四川省广安市代市高级中学2021-2022学年高二上学期第一次月考化学试卷(Word版含答案)
文档属性
| 名称 | 四川省广安市代市高级中学2021-2022学年高二上学期第一次月考化学试卷(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-18 16:16:53 | ||
图片预览



文档简介
广安市代市高级中学2021-2022学年高二上学期高二第1次月考
化学 试题
可能用到的相对原子质量:
H: 1 C:12 N: 14 O: 16 Na:23 Mg: 24 Al:27 Cl: 35.5
第一部分 选择题(共50分)
一、选择题(每小题只有1个选项符合题意,每小题2.5分,共50分。)
1.下列反应属于吸热反应的是( )
A. C6H12O6(葡萄糖aq)+6O2 6CO2+6H2O
B. CH3COOH+KOH CH3COOK+H2O
C. 反应物的总能量大于生成物的总能量
D.破坏反应物全部化学键所需能量大于破坏生成物全部化学键所需能量
2.已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是( )
A.吸热88kJ B. 吸热2.44KJ C.放热44kJ D. 吸热44KJ
3.已知:H2(g)+F2(g) === 2HF(g) △H=-270kJ,下列说法正确的是( )
A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量
4.相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)=== 2H2O(l) △H1= -Q1 kJ mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2 kJ mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H1= -Q3 kJ mol-1
则Q1、Q2、Q3的关系表示正确的是( )
A. Q1=Q2 Q1 >Q3 C. Q3> Q2> Q1 D. Q1=Q2=Q3
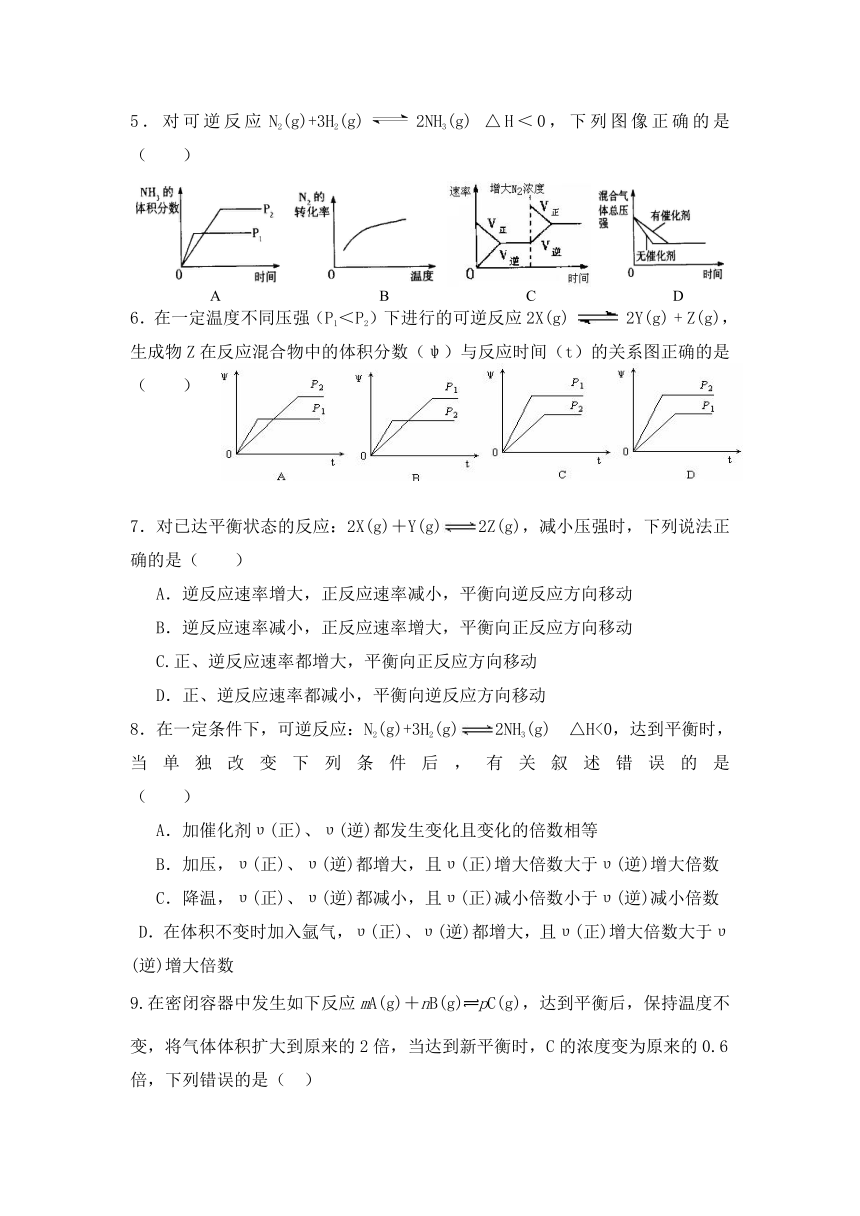
5.对可逆反应N2(g)+3H2(g)2NH3(g) △H<0,下列图像正确的是 ( )
6.在一定温度不同压强(P1<P2)下进行的可逆反应2X(g) 2Y(g) + Z(g),生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系图正确的是 ( )
7.对已达平衡状态的反应:2X(g)+Y(g)2Z(g),减小压强时,下列说法正确的是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都增大,平衡向正反应方向移动
D.正、逆反应速率都减小,平衡向逆反应方向移动
8.在一定条件下,可逆反应:N2(g)+3H2(g)2NH3(g) △H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是 ( )
A.加催化剂υ(正)、υ(逆)都发生变化且变化的倍数相等
B.加压,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数
C.降温,υ(正)、υ(逆)都减小,且υ(正)减小倍数小于υ(逆)减小倍数
D.在体积不变时加入氩气,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数
9.在密闭容器中发生如下反应mA(g)+nB(g)pC(g),达到平衡后,保持温度不变,将气体体积扩大到原来的2倍,当达到新平衡时,C的浓度变为原来的0.6倍,下列错误的是( )
A.C的体积分数增加 B.平衡向正反应方向移动
C.A的转化率提高 D.m+n>p
10.二氧化氮能形成二聚分子:2NO2(g) N2O4(g),ΔH<0。现欲测定二氧化氮的相对分子质量,应采用的适宜条件为 ( )
A.高温低压 B.低温高压 C.低温低压 D.高温高压
11.对平衡CO2(g)CO2(aq) △H= -19.75 kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是 ( )
A.升温增压 B.降温减压 C.升温减压 D.降温增压
12.下列对化学平衡移动的分析中,不正确的是 ( )
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应达平衡时,若减小体积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
13.现有3个体积相等的密闭容器,都进行下列反应:CO2(g)+H2(g) H2O(g)+CO(g),
反应所处的温度相同,但起始浓度不同。其中甲:CO2 = H2 = a mol;乙:CO2 = a mol,
H2 = 2a mol;丙:CO2 =H2 =H2O(g)= a mol。达到平衡时,CO的物质的量由大到小的顺序
是 ( )
A.甲>乙>丙 B.甲>丙>乙 C.乙>丙>甲 D.乙>甲>丙
14.对可逆反应:A(g) + B(s) C(s) + D(g) ΔH>0 ,左下图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示的条件改变的是 ( )
A.②③ B.①②
C.③④ D.④⑤
15.某温度下,可逆反应mA(g)+nB(g)pC(g)的平衡常数为K,下列对K的说法正确的是
( )
A.K值越大,表明该反应越有利于C的生成,反应物的转化率越大
B.若缩小反应器的容积,能使平衡正向移动,则K增大
C.温度越高,K一定越大
D.如果m+n=p,则K=1
16.将4 mol SO2与2 mol O2放入4 L的密闭容器中,在一定条件下反应达到平衡:2SO2+O22SO3,测得平衡时SO3的浓度为0.5 mol·L-1。则此条件下的平衡常数K为( )
A.4 B.0.25 C.0.4 D.0.2
17.在淀粉 KI溶液中存在下列平衡:I2(aq)+I-(aq) I(aq)。测得不同温度下该反应的平衡常数K如表所示:
t/℃ 5 15 25 35 50
K 1 100 841 689 533 409
下列说法正确的是 ( )
A.反应I2(aq)+I-(aq) I(aq)的ΔH>0
B.其他条件不变,升高温度,溶液中c(I)减小
C.该反应的平衡常数表达式为K=
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689
18.某可逆反应正向反应过程中能量变化如图所示,下列说法正确的是( )
A.该反应为吸热反应
B.当反应达到平衡时,降低温度,A的转化率减小
C.升高温度平衡常数K增大;压强增大,平衡向正反应方向移动
D.加入催化剂,反应速率增大,E1减小,E2减小,反应热不变
19.已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是 ( )
A.反应①的平衡常数K1=
B.反应③的平衡常数K=
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
20. 如下图所示,△H1=-393.5 kJ mol-1,△H2=-395.4 kJ mol-1,下列说法或表示式正确的是( )
A. C(s、石墨)== C(s、金刚石) △H= -1.9 kJ mol-1
B. 石墨和金刚石的转化是物理变化
C. 石墨的稳定性强于金刚石
D. 1 mol石墨的总能量比1 mol金刚石的总能量大
第二部分 非选择题(共50分)
21.(每空2分,共12分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”)
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
22.(每空2分,共8分)高炉炼铁中发生的反应有:FeO(s) + CO(g)==Fe(s) + CO2(g) △H < 0
(1) 该反应的平衡常数表达式K=____________
(2) 已知1100℃时,K=0.263温度升高,平衡常数K_______(增大,减少或不变)
(3) 1100℃时,测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应是否处于平衡状态______(填是或否),此时反应速率是v正_____v逆(填>,<,=)
23、(每空1分,共4分)在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
⑴该反应化学平衡常数的表达式:K= ;
⑵该反应为 (填“吸热”或“放热”)反应;
⑶下列说法中能说明该反应达平衡状态的是
A、容器中压强不变 B、混合气体中c(CO)不变
C、混合气体的密度不变 D、c(CO) = c(CO2)
E、化学平衡常数K不变 F、单位时间内生成CO的分子数与生成H2O的分子数相等
⑷某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为 。
24.(每空1分,共7分)反应A(g)+B(g)C(g) +D(g)过程中的能量变化如图所示。回答下列问题。
(1)该反应是____________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率______(填增大”“减小”或“不变”),原因是 。
(3)反应体系中加入催化剂对反应热是否有影响?___________,原因是 。
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小”或“不变”)。
25.(共6分)把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
请回答下列问题:
(1) 途径I放出的热量 (1分) ( 填“大于”“等于”或“小于”) 途径II放出的热量,原因是 (1分)。
(2) △H1、△H2、△H3、△H4的数学关系式是 (1分)。
(3)12g 炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为
(2分)。
(4)煤炭作为燃料采用途径II的优点有 (1分)。
26.(每空1分,共8分)在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ mol-1表示。请认真观察下图,然后回答问题。
(1)图中反应是 (填“吸热”或“放热”)反应,
该反应 (填“需要”或“不需要”)环境先提供能
量,该反应的△H= (用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g) === H2O(g)
△H= -241.8kJ mol-1,该反应的活化能为167.2 kJ mol-1,则其逆反应的活化能为 。
(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能 ,单位体积内活化分子的百分数 ,因此反应速率 ,你认为最可能的原因是 。
27.(每空1分,共5分)某化学反应2A==B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验序号 温度/℃ 0 10 20 30 40 50 60
1 800 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800 c1 0.60 0.50 0.50 0.50 0.50 0.50
3 800 c2 0.92 0.75 0.63 0.60 0.60 0.60
4 820 1.0 0.40 0.25 0.20 0.20 0.20 0.20
根据上述数据,完成下列填空。
(1)在实验1,反应在l0 min至20 min时间内应物A平均速率为_____________mol/(L·min)。
(2)在实验2中,A的初始浓度c1=_________mol/L。实验2中还隐含的条件是 。
(3)设实验3中c2_________1.0 mol/L (填“>”“=”或“<”)。
(4)比较实验4和实验1,可推知该反应是_________________反应(填“吸热”或“放热”)。
化学答案
一,选择题。
B.D 2.B 3.C 4.B 5.C 6.B 7.D 8.D 9.D 10.C
11.D 12.D 13.D 14.A 15.A 16.A 17.B 18.D 19.B 20.C
二,填空题。
21.(1)环形玻璃搅拌棒 (2)减少实验过程中的热量损失 (3)偏小
(4)不相等;相等; (5)偏小
22.(1)K= (2)减小 (3) 否 >
23. (1)K= (2)吸热 (3)B (4)830℃
24 (1)放热 (2)减小 升温,平衡逆向移动 (3)无影响 催化剂只改变反应速率,对反应热无影响 (4)减小 减小
25(1)等于 反应热只与反应体系的始态和终态有关,与反应途径无关。
(2)△H1=△H2+(△H3+△H4) (3)
(4)燃料燃烧充分,利用率高,放热多,污染小等。
26(1)放热 需要 E2— E1 (2)409.0kJ mol-1 (3)降低 增多 加快 使用了催化剂
27.(1)0.013 (2)1.0 使用了催化剂 (3) > (4)吸热
A B C D
化学 试题
可能用到的相对原子质量:
H: 1 C:12 N: 14 O: 16 Na:23 Mg: 24 Al:27 Cl: 35.5
第一部分 选择题(共50分)
一、选择题(每小题只有1个选项符合题意,每小题2.5分,共50分。)
1.下列反应属于吸热反应的是( )
A. C6H12O6(葡萄糖aq)+6O2 6CO2+6H2O
B. CH3COOH+KOH CH3COOK+H2O
C. 反应物的总能量大于生成物的总能量
D.破坏反应物全部化学键所需能量大于破坏生成物全部化学键所需能量
2.已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是( )
A.吸热88kJ B. 吸热2.44KJ C.放热44kJ D. 吸热44KJ
3.已知:H2(g)+F2(g) === 2HF(g) △H=-270kJ,下列说法正确的是( )
A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量
4.相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)=== 2H2O(l) △H1= -Q1 kJ mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2 kJ mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H1= -Q3 kJ mol-1
则Q1、Q2、Q3的关系表示正确的是( )
A. Q1=Q2
5.对可逆反应N2(g)+3H2(g)2NH3(g) △H<0,下列图像正确的是 ( )
6.在一定温度不同压强(P1<P2)下进行的可逆反应2X(g) 2Y(g) + Z(g),生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系图正确的是 ( )
7.对已达平衡状态的反应:2X(g)+Y(g)2Z(g),减小压强时,下列说法正确的是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都增大,平衡向正反应方向移动
D.正、逆反应速率都减小,平衡向逆反应方向移动
8.在一定条件下,可逆反应:N2(g)+3H2(g)2NH3(g) △H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是 ( )
A.加催化剂υ(正)、υ(逆)都发生变化且变化的倍数相等
B.加压,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数
C.降温,υ(正)、υ(逆)都减小,且υ(正)减小倍数小于υ(逆)减小倍数
D.在体积不变时加入氩气,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数
9.在密闭容器中发生如下反应mA(g)+nB(g)pC(g),达到平衡后,保持温度不变,将气体体积扩大到原来的2倍,当达到新平衡时,C的浓度变为原来的0.6倍,下列错误的是( )
A.C的体积分数增加 B.平衡向正反应方向移动
C.A的转化率提高 D.m+n>p
10.二氧化氮能形成二聚分子:2NO2(g) N2O4(g),ΔH<0。现欲测定二氧化氮的相对分子质量,应采用的适宜条件为 ( )
A.高温低压 B.低温高压 C.低温低压 D.高温高压
11.对平衡CO2(g)CO2(aq) △H= -19.75 kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是 ( )
A.升温增压 B.降温减压 C.升温减压 D.降温增压
12.下列对化学平衡移动的分析中,不正确的是 ( )
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应达平衡时,若减小体积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
13.现有3个体积相等的密闭容器,都进行下列反应:CO2(g)+H2(g) H2O(g)+CO(g),
反应所处的温度相同,但起始浓度不同。其中甲:CO2 = H2 = a mol;乙:CO2 = a mol,
H2 = 2a mol;丙:CO2 =H2 =H2O(g)= a mol。达到平衡时,CO的物质的量由大到小的顺序
是 ( )
A.甲>乙>丙 B.甲>丙>乙 C.乙>丙>甲 D.乙>甲>丙
14.对可逆反应:A(g) + B(s) C(s) + D(g) ΔH>0 ,左下图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示的条件改变的是 ( )
A.②③ B.①②
C.③④ D.④⑤
15.某温度下,可逆反应mA(g)+nB(g)pC(g)的平衡常数为K,下列对K的说法正确的是
( )
A.K值越大,表明该反应越有利于C的生成,反应物的转化率越大
B.若缩小反应器的容积,能使平衡正向移动,则K增大
C.温度越高,K一定越大
D.如果m+n=p,则K=1
16.将4 mol SO2与2 mol O2放入4 L的密闭容器中,在一定条件下反应达到平衡:2SO2+O22SO3,测得平衡时SO3的浓度为0.5 mol·L-1。则此条件下的平衡常数K为( )
A.4 B.0.25 C.0.4 D.0.2
17.在淀粉 KI溶液中存在下列平衡:I2(aq)+I-(aq) I(aq)。测得不同温度下该反应的平衡常数K如表所示:
t/℃ 5 15 25 35 50
K 1 100 841 689 533 409
下列说法正确的是 ( )
A.反应I2(aq)+I-(aq) I(aq)的ΔH>0
B.其他条件不变,升高温度,溶液中c(I)减小
C.该反应的平衡常数表达式为K=
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689
18.某可逆反应正向反应过程中能量变化如图所示,下列说法正确的是( )
A.该反应为吸热反应
B.当反应达到平衡时,降低温度,A的转化率减小
C.升高温度平衡常数K增大;压强增大,平衡向正反应方向移动
D.加入催化剂,反应速率增大,E1减小,E2减小,反应热不变
19.已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是 ( )
A.反应①的平衡常数K1=
B.反应③的平衡常数K=
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
20. 如下图所示,△H1=-393.5 kJ mol-1,△H2=-395.4 kJ mol-1,下列说法或表示式正确的是( )
A. C(s、石墨)== C(s、金刚石) △H= -1.9 kJ mol-1
B. 石墨和金刚石的转化是物理变化
C. 石墨的稳定性强于金刚石
D. 1 mol石墨的总能量比1 mol金刚石的总能量大
第二部分 非选择题(共50分)
21.(每空2分,共12分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”)
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
22.(每空2分,共8分)高炉炼铁中发生的反应有:FeO(s) + CO(g)==Fe(s) + CO2(g) △H < 0
(1) 该反应的平衡常数表达式K=____________
(2) 已知1100℃时,K=0.263温度升高,平衡常数K_______(增大,减少或不变)
(3) 1100℃时,测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应是否处于平衡状态______(填是或否),此时反应速率是v正_____v逆(填>,<,=)
23、(每空1分,共4分)在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
⑴该反应化学平衡常数的表达式:K= ;
⑵该反应为 (填“吸热”或“放热”)反应;
⑶下列说法中能说明该反应达平衡状态的是
A、容器中压强不变 B、混合气体中c(CO)不变
C、混合气体的密度不变 D、c(CO) = c(CO2)
E、化学平衡常数K不变 F、单位时间内生成CO的分子数与生成H2O的分子数相等
⑷某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为 。
24.(每空1分,共7分)反应A(g)+B(g)C(g) +D(g)过程中的能量变化如图所示。回答下列问题。
(1)该反应是____________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率______(填增大”“减小”或“不变”),原因是 。
(3)反应体系中加入催化剂对反应热是否有影响?___________,原因是 。
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小”或“不变”)。
25.(共6分)把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
请回答下列问题:
(1) 途径I放出的热量 (1分) ( 填“大于”“等于”或“小于”) 途径II放出的热量,原因是 (1分)。
(2) △H1、△H2、△H3、△H4的数学关系式是 (1分)。
(3)12g 炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为
(2分)。
(4)煤炭作为燃料采用途径II的优点有 (1分)。
26.(每空1分,共8分)在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ mol-1表示。请认真观察下图,然后回答问题。
(1)图中反应是 (填“吸热”或“放热”)反应,
该反应 (填“需要”或“不需要”)环境先提供能
量,该反应的△H= (用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g) === H2O(g)
△H= -241.8kJ mol-1,该反应的活化能为167.2 kJ mol-1,则其逆反应的活化能为 。
(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能 ,单位体积内活化分子的百分数 ,因此反应速率 ,你认为最可能的原因是 。
27.(每空1分,共5分)某化学反应2A==B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验序号 温度/℃ 0 10 20 30 40 50 60
1 800 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800 c1 0.60 0.50 0.50 0.50 0.50 0.50
3 800 c2 0.92 0.75 0.63 0.60 0.60 0.60
4 820 1.0 0.40 0.25 0.20 0.20 0.20 0.20
根据上述数据,完成下列填空。
(1)在实验1,反应在l0 min至20 min时间内应物A平均速率为_____________mol/(L·min)。
(2)在实验2中,A的初始浓度c1=_________mol/L。实验2中还隐含的条件是 。
(3)设实验3中c2_________1.0 mol/L (填“>”“=”或“<”)。
(4)比较实验4和实验1,可推知该反应是_________________反应(填“吸热”或“放热”)。
化学答案
一,选择题。
B.D 2.B 3.C 4.B 5.C 6.B 7.D 8.D 9.D 10.C
11.D 12.D 13.D 14.A 15.A 16.A 17.B 18.D 19.B 20.C
二,填空题。
21.(1)环形玻璃搅拌棒 (2)减少实验过程中的热量损失 (3)偏小
(4)不相等;相等; (5)偏小
22.(1)K= (2)减小 (3) 否 >
23. (1)K= (2)吸热 (3)B (4)830℃
24 (1)放热 (2)减小 升温,平衡逆向移动 (3)无影响 催化剂只改变反应速率,对反应热无影响 (4)减小 减小
25(1)等于 反应热只与反应体系的始态和终态有关,与反应途径无关。
(2)△H1=△H2+(△H3+△H4) (3)
(4)燃料燃烧充分,利用率高,放热多,污染小等。
26(1)放热 需要 E2— E1 (2)409.0kJ mol-1 (3)降低 增多 加快 使用了催化剂
27.(1)0.013 (2)1.0 使用了催化剂 (3) > (4)吸热
A B C D
同课章节目录
