生活中的含氮化合物(一)—氮的氧化物和硝酸课件_苏教版
文档属性
| 名称 | 生活中的含氮化合物(一)—氮的氧化物和硝酸课件_苏教版 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-26 22:14:25 | ||
图片预览










文档简介
(共56张PPT)
游离态
化合态氮
高能
生物
仿生
4/5
N≡N
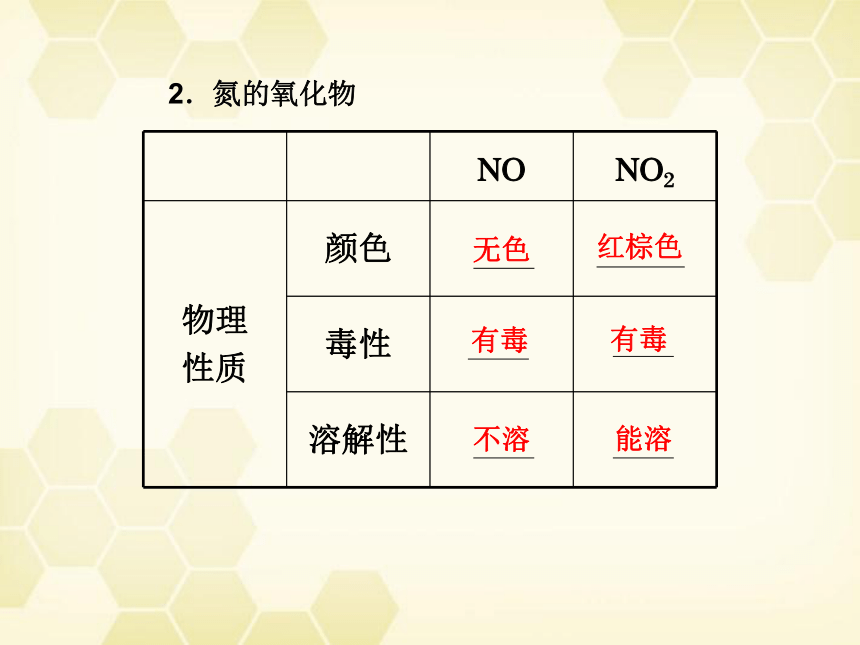
NO NO2
物理
性质 颜色
毒性
溶解性
无色
红棕色
有毒
有毒
不溶
能溶
2.氮的氧化物
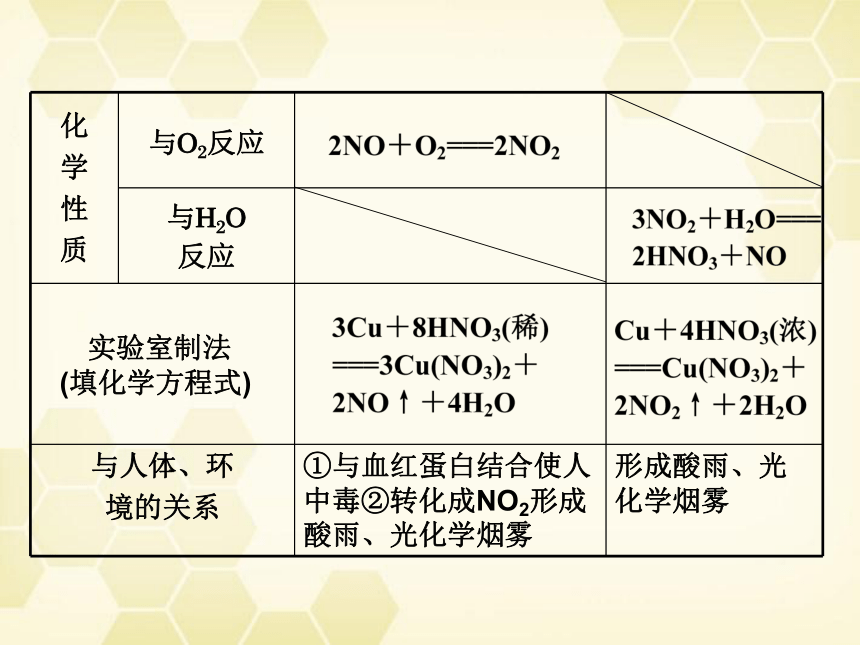
化
学
性
质 与O2反应
与H2O
反应
与人体、环
境的关系 ①与血红蛋白结合使人中毒②转化成NO2形成酸雨、光化学烟雾 形成酸雨、光化学烟雾
实验室制法
(填化学方程式)
无色有刺激性气味的液体
易挥发
与水以任意比互溶
质量分数大于98%的硝酸
红
红
HNO3分解产生的 NO2
溶解在硝酸中
不稳定
4HNO3====4NO2↑+O2↑+2H2O
或见光
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
钝化
C+4HNO3(浓)=====CO2↑+4NO2↑+2H2O
△
浓硝酸
浓盐酸
提示 浓硝酸常呈黄色是因为HNO3分解生成NO2
溶于HNO3中,去掉黄色的方法是通入少量O2(空气),
使其发生反应:4NO2+O2+2H2O===4HNO3。
思考 2 “浓HNO3与Cu反应产生NO2,稀HNO3与Cu反应产生NO,则稀HNO3氧化性强。”这种说法对吗?为什么?
A
A
×
√
×
解析 NO2通入溶液中生成HNO3,能把Fe2+氧
化成Fe3+,溶液由浅绿色变成棕黄色。
解析 电荷不守恒,应为2OH-+3NO2
===2NO +NO↑+H2O。
×
×
解析 氮氧化合物与灼热铜粉反应的化学方程式为2NOx+2xCu====2xCuO+N2。根据题目给定的数据可判断氮氧化合物为NO2。
A
答案 C
答案 D
用手捂热试管a,导管
口会有气泡冒出,松开手后,水又会回升到导管b中
有气泡冒出,溶液
变蒸汽
有气泡从管口冒出
水进入试管,上升到一定高度
返回
游离态
化合态氮
高能
生物
仿生
4/5
N≡N
NO NO2
物理
性质 颜色
毒性
溶解性
无色
红棕色
有毒
有毒
不溶
能溶
2.氮的氧化物
化
学
性
质 与O2反应
与H2O
反应
与人体、环
境的关系 ①与血红蛋白结合使人中毒②转化成NO2形成酸雨、光化学烟雾 形成酸雨、光化学烟雾
实验室制法
(填化学方程式)
无色有刺激性气味的液体
易挥发
与水以任意比互溶
质量分数大于98%的硝酸
红
红
HNO3分解产生的 NO2
溶解在硝酸中
不稳定
4HNO3====4NO2↑+O2↑+2H2O
或见光
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
钝化
C+4HNO3(浓)=====CO2↑+4NO2↑+2H2O
△
浓硝酸
浓盐酸
提示 浓硝酸常呈黄色是因为HNO3分解生成NO2
溶于HNO3中,去掉黄色的方法是通入少量O2(空气),
使其发生反应:4NO2+O2+2H2O===4HNO3。
思考 2 “浓HNO3与Cu反应产生NO2,稀HNO3与Cu反应产生NO,则稀HNO3氧化性强。”这种说法对吗?为什么?
A
A
×
√
×
解析 NO2通入溶液中生成HNO3,能把Fe2+氧
化成Fe3+,溶液由浅绿色变成棕黄色。
解析 电荷不守恒,应为2OH-+3NO2
===2NO +NO↑+H2O。
×
×
解析 氮氧化合物与灼热铜粉反应的化学方程式为2NOx+2xCu====2xCuO+N2。根据题目给定的数据可判断氮氧化合物为NO2。
A
答案 C
答案 D
用手捂热试管a,导管
口会有气泡冒出,松开手后,水又会回升到导管b中
有气泡冒出,溶液
变蒸汽
有气泡从管口冒出
水进入试管,上升到一定高度
返回
