人教版(五四制)九年级全一册化学 第二单元 课题1 溶液的形成(课件)(37张PPT)
文档属性
| 名称 | 人教版(五四制)九年级全一册化学 第二单元 课题1 溶液的形成(课件)(37张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-18 14:59:47 | ||
图片预览











文档简介
(共37张PPT)
新课导入
在约旦和巴勒斯坦交界处有一个内陆湖 ,湖中没有水生植物和鱼类,岸边寸草不生,人们把它称为“死海”。
传说许多年前,罗马帝国的军队来到“死海” ,他们把几个俘虏捆绑起来扔进湖里处死。没想到几个俘虏不仅没有淹死,反而被湖里的波浪送回到岸边。
你知道是什么原因吗?让我们走进溶液,探索其中的奥秘吧!
第九单元 溶液
课题1 溶液的形成
1.认识溶解现象,知道溶液、溶剂、溶质等概念;了解溶液在生活生产和科学研究中的广泛用途
2.理解影响溶质溶解的因素。
学习目标
海洋是巨大的资源宝库,其中含有80多种元素
海水是纯净物,还是混合物呢?
生活中的溶液
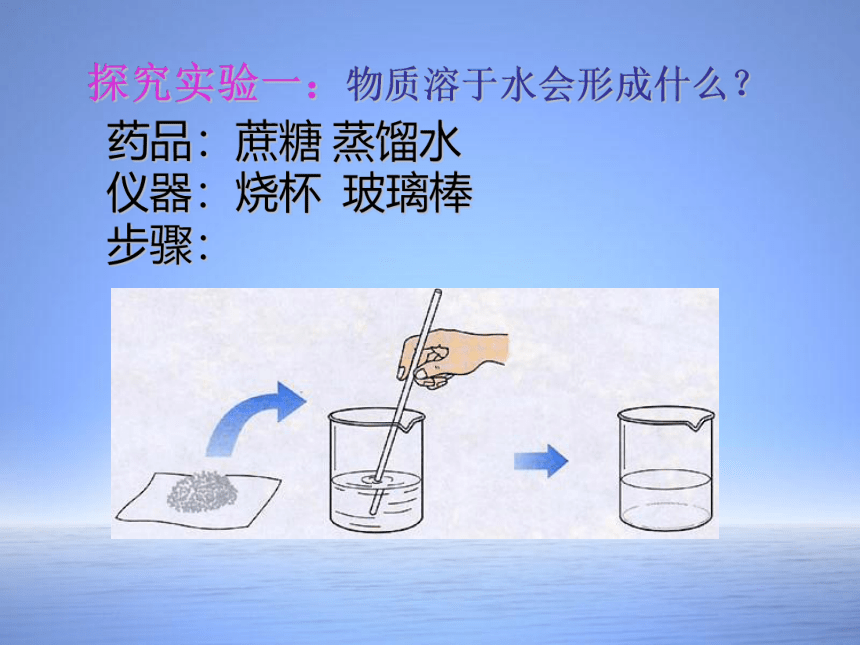
药品:蔗糖 蒸馏水
仪器:烧杯 玻璃棒
步骤:
探究实验一:物质溶于水会形成什么?
思考
1、蔗糖、氯化钠放入水中,你还能不能凭肉眼看到它们的粒子呢?形成的物质是纯净物还是混合物?
2、溶液是否都是无色的?
3、如果取出一部分,剩下的和取出的浓稀程度是否一样?如不考虑水分蒸发,长期放置是否会分层?
一、溶液
(1)概念:一种或几种物质分散到另一种物质里,形成均匀的、稳定的混合物,叫做溶液。
(2)特征:均一、稳定。
均一是指溶液中任意一部分的组成和性质完全相同。
稳定是指外界条件不变时(温度、溶剂量、气体压强等),溶质不会从溶剂中分离出来。
(3)组成:由溶质和溶剂两部分组成
溶质:被溶解的物质,可是固体、气体或液体。
溶剂:能溶解其他物质的物质,水是最常见的溶剂。
溶液质量=溶质质量+溶剂质量
—某某(溶质)的某某(溶剂)的溶液
讨论:溶液中溶质和溶剂是如何确定的
体系 溶质 溶剂
气+液
固+液
液+液
无水
有水
气体
液体
固体
液体
量少
量多
非水物
水
练习:
指出下列溶液中溶质、溶剂各是什么?
溶质 溶剂
(1)硫酸铜溶液
(2)稀硫酸
(3)75%的医用酒精
(4)油脂溶解在汽油里
(5)白磷的二硫化碳溶液
(6)盐酸
CuSO4
水
H2SO4
水
C2H5OH
水
油脂
汽油
白磷
二硫化碳
HCl
水
水是最常见的溶剂,汽油、酒精等也可以作为溶剂,相同溶质在不同溶剂里的溶解程度是否相同呢?反过来说,不同溶质在相同溶剂里的溶解程度是否相同呢?
思考
实验探究二:影响物质溶解性的因素有哪些?
A.在两支试管中各加入2mL~3mL水,分别加入1~2小粒碘或高锰酸钾;另取两支试管各加入2mL~3mL汽油,再分别加入1~2小粒碘或高锰酸钾。振荡,观察现象。
实验现象纪录
溶剂 溶质 现象
水 碘
汽油 碘
水 高锰酸钾
汽油 高锰酸钾
几乎不溶(溶液黄色)
溶解,溶液棕色
溶解,溶液紫红色
几乎不溶
物质的溶解性不仅与溶质有关,还与溶剂的性质有关。
B.在两只形状大小相同,水量相等但水温不同的烧杯中放入两块形状大小质量完全相硫酸铜。仔细观察硫酸铜在水中的溶解状况并将相关数据记录在记录表中。
C.两只形状大小相同、水量相等的烧杯中放入两块颗粒大小不一的硫酸铜。仔细观察硫酸铜在水中的溶解状况并将相关数据记录在记录表中。
D.在两只形状大小相同、水量相等的烧杯中放入颗粒粗细相同的硫酸铜,一个搅拌另一个不搅拌。仔细观察食盐在水中的溶解速度并将相关数据记录在记录表中。
实验现象记录:
项 目 对比实验条件 实 验 现 象
实验B 相同条件 硫酸铜的质量和颗粒大小都相同、都不搅拌;水的质量也相同。
不同条件 水的温度不同
实验C 相同条件 水的质量、水的温度、都不搅拌、硫酸铜的质量
不同条件 硫酸铜的颗粒大小
实验D 相同条件 硫酸铜的颗粒大小和质量;水的温度和质量。
不同条件 是否搅拌
热水中硫酸铜溶解的快
搅拌的硫酸铜溶解的快
颗粒小的硫酸铜溶解速度快
研细、升温、搅拌能加速物质在水中的溶解
实验探究三:物质溶解时的热量变化
现有试管、烧杯、玻璃棒,温度计等仪器和固态NaCl、NH4NO3 、NaOH(你还可以选用其它仪器及药品),试设计实验方案,探究它们溶解于水时是放出热量还是吸收热量。
实验现象纪录
水中加入的溶质 NaCl NH4NO3 NaOH
加入溶质前水的温度/℃
溶解现象
结论
10 ℃
温度基本不变
温度降低
温度升高
溶解时可能吸热,也可能放热
三、溶解时的吸热和放热现象
(1)溶质分散到溶剂中形成溶液的过程中,发生了两种变化。
①扩散过程:溶质的分子(或离子)向水中扩散,吸收热量;
②水合过程:溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),放出热量。
(2)溶解过程中温度变化。
①扩散过程中吸收热量>水合过程放出热量,溶液温度降低
②扩散过程吸收热量<水合过程中放出热量,溶液温度升高
③扩散过程吸收热量=水合过程放出热量,溶液温度不变
溶于水有显著吸热现象的物质:
NH4Cl NH4NO3 (带有NH4+的物质)等
溶于水有显著放热现象的物质:
NaOH KOH H2SO4 CaO等
小知识
探究实验四:溶液的导电性
解释
如果溶液中有可以移动的离子,该溶液能导电。反之,溶液中没有可以移动的离子,该溶液便不能导电。
结 论
溶液在我们的日常生活中有许多重要的用途,请你谈一谈。
在溶液里进行的化学反应通常是比较快的。
动物摄取食物里的养分,必须经过消化,变成溶液,才能吸收。
在医疗上用的葡萄糖溶液和生理盐水、医治细菌感染引起的各种炎症的注射液(如庆大霉素、卡那霉素)、各种眼药水等,都是按一定的要求配成溶液使用的 。
植物从土壤里获得各种养料,也要成为溶液,才能由根部吸收 。
溶质
被溶解
的物质
一种或几
种物质
分散
另一种物质
溶剂
均匀、稳定
的混合物
溶 液
能溶解其他
物质的物质
本节课我们学到了什么
溶剂的确定?
物质溶解时的热现象和影响溶解的几个因素。
什么样的溶液可以导电?
典例精析
[例1] 下列关于溶液的叙述,正确的是 ( )
A.凡是均一的、稳定的、澄清的、透明的液体一定是溶液
B.当外界条件不变时,溶液不论放置多长时间,溶质也不会从溶剂中分离出来
C.一种溶液上面部分和下面部分所含的溶质是不同的
D.溶质和溶剂混合时开始是混合物,等到溶质,全部溶解后就变成纯净的、透明的纯净物了
B
[例2] 下列物质充分混合后所得混合物是否为溶液 是溶液的写出溶质的化学式。
(1)碳酸钙溶于过量的稀盐酸
(2)二氧化碳与适量石灰水恰好完全反应
(3)NaOH溶液与CuSO4溶液混合恰好完全反应
CaCl2、 HCl
Na2SO4
[例3] 下列说法正确的是 ( )
A.溶液一定是液体
B.空气也是溶液
C.40mL酒精跟60mL水混合一定得到100mL溶液
D.盐水是溶液,糖水是溶液,两者混在一起,既有糖又有盐,则不是溶液了。
B
[例4] 如右图所示,向小试管中分别加入下列一定量的物质,右侧U形管中液面未发生明显变化,该物质是 ( )
A.氢氧化钠固体
B.浓硫酸
C.硝酸铵晶体
D.氯化钠晶体
D
水分子
Na+
Cl -
氯化钠晶体
蔗糖晶体
糖分子
物质的溶解过程
电离:物质溶解于水时离解成自由移动的离子的过程叫做电离。
用电离方程式表示:
NaCl = Na+ + Cl-
H2SO4 = 2H+ + SO42-
阴、阳离子所带的电荷总数相等;等号前后各元素的离子个数相等
解释
1.溶液的基本特征是什么?
2.把10gCuSO4完全溶于90g水中,
组成 g 溶液,
其溶质的质量分数为 。
3.把几滴花生油放入10mL水中,充分振荡,能组成溶液吗?为什么?
探究实验:洗涤剂在清洗油污时起的作用是什么?
取两只试管,分别放入2~3mL水,再滴入几滴植物油;
向其中一支试管中滴入几滴洗涤剂,振荡,观察现象;
静置,观察现象;
清洗,观察现象。
试管内加入的物质 现象 把液体到掉后试管是否干净
振荡前 振荡后 静置后
水和植物油
水和植物油和洗涤剂
分层
分层
浑浊
浑浊
分层
不分层
不干净
干净
植物油在水中形成的混合物的特点是什么?为什么加了洗涤剂的乳浊液可以稳定存在?
一.乳浊液:
定义:由小液滴分散在液体里形成的混合物。
特征:不均匀、不稳定(静置后分层)
二.乳化剂和乳化作用
1.乳化剂:能使乳浊液稳定的物质
如:洗涤剂、洗发精
洗涤剂有乳化的功能,它能使植物油分散成无数细小的液滴,而不聚成大油珠,以加了洗涤剂的乳浊液可以稳定存在。
2.乳化作用:乳化剂所起的作用。
经乳化作用形成的乳浊液,液体稳定,
不再分层,但不是溶液。
洗涤剂洗掉油污是什么变化
不同点
共同点
举例
分散微粒 静止后
现象 分散特征
溶液
悬浊液
乳浊液
离子或分子
固体小颗粒
液体小液滴
不分层不沉淀无明显变化
产生沉淀
产生分层
均匀的稳定的
不均匀的不稳定的
不均匀的不稳定的
混合物
食盐熔于水
粉笔灰放到水里
汽油放到水里
新课导入
在约旦和巴勒斯坦交界处有一个内陆湖 ,湖中没有水生植物和鱼类,岸边寸草不生,人们把它称为“死海”。
传说许多年前,罗马帝国的军队来到“死海” ,他们把几个俘虏捆绑起来扔进湖里处死。没想到几个俘虏不仅没有淹死,反而被湖里的波浪送回到岸边。
你知道是什么原因吗?让我们走进溶液,探索其中的奥秘吧!
第九单元 溶液
课题1 溶液的形成
1.认识溶解现象,知道溶液、溶剂、溶质等概念;了解溶液在生活生产和科学研究中的广泛用途
2.理解影响溶质溶解的因素。
学习目标
海洋是巨大的资源宝库,其中含有80多种元素
海水是纯净物,还是混合物呢?
生活中的溶液
药品:蔗糖 蒸馏水
仪器:烧杯 玻璃棒
步骤:
探究实验一:物质溶于水会形成什么?
思考
1、蔗糖、氯化钠放入水中,你还能不能凭肉眼看到它们的粒子呢?形成的物质是纯净物还是混合物?
2、溶液是否都是无色的?
3、如果取出一部分,剩下的和取出的浓稀程度是否一样?如不考虑水分蒸发,长期放置是否会分层?
一、溶液
(1)概念:一种或几种物质分散到另一种物质里,形成均匀的、稳定的混合物,叫做溶液。
(2)特征:均一、稳定。
均一是指溶液中任意一部分的组成和性质完全相同。
稳定是指外界条件不变时(温度、溶剂量、气体压强等),溶质不会从溶剂中分离出来。
(3)组成:由溶质和溶剂两部分组成
溶质:被溶解的物质,可是固体、气体或液体。
溶剂:能溶解其他物质的物质,水是最常见的溶剂。
溶液质量=溶质质量+溶剂质量
—某某(溶质)的某某(溶剂)的溶液
讨论:溶液中溶质和溶剂是如何确定的
体系 溶质 溶剂
气+液
固+液
液+液
无水
有水
气体
液体
固体
液体
量少
量多
非水物
水
练习:
指出下列溶液中溶质、溶剂各是什么?
溶质 溶剂
(1)硫酸铜溶液
(2)稀硫酸
(3)75%的医用酒精
(4)油脂溶解在汽油里
(5)白磷的二硫化碳溶液
(6)盐酸
CuSO4
水
H2SO4
水
C2H5OH
水
油脂
汽油
白磷
二硫化碳
HCl
水
水是最常见的溶剂,汽油、酒精等也可以作为溶剂,相同溶质在不同溶剂里的溶解程度是否相同呢?反过来说,不同溶质在相同溶剂里的溶解程度是否相同呢?
思考
实验探究二:影响物质溶解性的因素有哪些?
A.在两支试管中各加入2mL~3mL水,分别加入1~2小粒碘或高锰酸钾;另取两支试管各加入2mL~3mL汽油,再分别加入1~2小粒碘或高锰酸钾。振荡,观察现象。
实验现象纪录
溶剂 溶质 现象
水 碘
汽油 碘
水 高锰酸钾
汽油 高锰酸钾
几乎不溶(溶液黄色)
溶解,溶液棕色
溶解,溶液紫红色
几乎不溶
物质的溶解性不仅与溶质有关,还与溶剂的性质有关。
B.在两只形状大小相同,水量相等但水温不同的烧杯中放入两块形状大小质量完全相硫酸铜。仔细观察硫酸铜在水中的溶解状况并将相关数据记录在记录表中。
C.两只形状大小相同、水量相等的烧杯中放入两块颗粒大小不一的硫酸铜。仔细观察硫酸铜在水中的溶解状况并将相关数据记录在记录表中。
D.在两只形状大小相同、水量相等的烧杯中放入颗粒粗细相同的硫酸铜,一个搅拌另一个不搅拌。仔细观察食盐在水中的溶解速度并将相关数据记录在记录表中。
实验现象记录:
项 目 对比实验条件 实 验 现 象
实验B 相同条件 硫酸铜的质量和颗粒大小都相同、都不搅拌;水的质量也相同。
不同条件 水的温度不同
实验C 相同条件 水的质量、水的温度、都不搅拌、硫酸铜的质量
不同条件 硫酸铜的颗粒大小
实验D 相同条件 硫酸铜的颗粒大小和质量;水的温度和质量。
不同条件 是否搅拌
热水中硫酸铜溶解的快
搅拌的硫酸铜溶解的快
颗粒小的硫酸铜溶解速度快
研细、升温、搅拌能加速物质在水中的溶解
实验探究三:物质溶解时的热量变化
现有试管、烧杯、玻璃棒,温度计等仪器和固态NaCl、NH4NO3 、NaOH(你还可以选用其它仪器及药品),试设计实验方案,探究它们溶解于水时是放出热量还是吸收热量。
实验现象纪录
水中加入的溶质 NaCl NH4NO3 NaOH
加入溶质前水的温度/℃
溶解现象
结论
10 ℃
温度基本不变
温度降低
温度升高
溶解时可能吸热,也可能放热
三、溶解时的吸热和放热现象
(1)溶质分散到溶剂中形成溶液的过程中,发生了两种变化。
①扩散过程:溶质的分子(或离子)向水中扩散,吸收热量;
②水合过程:溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),放出热量。
(2)溶解过程中温度变化。
①扩散过程中吸收热量>水合过程放出热量,溶液温度降低
②扩散过程吸收热量<水合过程中放出热量,溶液温度升高
③扩散过程吸收热量=水合过程放出热量,溶液温度不变
溶于水有显著吸热现象的物质:
NH4Cl NH4NO3 (带有NH4+的物质)等
溶于水有显著放热现象的物质:
NaOH KOH H2SO4 CaO等
小知识
探究实验四:溶液的导电性
解释
如果溶液中有可以移动的离子,该溶液能导电。反之,溶液中没有可以移动的离子,该溶液便不能导电。
结 论
溶液在我们的日常生活中有许多重要的用途,请你谈一谈。
在溶液里进行的化学反应通常是比较快的。
动物摄取食物里的养分,必须经过消化,变成溶液,才能吸收。
在医疗上用的葡萄糖溶液和生理盐水、医治细菌感染引起的各种炎症的注射液(如庆大霉素、卡那霉素)、各种眼药水等,都是按一定的要求配成溶液使用的 。
植物从土壤里获得各种养料,也要成为溶液,才能由根部吸收 。
溶质
被溶解
的物质
一种或几
种物质
分散
另一种物质
溶剂
均匀、稳定
的混合物
溶 液
能溶解其他
物质的物质
本节课我们学到了什么
溶剂的确定?
物质溶解时的热现象和影响溶解的几个因素。
什么样的溶液可以导电?
典例精析
[例1] 下列关于溶液的叙述,正确的是 ( )
A.凡是均一的、稳定的、澄清的、透明的液体一定是溶液
B.当外界条件不变时,溶液不论放置多长时间,溶质也不会从溶剂中分离出来
C.一种溶液上面部分和下面部分所含的溶质是不同的
D.溶质和溶剂混合时开始是混合物,等到溶质,全部溶解后就变成纯净的、透明的纯净物了
B
[例2] 下列物质充分混合后所得混合物是否为溶液 是溶液的写出溶质的化学式。
(1)碳酸钙溶于过量的稀盐酸
(2)二氧化碳与适量石灰水恰好完全反应
(3)NaOH溶液与CuSO4溶液混合恰好完全反应
CaCl2、 HCl
Na2SO4
[例3] 下列说法正确的是 ( )
A.溶液一定是液体
B.空气也是溶液
C.40mL酒精跟60mL水混合一定得到100mL溶液
D.盐水是溶液,糖水是溶液,两者混在一起,既有糖又有盐,则不是溶液了。
B
[例4] 如右图所示,向小试管中分别加入下列一定量的物质,右侧U形管中液面未发生明显变化,该物质是 ( )
A.氢氧化钠固体
B.浓硫酸
C.硝酸铵晶体
D.氯化钠晶体
D
水分子
Na+
Cl -
氯化钠晶体
蔗糖晶体
糖分子
物质的溶解过程
电离:物质溶解于水时离解成自由移动的离子的过程叫做电离。
用电离方程式表示:
NaCl = Na+ + Cl-
H2SO4 = 2H+ + SO42-
阴、阳离子所带的电荷总数相等;等号前后各元素的离子个数相等
解释
1.溶液的基本特征是什么?
2.把10gCuSO4完全溶于90g水中,
组成 g 溶液,
其溶质的质量分数为 。
3.把几滴花生油放入10mL水中,充分振荡,能组成溶液吗?为什么?
探究实验:洗涤剂在清洗油污时起的作用是什么?
取两只试管,分别放入2~3mL水,再滴入几滴植物油;
向其中一支试管中滴入几滴洗涤剂,振荡,观察现象;
静置,观察现象;
清洗,观察现象。
试管内加入的物质 现象 把液体到掉后试管是否干净
振荡前 振荡后 静置后
水和植物油
水和植物油和洗涤剂
分层
分层
浑浊
浑浊
分层
不分层
不干净
干净
植物油在水中形成的混合物的特点是什么?为什么加了洗涤剂的乳浊液可以稳定存在?
一.乳浊液:
定义:由小液滴分散在液体里形成的混合物。
特征:不均匀、不稳定(静置后分层)
二.乳化剂和乳化作用
1.乳化剂:能使乳浊液稳定的物质
如:洗涤剂、洗发精
洗涤剂有乳化的功能,它能使植物油分散成无数细小的液滴,而不聚成大油珠,以加了洗涤剂的乳浊液可以稳定存在。
2.乳化作用:乳化剂所起的作用。
经乳化作用形成的乳浊液,液体稳定,
不再分层,但不是溶液。
洗涤剂洗掉油污是什么变化
不同点
共同点
举例
分散微粒 静止后
现象 分散特征
溶液
悬浊液
乳浊液
离子或分子
固体小颗粒
液体小液滴
不分层不沉淀无明显变化
产生沉淀
产生分层
均匀的稳定的
不均匀的不稳定的
不均匀的不稳定的
混合物
食盐熔于水
粉笔灰放到水里
汽油放到水里
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
