第六单元 课题3二氧化碳与一氧化碳(第二课时)课后练习—2021-2022学年九年级化学人教版上册(word版 含答案)
文档属性
| 名称 | 第六单元 课题3二氧化碳与一氧化碳(第二课时)课后练习—2021-2022学年九年级化学人教版上册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 200.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-18 17:54:36 | ||
图片预览


文档简介
2021——2022学年度人教版九年级化学上册 第六单元碳和碳的化合物
课题3二氧化碳与一氧化碳(第二课时)课后练习
一、选择题
1.下列除杂的方法正确的是(括号内的是杂质)
A.KClO3(KCl)—加热 B.空气(氧气)—加入硫燃烧
C.KMnO4(MnO2)—溶解、过滤、蒸发 D.CO2(CO)—点燃
2.除去CO中混有的少量CO2,采用的方法是
A.通入足量石灰水 B.通过灼热的CuO C.点燃 D.倾倒混合气体
3.某无色气体可能含有CO2、CO、H2中的一种或几种,依次进行以下实验(假设每步反应均完全进行);①通过赤热的炭层后,恢复到原状态,气体体积不变;②通过灼热的CuO时,固体变成红色;③通过白色CuSO4粉末时,粉末变成蓝色晶体;④通入澄清石灰水中,石灰水变浑浊。下列判断正确的是
A.原混合气体中一定含有CO2、CO、H2 B.原混合气体中一定没有CO2,一定含有H2和CO
C.原混合气体中一定含有H2和CO2,可能含有CO D.根据①④,可推断实验过程中一定有CO2生成
4.下列有关碳和碳的氧化物的说法中错误的是
A.二氧化碳的大量排放是导致酸雨的原因 B.用炭火取暖时应注意通风,防止一氧化碳中毒
C.木炭有还原性,常用来冶炼金属 D.金刚石和石墨物理性质不同,是因为构成它们的碳原子的排列方式不同
5.下列说法中正确的是
A.金刚石、石墨和C60都是由原子构成的,
B.用澄清石灰水鉴别一氧化碳和二氧化碳
C.除去二氧化碳气体中的一氧化碳可向混合气体通入足量氧气,然后点燃
D.向石蕊溶液中通入二氧化碳,溶液会变红,然后加热溶液,溶液变成无色
6.下列实验设计不能达到其对应实验目的的是
A.测定空气里氧气的含量 B.证明CO2密度比空气的大
C.检查装置的气密性 D.探究CO2溶于水生成酸
7.含有CO和H2的混合气体,其分子总数为n,当它们完全燃烧时,需要氧气的分子数为
A.0.5n B.n C.2n D.不能确定
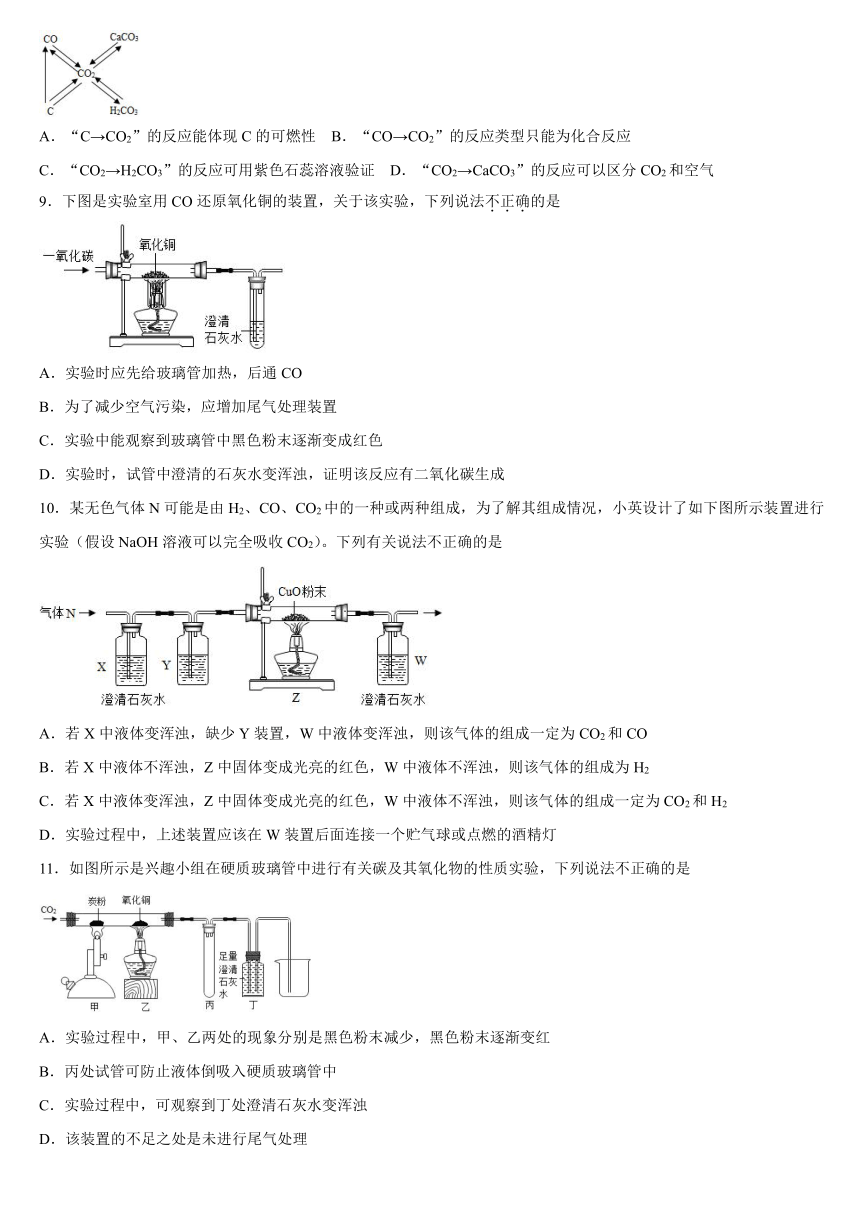
8.如图是关于碳和碳的化合物知识网络图(图中“→”表示转化关系,“﹣”表示相互能反应)。下列说法错误的是
A.“C→CO2”的反应能体现C的可燃性 B.“CO→CO2”的反应类型只能为化合反应
C.“CO2→H2CO3”的反应可用紫色石蕊溶液验证 D.“CO2→CaCO3”的反应可以区分CO2和空气
9.下图是实验室用CO还原氧化铜的装置,关于该实验,下列说法不正确的是
A.实验时应先给玻璃管加热,后通CO
B.为了减少空气污染,应增加尾气处理装置
C.实验中能观察到玻璃管中黑色粉末逐渐变成红色
D.实验时,试管中澄清的石灰水变浑浊,证明该反应有二氧化碳生成
10.某无色气体N可能是由H2、CO、CO2中的一种或两种组成,为了解其组成情况,小英设计了如下图所示装置进行实验(假设NaOH溶液可以完全吸收CO2)。下列有关说法不正确的是
A.若X中液体变浑浊,缺少Y装置,W中液体变浑浊,则该气体的组成一定为CO2和CO
B.若X中液体不浑浊,Z中固体变成光亮的红色,W中液体不浑浊,则该气体的组成为H2
C.若X中液体变浑浊,Z中固体变成光亮的红色,W中液体不浑浊,则该气体的组成一定为CO2和H2
D.实验过程中,上述装置应该在W装置后面连接一个贮气球或点燃的酒精灯
11.如图所示是兴趣小组在硬质玻璃管中进行有关碳及其氧化物的性质实验,下列说法不正确的是
A.实验过程中,甲、乙两处的现象分别是黑色粉末减少,黑色粉末逐渐变红
B.丙处试管可防止液体倒吸入硬质玻璃管中
C.实验过程中,可观察到丁处澄清石灰水变浑浊
D.该装置的不足之处是未进行尾气处理
12.将7.2克一氧化碳、二氧化碳的混合气体通过足量的灼热氧化铜充分反应后,再量的澄清石灰水充分反应,过滤,得到滤渣20克,则原混合物中氧元素的质量分数约是
A.33.3% B.50% C.62% D.66.7%
13.将一氧化碳和氢气的混合气体20g通过600g灼热的氧化铜粉末,充分反应后(气体全部发生反应),称量剩余固体质量为492g,则原混合气体中氢气的质量分数为
A.15% B.30% C.50% D.65%
14.N2、CO和CO2的混合气体50.0g,其中碳元素的质量分数为24%。使该混合气体依次通过:足量的CuO、过量的澄清石灰水,得到沉淀的质量为xg。下列说法错误的是
A.混合气体中含N2可能为24% B.混合气体中CO质量一定≤28.0g
C.x的数值为100 D.气体通过灼热的CuO后,得到44.0gCO2
二、填空题
15.按要求写出煤炉中的煤在燃烧过程中反应的化学方程式(如图):
(1)进风良好的下部: ______________;
(2)中部产生毒气的反应: ___________;
(3)上部产生蓝色火焰的反应:______________。
16.用纯净的CO还原CuO时,试管中的固体由____色逐渐变为____色;将生成的气体通入澄清的石灰水中,可以看到澄清的石灰水____,写出该反应的化学方程式____。
17.将一定量的木炭在盛有32g氧气的密闭容器中燃烧(氧气完全反应),将生成的气体通入足量的澄清石灰水中,生成50g沉淀。则生成气体的成分是____。
18.请回答下列与含碳物质有关的问题。
(1)金刚石和石墨的物理性质不同,原因是______不同;
(2)为了减缓温室效应加剧,有科学家提出可利用FeO吸收和利用CO2,反应的化学方程式为,则X的化学式为______;
(3)混合气体中有氢气、一氧化碳和二氧化碳,要证明混合气体中有一氧化碳,可将气体依次通过下列试剂:
A.NaOH溶液 B.石灰水 C.灼热的氧化铜 D.石灰水
证明混合气体中有一氧化碳的现象是______。
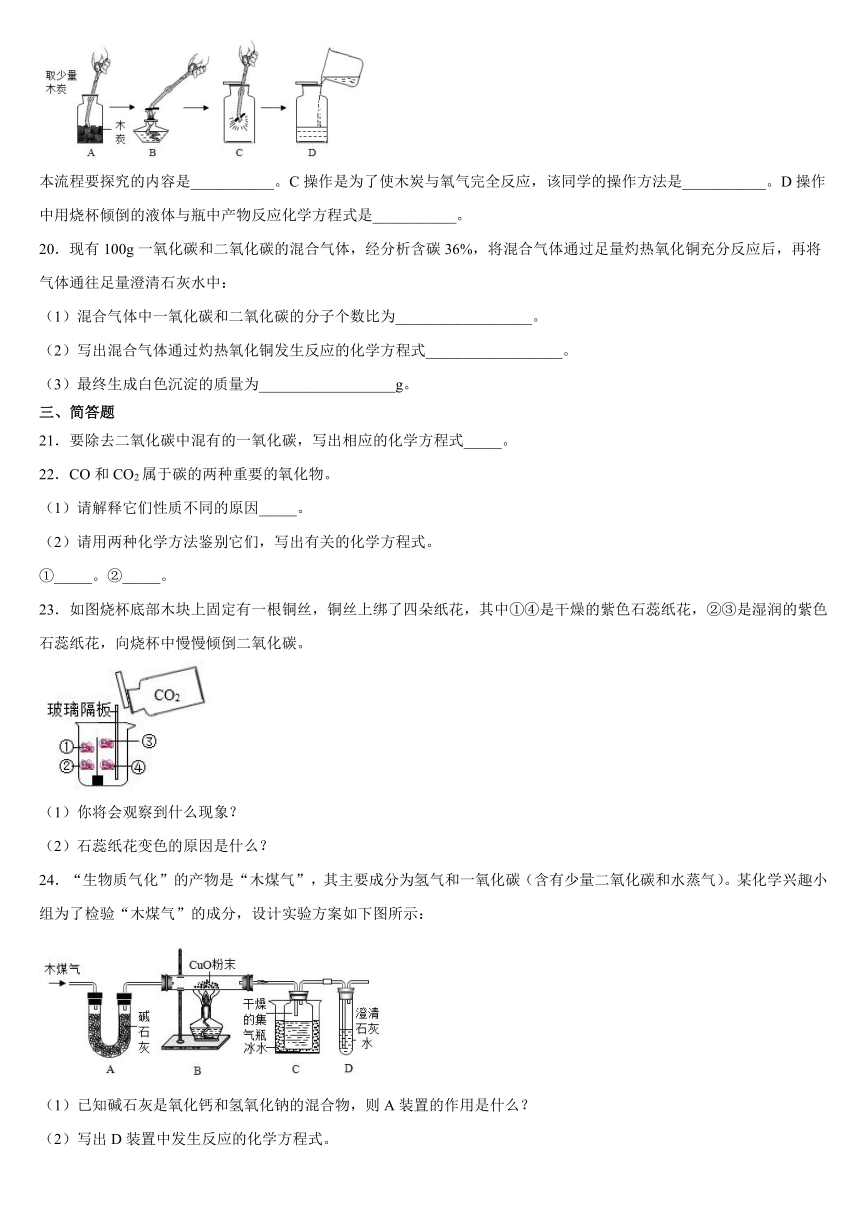
19.某同学在做氧气的性质探究时,用了如图所示的操作流程。
本流程要探究的内容是___________。C操作是为了使木炭与氧气完全反应,该同学的操作方法是___________。D操作中用烧杯倾倒的液体与瓶中产物反应化学方程式是___________。
20.现有100g一氧化碳和二氧化碳的混合气体,经分析含碳36%,将混合气体通过足量灼热氧化铜充分反应后,再将气体通往足量澄清石灰水中:
(1)混合气体中一氧化碳和二氧化碳的分子个数比为__________________。
(2)写出混合气体通过灼热氧化铜发生反应的化学方程式__________________。
(3)最终生成白色沉淀的质量为__________________g。
三、简答题
21.要除去二氧化碳中混有的一氧化碳,写出相应的化学方程式_____。
22.CO和CO2属于碳的两种重要的氧化物。
(1)请解释它们性质不同的原因_____。
(2)请用两种化学方法鉴别它们,写出有关的化学方程式。
①_____。②_____。
23.如图烧杯底部木块上固定有一根铜丝,铜丝上绑了四朵纸花,其中①④是干燥的紫色石蕊纸花,②③是湿润的紫色石蕊纸花,向烧杯中慢慢倾倒二氧化碳。
(1)你将会观察到什么现象?
(2)石蕊纸花变色的原因是什么?
24.“生物质气化”的产物是“木煤气”,其主要成分为氢气和一氧化碳(含有少量二氧化碳和水蒸气)。某化学兴趣小组为了检验“木煤气”的成分,设计实验方案如下图所示:
(1)已知碱石灰是氧化钙和氢氧化钠的混合物,则A装置的作用是什么?
(2)写出D装置中发生反应的化学方程式。
(3)证明“木煤气”中含有H2的实验现象是什么?
四、综合应用题
25.碱式碳酸铜可用于生产木材防腐剂等。工业上常在含有硫酸铜的废水中加入碳酸钠溶液,得到碱式碳酸铜沉淀。
(1)产品生产中加入Na2CO3溶液时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如图所示,沉淀时溶液pH最好控制在_________左右。
(2)实验探究
Ⅰ.验证碱式碳酸铜的分解产物,可选装置如图所示。
甲同学将装置按BCA的顺序组合进行实验,装置A中盛放的试剂的作用是___________,装置C中的现象为___________。装置C、A顺序不能颠倒的原因是___________。
实验结束,B装置中粉末完全变黑。关于黑色物质的成分,有人认为可能有碳,请从物质的物理性质和元素守恒角度说明此猜想的依据是_____________。
乙同学为确认该黑色粉末是氧化铜而不是碳粉,设计如下实验,请完成下表:
实验步骤 观察到的现象 获得结论 反应的化学方程式
取少量黑色粉末于试管中,向其中加入足量的稀硫酸,振荡 _______ 黑色粉末均为氧化铜 _______
Ⅱ.丙同学探究CO还原CuO所得固体产物的成分,实验装置如下图:
资料:CO还原CuO的实验过程中,固体产物可能有Cu2O(红色固体)、Cu。
反应前 反应后
玻璃管和内盛氧化铜 粉末的总质量为62.0 g 玻璃管和内盛红色 粉末的总质量为61.7 g
玻璃管的质量为60.0 g
(1)打开K,缓缓通入CO气体,一段时间后加热。当黑色固体全部变红后停止加热,继续通入CO气体直至玻璃管冷却。
①由实验数据计算可知,CuO中铜元素的质量为_________g,红色固体粉末成分为_________。
②下列有关该实验的说法正确的是_____________。
A.先通入一会CO再加热是为了排净装置中的空气
B.实验结束必须先将玻璃管与虚线框内的装置分开,防止溶液倒吸
C.装置图中虚线框内的装置既能吸收二氧化碳,又能收集一氧化碳
D.排入到烧杯中的溶液可能显碱性,也可能显中性
Ⅲ.工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。为测定某种产品的组成,丁同学设计的实验方案中有如下步骤:①称取12.0 g的样品;②高温分解;③测出生成CO2的质量为2.2 g;④测出生成水蒸气的质量为1.8 g。请根据实验数据,计算确定该碱式碳酸铜的化学式。写出计算过程。_______
【参考答案】
1.C 2.A 3.B 4.A 5.B 6.D 7.A 8.B 9.A 10.A 11.D 12.D 13.D 14.B
15.(1)C+O2 CO2(2)2C+O2 2CO 或CO2+C2CO(3)2CO+O22CO2
16.黑 红 变浑浊 CO2+Ca(OH)2=CaCO3↓+H2O
17.CO、CO2
18.(1)碳原子排列方式不同(2)Fe3O4(3)C中黑色固体变红,B中石灰水不浑浊,D中石灰水变浑浊
19.木炭在氧气中燃烧 使红热的木炭由瓶口向下缓慢插入
20.2:1 300
21.CO+CuOCu+CO2
22.分子的构成不同 将两种气体分别通入澄清石灰水中,能使澄清石灰水变浑浊的是二氧化碳,不能使澄清石灰水变浑浊的是一氧化碳,反应的化学方程式为:CO2 +Ca(OH)2 =CaCO3↓+ H2O 分别将两种气体靠近火焰,能点燃的是一氧化碳,不能点燃的是二氧化碳,反应的化学方程式为:2CO+O22CO2
23.(1)紫色石蕊纸花②比③先变红;①④不变色。(2)二氧化碳与水反应生成碳酸,碳酸使紫色石蕊纸花变红色。
24.(1)吸收水蒸气和二氧化碳(2)(3)C中集气瓶内壁中出现水珠
25.8.5 检验二氧化碳气体 白色固体变为蓝色 A中澄清石灰水中的水会对产物中水的检验有干扰 碳为黑色且反应物中有碳元素 现象:固体全部溶解,溶液变为蓝色 方程式:略 1.6g Cu2O和Cu ABCD 反应后生成的CuO的质量为12.0g- 2.2g -1.8g=8.0g
(x+y)CuO ~ x CO2 ~ (y+z) H2O
80(x+y ) 44x 18(y+z)
8.0g 2.2g 1.8g
80(x+y)/8.0g = 44x/ 2.2g = 18(y+z)/ 1.8g
x = y = z
碱式碳酸铜的化学式为:CuCO3·Cu(OH)2·H2O
课题3二氧化碳与一氧化碳(第二课时)课后练习
一、选择题
1.下列除杂的方法正确的是(括号内的是杂质)
A.KClO3(KCl)—加热 B.空气(氧气)—加入硫燃烧
C.KMnO4(MnO2)—溶解、过滤、蒸发 D.CO2(CO)—点燃
2.除去CO中混有的少量CO2,采用的方法是
A.通入足量石灰水 B.通过灼热的CuO C.点燃 D.倾倒混合气体
3.某无色气体可能含有CO2、CO、H2中的一种或几种,依次进行以下实验(假设每步反应均完全进行);①通过赤热的炭层后,恢复到原状态,气体体积不变;②通过灼热的CuO时,固体变成红色;③通过白色CuSO4粉末时,粉末变成蓝色晶体;④通入澄清石灰水中,石灰水变浑浊。下列判断正确的是
A.原混合气体中一定含有CO2、CO、H2 B.原混合气体中一定没有CO2,一定含有H2和CO
C.原混合气体中一定含有H2和CO2,可能含有CO D.根据①④,可推断实验过程中一定有CO2生成
4.下列有关碳和碳的氧化物的说法中错误的是
A.二氧化碳的大量排放是导致酸雨的原因 B.用炭火取暖时应注意通风,防止一氧化碳中毒
C.木炭有还原性,常用来冶炼金属 D.金刚石和石墨物理性质不同,是因为构成它们的碳原子的排列方式不同
5.下列说法中正确的是
A.金刚石、石墨和C60都是由原子构成的,
B.用澄清石灰水鉴别一氧化碳和二氧化碳
C.除去二氧化碳气体中的一氧化碳可向混合气体通入足量氧气,然后点燃
D.向石蕊溶液中通入二氧化碳,溶液会变红,然后加热溶液,溶液变成无色
6.下列实验设计不能达到其对应实验目的的是
A.测定空气里氧气的含量 B.证明CO2密度比空气的大
C.检查装置的气密性 D.探究CO2溶于水生成酸
7.含有CO和H2的混合气体,其分子总数为n,当它们完全燃烧时,需要氧气的分子数为
A.0.5n B.n C.2n D.不能确定
8.如图是关于碳和碳的化合物知识网络图(图中“→”表示转化关系,“﹣”表示相互能反应)。下列说法错误的是
A.“C→CO2”的反应能体现C的可燃性 B.“CO→CO2”的反应类型只能为化合反应
C.“CO2→H2CO3”的反应可用紫色石蕊溶液验证 D.“CO2→CaCO3”的反应可以区分CO2和空气
9.下图是实验室用CO还原氧化铜的装置,关于该实验,下列说法不正确的是
A.实验时应先给玻璃管加热,后通CO
B.为了减少空气污染,应增加尾气处理装置
C.实验中能观察到玻璃管中黑色粉末逐渐变成红色
D.实验时,试管中澄清的石灰水变浑浊,证明该反应有二氧化碳生成
10.某无色气体N可能是由H2、CO、CO2中的一种或两种组成,为了解其组成情况,小英设计了如下图所示装置进行实验(假设NaOH溶液可以完全吸收CO2)。下列有关说法不正确的是
A.若X中液体变浑浊,缺少Y装置,W中液体变浑浊,则该气体的组成一定为CO2和CO
B.若X中液体不浑浊,Z中固体变成光亮的红色,W中液体不浑浊,则该气体的组成为H2
C.若X中液体变浑浊,Z中固体变成光亮的红色,W中液体不浑浊,则该气体的组成一定为CO2和H2
D.实验过程中,上述装置应该在W装置后面连接一个贮气球或点燃的酒精灯
11.如图所示是兴趣小组在硬质玻璃管中进行有关碳及其氧化物的性质实验,下列说法不正确的是
A.实验过程中,甲、乙两处的现象分别是黑色粉末减少,黑色粉末逐渐变红
B.丙处试管可防止液体倒吸入硬质玻璃管中
C.实验过程中,可观察到丁处澄清石灰水变浑浊
D.该装置的不足之处是未进行尾气处理
12.将7.2克一氧化碳、二氧化碳的混合气体通过足量的灼热氧化铜充分反应后,再量的澄清石灰水充分反应,过滤,得到滤渣20克,则原混合物中氧元素的质量分数约是
A.33.3% B.50% C.62% D.66.7%
13.将一氧化碳和氢气的混合气体20g通过600g灼热的氧化铜粉末,充分反应后(气体全部发生反应),称量剩余固体质量为492g,则原混合气体中氢气的质量分数为
A.15% B.30% C.50% D.65%
14.N2、CO和CO2的混合气体50.0g,其中碳元素的质量分数为24%。使该混合气体依次通过:足量的CuO、过量的澄清石灰水,得到沉淀的质量为xg。下列说法错误的是
A.混合气体中含N2可能为24% B.混合气体中CO质量一定≤28.0g
C.x的数值为100 D.气体通过灼热的CuO后,得到44.0gCO2
二、填空题
15.按要求写出煤炉中的煤在燃烧过程中反应的化学方程式(如图):
(1)进风良好的下部: ______________;
(2)中部产生毒气的反应: ___________;
(3)上部产生蓝色火焰的反应:______________。
16.用纯净的CO还原CuO时,试管中的固体由____色逐渐变为____色;将生成的气体通入澄清的石灰水中,可以看到澄清的石灰水____,写出该反应的化学方程式____。
17.将一定量的木炭在盛有32g氧气的密闭容器中燃烧(氧气完全反应),将生成的气体通入足量的澄清石灰水中,生成50g沉淀。则生成气体的成分是____。
18.请回答下列与含碳物质有关的问题。
(1)金刚石和石墨的物理性质不同,原因是______不同;
(2)为了减缓温室效应加剧,有科学家提出可利用FeO吸收和利用CO2,反应的化学方程式为,则X的化学式为______;
(3)混合气体中有氢气、一氧化碳和二氧化碳,要证明混合气体中有一氧化碳,可将气体依次通过下列试剂:
A.NaOH溶液 B.石灰水 C.灼热的氧化铜 D.石灰水
证明混合气体中有一氧化碳的现象是______。
19.某同学在做氧气的性质探究时,用了如图所示的操作流程。
本流程要探究的内容是___________。C操作是为了使木炭与氧气完全反应,该同学的操作方法是___________。D操作中用烧杯倾倒的液体与瓶中产物反应化学方程式是___________。
20.现有100g一氧化碳和二氧化碳的混合气体,经分析含碳36%,将混合气体通过足量灼热氧化铜充分反应后,再将气体通往足量澄清石灰水中:
(1)混合气体中一氧化碳和二氧化碳的分子个数比为__________________。
(2)写出混合气体通过灼热氧化铜发生反应的化学方程式__________________。
(3)最终生成白色沉淀的质量为__________________g。
三、简答题
21.要除去二氧化碳中混有的一氧化碳,写出相应的化学方程式_____。
22.CO和CO2属于碳的两种重要的氧化物。
(1)请解释它们性质不同的原因_____。
(2)请用两种化学方法鉴别它们,写出有关的化学方程式。
①_____。②_____。
23.如图烧杯底部木块上固定有一根铜丝,铜丝上绑了四朵纸花,其中①④是干燥的紫色石蕊纸花,②③是湿润的紫色石蕊纸花,向烧杯中慢慢倾倒二氧化碳。
(1)你将会观察到什么现象?
(2)石蕊纸花变色的原因是什么?
24.“生物质气化”的产物是“木煤气”,其主要成分为氢气和一氧化碳(含有少量二氧化碳和水蒸气)。某化学兴趣小组为了检验“木煤气”的成分,设计实验方案如下图所示:
(1)已知碱石灰是氧化钙和氢氧化钠的混合物,则A装置的作用是什么?
(2)写出D装置中发生反应的化学方程式。
(3)证明“木煤气”中含有H2的实验现象是什么?
四、综合应用题
25.碱式碳酸铜可用于生产木材防腐剂等。工业上常在含有硫酸铜的废水中加入碳酸钠溶液,得到碱式碳酸铜沉淀。
(1)产品生产中加入Na2CO3溶液时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如图所示,沉淀时溶液pH最好控制在_________左右。
(2)实验探究
Ⅰ.验证碱式碳酸铜的分解产物,可选装置如图所示。
甲同学将装置按BCA的顺序组合进行实验,装置A中盛放的试剂的作用是___________,装置C中的现象为___________。装置C、A顺序不能颠倒的原因是___________。
实验结束,B装置中粉末完全变黑。关于黑色物质的成分,有人认为可能有碳,请从物质的物理性质和元素守恒角度说明此猜想的依据是_____________。
乙同学为确认该黑色粉末是氧化铜而不是碳粉,设计如下实验,请完成下表:
实验步骤 观察到的现象 获得结论 反应的化学方程式
取少量黑色粉末于试管中,向其中加入足量的稀硫酸,振荡 _______ 黑色粉末均为氧化铜 _______
Ⅱ.丙同学探究CO还原CuO所得固体产物的成分,实验装置如下图:
资料:CO还原CuO的实验过程中,固体产物可能有Cu2O(红色固体)、Cu。
反应前 反应后
玻璃管和内盛氧化铜 粉末的总质量为62.0 g 玻璃管和内盛红色 粉末的总质量为61.7 g
玻璃管的质量为60.0 g
(1)打开K,缓缓通入CO气体,一段时间后加热。当黑色固体全部变红后停止加热,继续通入CO气体直至玻璃管冷却。
①由实验数据计算可知,CuO中铜元素的质量为_________g,红色固体粉末成分为_________。
②下列有关该实验的说法正确的是_____________。
A.先通入一会CO再加热是为了排净装置中的空气
B.实验结束必须先将玻璃管与虚线框内的装置分开,防止溶液倒吸
C.装置图中虚线框内的装置既能吸收二氧化碳,又能收集一氧化碳
D.排入到烧杯中的溶液可能显碱性,也可能显中性
Ⅲ.工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。为测定某种产品的组成,丁同学设计的实验方案中有如下步骤:①称取12.0 g的样品;②高温分解;③测出生成CO2的质量为2.2 g;④测出生成水蒸气的质量为1.8 g。请根据实验数据,计算确定该碱式碳酸铜的化学式。写出计算过程。_______
【参考答案】
1.C 2.A 3.B 4.A 5.B 6.D 7.A 8.B 9.A 10.A 11.D 12.D 13.D 14.B
15.(1)C+O2 CO2(2)2C+O2 2CO 或CO2+C2CO(3)2CO+O22CO2
16.黑 红 变浑浊 CO2+Ca(OH)2=CaCO3↓+H2O
17.CO、CO2
18.(1)碳原子排列方式不同(2)Fe3O4(3)C中黑色固体变红,B中石灰水不浑浊,D中石灰水变浑浊
19.木炭在氧气中燃烧 使红热的木炭由瓶口向下缓慢插入
20.2:1 300
21.CO+CuOCu+CO2
22.分子的构成不同 将两种气体分别通入澄清石灰水中,能使澄清石灰水变浑浊的是二氧化碳,不能使澄清石灰水变浑浊的是一氧化碳,反应的化学方程式为:CO2 +Ca(OH)2 =CaCO3↓+ H2O 分别将两种气体靠近火焰,能点燃的是一氧化碳,不能点燃的是二氧化碳,反应的化学方程式为:2CO+O22CO2
23.(1)紫色石蕊纸花②比③先变红;①④不变色。(2)二氧化碳与水反应生成碳酸,碳酸使紫色石蕊纸花变红色。
24.(1)吸收水蒸气和二氧化碳(2)(3)C中集气瓶内壁中出现水珠
25.8.5 检验二氧化碳气体 白色固体变为蓝色 A中澄清石灰水中的水会对产物中水的检验有干扰 碳为黑色且反应物中有碳元素 现象:固体全部溶解,溶液变为蓝色 方程式:略 1.6g Cu2O和Cu ABCD 反应后生成的CuO的质量为12.0g- 2.2g -1.8g=8.0g
(x+y)CuO ~ x CO2 ~ (y+z) H2O
80(x+y ) 44x 18(y+z)
8.0g 2.2g 1.8g
80(x+y)/8.0g = 44x/ 2.2g = 18(y+z)/ 1.8g
x = y = z
碱式碳酸铜的化学式为:CuCO3·Cu(OH)2·H2O
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
