人教版化学九年级下册 8.2.2 金属活动性顺序 同步课件(14张PPT)
文档属性
| 名称 | 人教版化学九年级下册 8.2.2 金属活动性顺序 同步课件(14张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-07 10:08:59 | ||
图片预览





文档简介
(共14张PPT)
空白演示
单击输入您的封面副标题
第八单元 金属和金属材料
九年级化学下册(RJ)
教学课件
课题2 金属的化学性质
第2课时 金属活动性顺序
将铁钉投入到硫酸铜溶液中有何现象?
该反应的化学方程式:
Fe + CuSO4==== Cu + FeSO4
蓝色溶液
红色
浅绿色溶液
活动性强的金属可以把活动性弱的金属从它的化合物溶液中置换出来。
导入新课
1.探究铝和铜、银和铜的金属活动性强弱;
2.知道金属活动性顺序,会应用金属活动性顺序。
学习目标
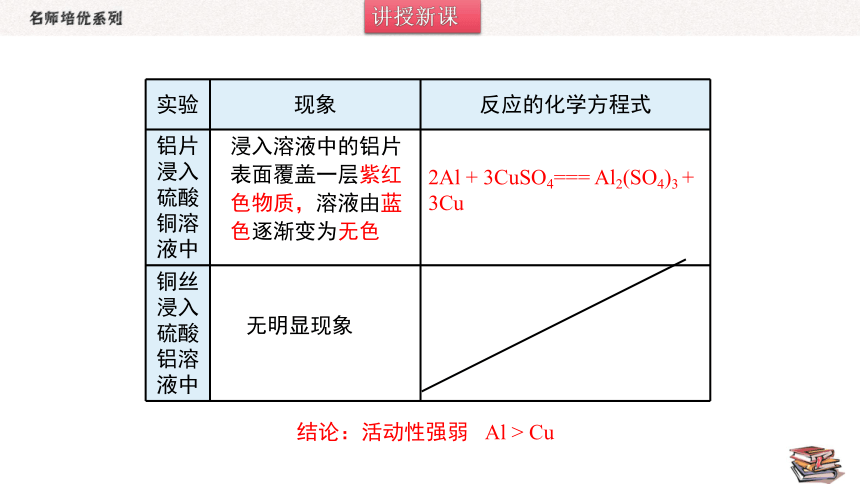
1.设计实验判断Al和Cu的活动性强弱
实验药品:
铝片、铜丝、硫酸铝溶液、硫酸铜溶液
( Al 、 Cu 、 Al2(SO4)3 、 CuSO4 )
金属活动性顺序
讲授新课
实验 现象 反应的化学方程式
铝片浸入硫酸铜溶液中
铜丝浸入硫酸铝溶液中
浸入溶液中的铝片
表面覆盖一层紫红
色物质,溶液由蓝
色逐渐变为无色
无明显现象
2Al + 3CuSO4=== Al2(SO4)3 + 3Cu
结论:活动性强弱 Al > Cu
讲授新课
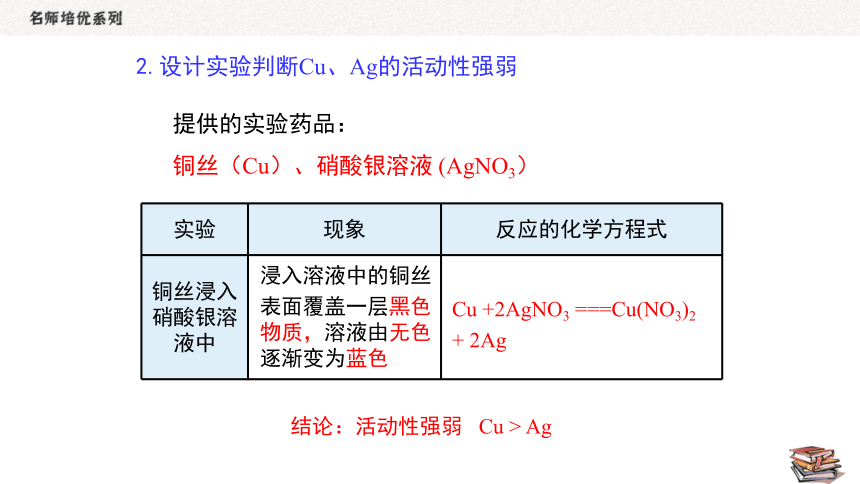
2.设计实验判断Cu、Ag的活动性强弱
提供的实验药品:
铜丝(Cu)、硝酸银溶液 (AgNO3)
实验 现象 反应的化学方程式
铜丝浸入硝酸银溶液中
浸入溶液中的铜丝
表面覆盖一层黑色物质,溶液由无色逐渐变为蓝色
结论:活动性强弱 Cu > Ag
Cu +2AgNO3 ===Cu(NO3)2
+ 2Ag
Cu+2AgNO3===Cu(NO3)2+2Ag
2Al+3CuSO4=== Al2(SO4)3+3Cu
铝与硫酸铜溶液反应
铜与硝酸银溶液反应
交流与讨论
通过上述探究,你能得出铁、铜、银的金属活动性顺序吗?
Fe Cu Ag
金属活动性: 强 弱
金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
注意:钾钙钠,要除外。
可否用铁桶盛放硫酸铜溶液?或者说:能否用铁桶配制农药波尔多液?(配制波尔多液时用到硫酸铜溶液)
Fe +CuSO4====Cu+FeSO4
生活常识
判断下列各组物质能否发生反应?
(1)铜和硫酸锌溶液
(2)锌和硫酸铜溶液
(3)金和硫酸铜溶液
(4)铁和氯化银
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
不反应
不反应
能反应
难溶物
不反应
有X、 Y 、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y的表面有银析出,而Z无变化。根据以上事实,判断X Y Z的金属活动顺序。
答案: 金属活动性顺序 X>Y>Z
学以致用
2.判断金属活动性的方法
(2)金属能否与其他金属化合物的溶液反应
(1)金属与酸反应的剧烈程度
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
1.金属活动性顺序
课堂小结
空白演示
单击输入您的封面副标题
第八单元 金属和金属材料
九年级化学下册(RJ)
教学课件
课题2 金属的化学性质
第2课时 金属活动性顺序
将铁钉投入到硫酸铜溶液中有何现象?
该反应的化学方程式:
Fe + CuSO4==== Cu + FeSO4
蓝色溶液
红色
浅绿色溶液
活动性强的金属可以把活动性弱的金属从它的化合物溶液中置换出来。
导入新课
1.探究铝和铜、银和铜的金属活动性强弱;
2.知道金属活动性顺序,会应用金属活动性顺序。
学习目标
1.设计实验判断Al和Cu的活动性强弱
实验药品:
铝片、铜丝、硫酸铝溶液、硫酸铜溶液
( Al 、 Cu 、 Al2(SO4)3 、 CuSO4 )
金属活动性顺序
讲授新课
实验 现象 反应的化学方程式
铝片浸入硫酸铜溶液中
铜丝浸入硫酸铝溶液中
浸入溶液中的铝片
表面覆盖一层紫红
色物质,溶液由蓝
色逐渐变为无色
无明显现象
2Al + 3CuSO4=== Al2(SO4)3 + 3Cu
结论:活动性强弱 Al > Cu
讲授新课
2.设计实验判断Cu、Ag的活动性强弱
提供的实验药品:
铜丝(Cu)、硝酸银溶液 (AgNO3)
实验 现象 反应的化学方程式
铜丝浸入硝酸银溶液中
浸入溶液中的铜丝
表面覆盖一层黑色物质,溶液由无色逐渐变为蓝色
结论:活动性强弱 Cu > Ag
Cu +2AgNO3 ===Cu(NO3)2
+ 2Ag
Cu+2AgNO3===Cu(NO3)2+2Ag
2Al+3CuSO4=== Al2(SO4)3+3Cu
铝与硫酸铜溶液反应
铜与硝酸银溶液反应
交流与讨论
通过上述探究,你能得出铁、铜、银的金属活动性顺序吗?
Fe Cu Ag
金属活动性: 强 弱
金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
注意:钾钙钠,要除外。
可否用铁桶盛放硫酸铜溶液?或者说:能否用铁桶配制农药波尔多液?(配制波尔多液时用到硫酸铜溶液)
Fe +CuSO4====Cu+FeSO4
生活常识
判断下列各组物质能否发生反应?
(1)铜和硫酸锌溶液
(2)锌和硫酸铜溶液
(3)金和硫酸铜溶液
(4)铁和氯化银
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
不反应
不反应
能反应
难溶物
不反应
有X、 Y 、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y的表面有银析出,而Z无变化。根据以上事实,判断X Y Z的金属活动顺序。
答案: 金属活动性顺序 X>Y>Z
学以致用
2.判断金属活动性的方法
(2)金属能否与其他金属化合物的溶液反应
(1)金属与酸反应的剧烈程度
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
1.金属活动性顺序
课堂小结
同课章节目录
