人教版化学九年级下册 8.2.1 金属与氧气、酸的反应 同步课件(20张PPT)
文档属性
| 名称 | 人教版化学九年级下册 8.2.1 金属与氧气、酸的反应 同步课件(20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-07 10:08:59 | ||
图片预览








文档简介
(共20张PPT)
空白演示
单击输入您的封面副标题
第八单元 金属和金属材料
九年级化学下册(RJ)
教学课件
课题2 金属的化学性质
第1课时 金属与氧气、酸的反应
金属材料的发展
青铜器
铁器
铝器
导入新课
铝的应用非常广泛,这不仅与铝的物理性质有关,还与铝的化学性质密切相关。
思考:为什么铝有这么好的抗腐蚀性能呢?
铝有很好的抗腐蚀性能
1.知道镁、铝、铁、铜等金属与氧气的反应及剧烈程度;
2.探究不同金属与稀盐酸、稀硫酸的反应,知道什么是置换反应;
3.初步了解一些常见金属的活动性强弱顺序。
学习目标
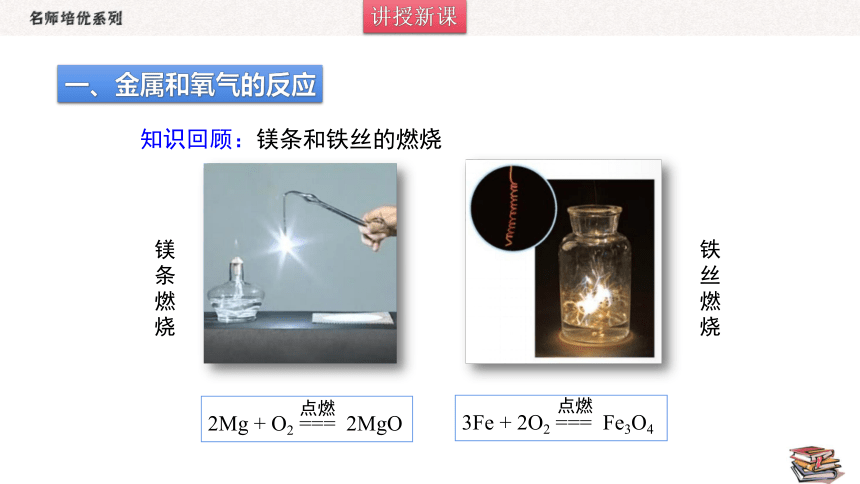
2Mg + O2 === 2MgO
点燃
3Fe + 2O2 === Fe3O4
点燃
知识回顾:镁条和铁丝的燃烧
镁条燃烧
铁丝燃烧
一、金属和氧气的反应
讲授新课
许多金属都能与氧气反应,但反应的难易和剧烈程度不同。
1.镁、铝在常温下就能与氧气反应;
2.铁、铜在常温下几乎不与氧气反应,但在点燃或加热时能与氧气反应;
3.金在高温下也不与氧气反应(真金不怕火炼)。
4Al + 3O2 === 2Al2O3
在常温下,铝和氧气能发生反应,在铝表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化,所以铝具有很好的抗腐蚀性。
金属活动性:镁、铝较活泼,铁、铜次之,金最不活泼。
铜片在空气中加热
现象:铜片表面由红色变为黑色。
2Cu + O2 === 2CuO
△
金属铜
1.判断金属活动性的方法一:
可根据金属与氧气反应的难易程度或者相同条件下反应现象的剧烈程度进行判断。
2.大多数金属都能与氧气发生反应
金属的活动性顺序:Mg>Al>Fe,Cu>Au
小结
二、金属与盐酸、稀硫酸的反应
活动探究(以盐酸为例):金属与盐酸的反应
镁与盐酸
锌与盐酸
铁与盐酸
铜与盐酸
金属 现象 化学方程式
镁
锌
铁
铜
表面产生气泡,非常快
表面产生气泡,较快
产生气泡较慢,溶液由无色变为浅绿色
无气泡产生
Mg + 2HCl ====MgCl2 + H2↑
Zn + 2HCl === ZnCl2 + H2↑
Fe + 2HCl === FeCl2 + H2↑
+2价
为什么镁、锌、铁、铜在相同的条件下与相同浓度的盐酸反应的现象会不一样呢?
金属活动性(金属的活泼程度)不一样
想一想
镁>锌>铁>铜
1.大多数金属能与盐酸或稀硫酸发生置换反应。
2.判断金属活动性的方法二:
可根据金属是否与盐酸或稀硫酸反应,或反应的剧烈程度判断金属的活动性强弱。
Mg > Zn > Fe > (H)> Cu
小结
Mg + H2SO4 == MgSO4 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
Zn + H2SO4 == ZnSO4 + H2↑
2Al + 3H2SO4 == Al2(SO4)3 + 3H2↑
置换反应:一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。
单质
单质
化合物
化合物
这四个化学方程式
有什么特点?
回顾:化学反应基本类型
化合反应
由两种或两种以上物质生成另一种物质的反应
分解反应
由一种反应物生成两种或两种以上其他物质的反应
A+B==AB
CaO+H2O===Ca(OH)2
A==B+C (+D)
C +O2===CO2
点燃
KMnO4===K2MnO4+MnO2+O2↑
△
思考:这个反应是置换反应吗?
CaCO3+2HCl===CaCl2+H2CO3
置换反应用字母怎么表示呢?
A+B===C+D
A+BC===B+AC
必须是一种单质置换出另一种单质
?
试一试:学过的反应中有置换反应吗?
H2 + CuO === Cu + H2O
C + CuO === Cu + CO2
CO + CuO === Cu + CO2
√
√
△
△
△
◆ 金属的化学性质:
1.与氧气反应
2.与稀盐酸(稀硫酸)反应
(金属越活泼,反应越容易,越剧烈)
◆ 置换反应
A+BC===B+AC
◆ 金属活动性
Mg > Zn > Fe > (H)> Cu
课堂小结
空白演示
单击输入您的封面副标题
第八单元 金属和金属材料
九年级化学下册(RJ)
教学课件
课题2 金属的化学性质
第1课时 金属与氧气、酸的反应
金属材料的发展
青铜器
铁器
铝器
导入新课
铝的应用非常广泛,这不仅与铝的物理性质有关,还与铝的化学性质密切相关。
思考:为什么铝有这么好的抗腐蚀性能呢?
铝有很好的抗腐蚀性能
1.知道镁、铝、铁、铜等金属与氧气的反应及剧烈程度;
2.探究不同金属与稀盐酸、稀硫酸的反应,知道什么是置换反应;
3.初步了解一些常见金属的活动性强弱顺序。
学习目标
2Mg + O2 === 2MgO
点燃
3Fe + 2O2 === Fe3O4
点燃
知识回顾:镁条和铁丝的燃烧
镁条燃烧
铁丝燃烧
一、金属和氧气的反应
讲授新课
许多金属都能与氧气反应,但反应的难易和剧烈程度不同。
1.镁、铝在常温下就能与氧气反应;
2.铁、铜在常温下几乎不与氧气反应,但在点燃或加热时能与氧气反应;
3.金在高温下也不与氧气反应(真金不怕火炼)。
4Al + 3O2 === 2Al2O3
在常温下,铝和氧气能发生反应,在铝表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化,所以铝具有很好的抗腐蚀性。
金属活动性:镁、铝较活泼,铁、铜次之,金最不活泼。
铜片在空气中加热
现象:铜片表面由红色变为黑色。
2Cu + O2 === 2CuO
△
金属铜
1.判断金属活动性的方法一:
可根据金属与氧气反应的难易程度或者相同条件下反应现象的剧烈程度进行判断。
2.大多数金属都能与氧气发生反应
金属的活动性顺序:Mg>Al>Fe,Cu>Au
小结
二、金属与盐酸、稀硫酸的反应
活动探究(以盐酸为例):金属与盐酸的反应
镁与盐酸
锌与盐酸
铁与盐酸
铜与盐酸
金属 现象 化学方程式
镁
锌
铁
铜
表面产生气泡,非常快
表面产生气泡,较快
产生气泡较慢,溶液由无色变为浅绿色
无气泡产生
Mg + 2HCl ====MgCl2 + H2↑
Zn + 2HCl === ZnCl2 + H2↑
Fe + 2HCl === FeCl2 + H2↑
+2价
为什么镁、锌、铁、铜在相同的条件下与相同浓度的盐酸反应的现象会不一样呢?
金属活动性(金属的活泼程度)不一样
想一想
镁>锌>铁>铜
1.大多数金属能与盐酸或稀硫酸发生置换反应。
2.判断金属活动性的方法二:
可根据金属是否与盐酸或稀硫酸反应,或反应的剧烈程度判断金属的活动性强弱。
Mg > Zn > Fe > (H)> Cu
小结
Mg + H2SO4 == MgSO4 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
Zn + H2SO4 == ZnSO4 + H2↑
2Al + 3H2SO4 == Al2(SO4)3 + 3H2↑
置换反应:一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。
单质
单质
化合物
化合物
这四个化学方程式
有什么特点?
回顾:化学反应基本类型
化合反应
由两种或两种以上物质生成另一种物质的反应
分解反应
由一种反应物生成两种或两种以上其他物质的反应
A+B==AB
CaO+H2O===Ca(OH)2
A==B+C (+D)
C +O2===CO2
点燃
KMnO4===K2MnO4+MnO2+O2↑
△
思考:这个反应是置换反应吗?
CaCO3+2HCl===CaCl2+H2CO3
置换反应用字母怎么表示呢?
A+B===C+D
A+BC===B+AC
必须是一种单质置换出另一种单质
?
试一试:学过的反应中有置换反应吗?
H2 + CuO === Cu + H2O
C + CuO === Cu + CO2
CO + CuO === Cu + CO2
√
√
△
△
△
◆ 金属的化学性质:
1.与氧气反应
2.与稀盐酸(稀硫酸)反应
(金属越活泼,反应越容易,越剧烈)
◆ 置换反应
A+BC===B+AC
◆ 金属活动性
Mg > Zn > Fe > (H)> Cu
课堂小结
同课章节目录
