2.2物质转化的规律(3)
图片预览







文档简介
(共28张PPT)
物质转化的规律
第三课时
金属的冶炼:
把金属从化合态变成游离态。
方法一:金属氧化物与H2、C、CO还原剂等共热。
方法二:盐溶液与活泼金属置换出金属。
1.在实验室里,为什么宜用锌和稀硫酸反应制取氢气?
镁与酸反应速率过快,不易控制,且价格也贵,
铁与酸反应速率过慢,不适宜实验实制取氢气,
而锌与酸反应速率适中且价格较便宜。
不用浓硫酸和硝酸,是因为它们具有强氧化性,与锌等金属反应不产生氢气,
盐酸具有挥发性,会有少量氯化氢气体混入氢气,这样制取的氢气就不纯净。
2.为什么要将氧化铜铺在试管底部?
为了增加反应物的受热面积,加快反应速率。
3.为什么盛氧化铜的试管口要略向下倾斜?
可避免反应中生成的水倒流,防止试管破裂。
4.为什么通氢气的导管应插入试管底部氧化铜的上方?
其一,为避免氧化铜粉末堵塞导管口;
其二,易把试管里的空气赶尽,加热后不致发生危险。
5.为什么要先通一会儿氢气,再给氧化铜加热?
当氢气还没有把试管里的空气完全排尽时就给氧化铜加热,容易引起爆炸事故。
6.给盛有氧化铜的试管加热,为什么要先使试管预热,然后再在放氧化铜的部位加热?
避免试管局部温度过高而破裂。
7.为何反应完成后停止加热,还要继续通氢气,直到试管冷却?
使还原出来的铜在氢气流里逐渐冷却,防止灼热的铜在空气中再被氧化。
木炭与氧化铜的反应
C + 2CuO = 2Cu + CO2
△
有亮红色物质生成,生成的气体使澄清石灰水变浑浊。
现象:
实验注意事项:
实验后先把导管从石灰水里移开然后再灭酒精灯。
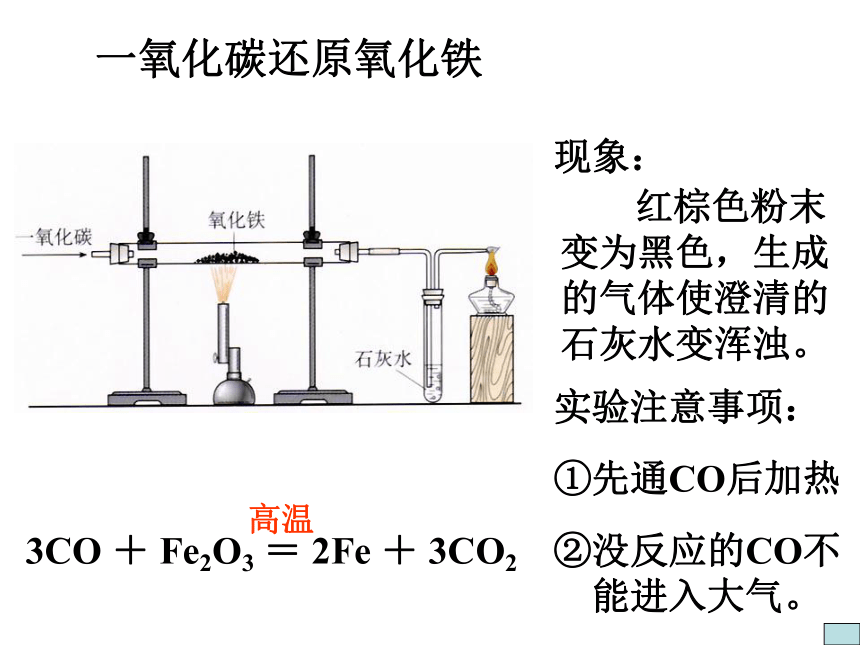
一氧化碳还原氧化铁
红棕色粉末变为黑色,生成的气体使澄清的石灰水变浑浊。
现象:
实验注意事项:
①先通CO后加热
②没反应的CO不 能进入大气。
3CO + Fe2O3 = 2Fe + 3CO2
高温
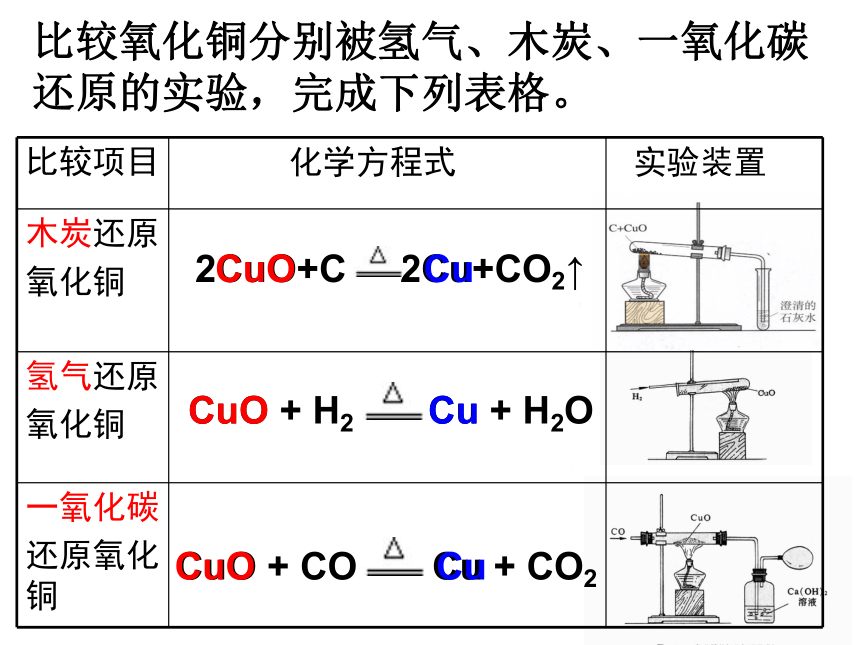
比较氧化铜分别被氢气、木炭、一氧化碳
还原的实验,完成下列表格。
比较项目 化学方程式 实验装置
木炭还原
氧化铜
氢气还原
氧化铜
一氧化碳
还原氧化铜
CuO + CO Cu + CO2
2CuO+C 2Cu+CO2↑
CuO + H2 Cu + H2O
CuO Cu
CuO Cu
CuO Cu
比较项目 实验现象 实验注意事项
木炭还原
氧化铜
氢气还原
氧化铜
一氧化碳
还原氧化铜
试管壁出现水珠,试管中
出现光亮紫红色的固体;
澄清的石灰水变浑浊。
黑色的氧化铜变成光亮紫
红色的金属;
试管内壁出现小水珠。
黑色的氧化铜变成光亮紫
红色的固体;
澄清的石灰水变浑浊。
反应需要比较
高的温度
H2“早出晚归”
尾气要无害化
处理
试管中
出现光亮紫红色的固体;
黑色的氧化铜变成光亮紫
红色的金属;
黑色的氧化铜变成光亮紫
红色的固体;
练一练
下图为一氧化碳还原氧化铜的装置
①实验过程中观察到的现象是:在(a)玻璃管内 ;
在(b)管内 。
②点燃(b)管中导出一氧化碳气体的目的是:
为了 。
黑色的氧化铜变成光亮紫红色的固体
澄清的石灰水变浑浊
防止CO污染大气
1、下面是氢气还原氧化铜的操作步骤:a.停止用酒精灯加热;b.将平铺在试管底,把试管固定在铁架台上;c.用酒精灯加热;d.继续通人氢气到试管冷却;e.向盛氧化铜的试管中通氢气。
实验时正确的操作顺序是 .
2、某学生在实验室还原8g氧化铜,需耗氢气的质量为( )
A 8g B 大于0.2g C 小于0.2g D 0.2g
B
b、e、c、a、d
练 习
用2000吨含Fe2O3 75% 的铁矿石,
最多可炼出多少吨铁.
计算
计算
100吨含Fe2O3的质量分数为85%的铁矿石,可炼出含铁的质量分数为96%的生铁多少吨?
解:3CO+Fe2O3 ====2Fe+3CO2
160
112
100吨×85%
X·96%
某钢铁厂用580吨含Fe3O480%的磁铁矿(其余为不含铁的杂质),可炼得含杂质为4%的生铁多少吨?
解:
Fe3O4
3Fe
232
~
168
580t×80%
x×(1-4%)
设可炼得含杂质为4%的生铁x吨
x = 350t
232
168
=
580t×80%
x×(1-4%)
解:
Fe2O3
2Fe
160
~
112
x×96%
设可炼出含铁质量分数为96%的生铁x吨
x = 62t
160
112
x×96%
=
100t×85%
100t×85%
练习:
1、用1000吨含Fe2O3 85% 的铁矿石,最多可炼出多少吨铁.
2、部分变质的氢氧化钠固体20克,与200克稀盐酸恰好完全反应,反应后测得剩余溶液质量为215.6克,求:
A.氢氧化钠样品中氢氧化钠的质量分数是多少?(47%)
B.稀盐酸的质量分数是多少?
(7.3+8.5775)/200=7.94%
3、以铁粉、氧化铜和稀硫酸为原料,试用两种
方法制取少量的铜,写出化学方程式,并比较那
一个方法好?
(1) ,
;
(2) ,
。
CuO + H2 Cu + H2O
Fe + H2SO4 = FeSO4 + H2↑
Fe + CuSO4 = FeSO4 + Cu
CuO + H2SO4 = CuSO4 + H2O
其中(2)较好。
Cu
CuO
Cu(OH)2
CuCl2(CuSO4)
Cu2(OH)2CO3
铜锈
O2
CO/C/H2
不溶性碱受热易分解
不溶性碱===金属氧化物+水
4、写出下列变化的化学方程式
Cu2(OH)2CO3 2CuO + CO2↑+ H2O
CuO + H2 Cu + H2O
2Cu + O2 2CuO
Cu(OH)2 CuO + H2O
CuO + H2SO4 CuSO4 + H2O
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
2NaOH +CuSO4 = Cu(OH)2↓+ Na2SO4
实验:孔雀石(主要成分为碱式碳酸铜) 的变化
1.观察孔雀石的颜色,写出它的化学式
2.用酒精灯高温加热孔雀石约15分钟,观察现象。用湿润的pH试纸贴在试管壁上观察颜色的变化 。
Cu2(OH)2CO3 === 2CuO+ CO2↑+H2O
Cu2(OH)2CO3
高温
含CaCO3的石灰岩跟CO2和水反应变成Ca(HCO3)2,使石灰岩溶解。
CaCO3 +CO2 +H2O = Ca(HCO3)2
如溶有Ca(HCO3)2的水从溶洞顶部流下,因温度、压强的变化Ca(HCO3)2发生分解反应使CaCO3以沉积物形式析出。
Ca(HCO3)2 = CaCO3 +CO2 ↑+H2O
开始以小突起附着在洞顶,以后逐渐向下增长具有同心圆状结构而形成钟乳石。如从岩洞底部向上生成的CaCO3沉积物则形成石笋。
稀HCl
当鸡蛋遇到盐酸时,会发生如下反应:
CaCO3+2HCl=
CaCl2+CO2↑+H2O
开始时,由于鸡蛋的重力大于其浮力,鸡蛋下沉。随之鸡蛋中的CaCO3与稀盐酸反应,产生大量气泡,附在蛋壳表面,增加了蛋壳的浮力,浮力大于重力,鸡蛋上浮。当气泡到达液面后,气泡逐渐减少,浮力减小,小于鸡蛋的重力,所以下沉。如此反复,犹如“跳舞”。
三、化学反应中的物质类别
Zn+H2SO4 = ZnSO4+H2↑
(金属+酸=盐+氢气)
ZnO+2HNO3 = Zn(NO3)3 + H2O
(金属氧化物+酸=盐+水)
NaOH+HCl = NaCl + H2O
(酸+碱=盐+水)
HCl+AgNO3 = AgCl↓+HNO3
(酸+盐=新酸+新盐)
NaCl+AgNO3==AgCl↓+NaNO3
(盐+盐=两种新盐)
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
(盐+碱=新盐+新碱)
SiO2+2NaOH=Na2SiO3+H2O
(非金属氧化物+可溶性碱=盐+水)
点燃
Cl2+2Na====2NaCl
(金属+非金属=盐)
CaO+CO2 = CaCO3
(金属氧化物+非金属氧化物=含氧酸盐)
金属
金属氧化物
碱
盐
非金属
非金属氧化物
酸
盐
盐
盐
盐
盐
盐
物质转化的规律
第三课时
金属的冶炼:
把金属从化合态变成游离态。
方法一:金属氧化物与H2、C、CO还原剂等共热。
方法二:盐溶液与活泼金属置换出金属。
1.在实验室里,为什么宜用锌和稀硫酸反应制取氢气?
镁与酸反应速率过快,不易控制,且价格也贵,
铁与酸反应速率过慢,不适宜实验实制取氢气,
而锌与酸反应速率适中且价格较便宜。
不用浓硫酸和硝酸,是因为它们具有强氧化性,与锌等金属反应不产生氢气,
盐酸具有挥发性,会有少量氯化氢气体混入氢气,这样制取的氢气就不纯净。
2.为什么要将氧化铜铺在试管底部?
为了增加反应物的受热面积,加快反应速率。
3.为什么盛氧化铜的试管口要略向下倾斜?
可避免反应中生成的水倒流,防止试管破裂。
4.为什么通氢气的导管应插入试管底部氧化铜的上方?
其一,为避免氧化铜粉末堵塞导管口;
其二,易把试管里的空气赶尽,加热后不致发生危险。
5.为什么要先通一会儿氢气,再给氧化铜加热?
当氢气还没有把试管里的空气完全排尽时就给氧化铜加热,容易引起爆炸事故。
6.给盛有氧化铜的试管加热,为什么要先使试管预热,然后再在放氧化铜的部位加热?
避免试管局部温度过高而破裂。
7.为何反应完成后停止加热,还要继续通氢气,直到试管冷却?
使还原出来的铜在氢气流里逐渐冷却,防止灼热的铜在空气中再被氧化。
木炭与氧化铜的反应
C + 2CuO = 2Cu + CO2
△
有亮红色物质生成,生成的气体使澄清石灰水变浑浊。
现象:
实验注意事项:
实验后先把导管从石灰水里移开然后再灭酒精灯。
一氧化碳还原氧化铁
红棕色粉末变为黑色,生成的气体使澄清的石灰水变浑浊。
现象:
实验注意事项:
①先通CO后加热
②没反应的CO不 能进入大气。
3CO + Fe2O3 = 2Fe + 3CO2
高温
比较氧化铜分别被氢气、木炭、一氧化碳
还原的实验,完成下列表格。
比较项目 化学方程式 实验装置
木炭还原
氧化铜
氢气还原
氧化铜
一氧化碳
还原氧化铜
CuO + CO Cu + CO2
2CuO+C 2Cu+CO2↑
CuO + H2 Cu + H2O
CuO Cu
CuO Cu
CuO Cu
比较项目 实验现象 实验注意事项
木炭还原
氧化铜
氢气还原
氧化铜
一氧化碳
还原氧化铜
试管壁出现水珠,试管中
出现光亮紫红色的固体;
澄清的石灰水变浑浊。
黑色的氧化铜变成光亮紫
红色的金属;
试管内壁出现小水珠。
黑色的氧化铜变成光亮紫
红色的固体;
澄清的石灰水变浑浊。
反应需要比较
高的温度
H2“早出晚归”
尾气要无害化
处理
试管中
出现光亮紫红色的固体;
黑色的氧化铜变成光亮紫
红色的金属;
黑色的氧化铜变成光亮紫
红色的固体;
练一练
下图为一氧化碳还原氧化铜的装置
①实验过程中观察到的现象是:在(a)玻璃管内 ;
在(b)管内 。
②点燃(b)管中导出一氧化碳气体的目的是:
为了 。
黑色的氧化铜变成光亮紫红色的固体
澄清的石灰水变浑浊
防止CO污染大气
1、下面是氢气还原氧化铜的操作步骤:a.停止用酒精灯加热;b.将平铺在试管底,把试管固定在铁架台上;c.用酒精灯加热;d.继续通人氢气到试管冷却;e.向盛氧化铜的试管中通氢气。
实验时正确的操作顺序是 .
2、某学生在实验室还原8g氧化铜,需耗氢气的质量为( )
A 8g B 大于0.2g C 小于0.2g D 0.2g
B
b、e、c、a、d
练 习
用2000吨含Fe2O3 75% 的铁矿石,
最多可炼出多少吨铁.
计算
计算
100吨含Fe2O3的质量分数为85%的铁矿石,可炼出含铁的质量分数为96%的生铁多少吨?
解:3CO+Fe2O3 ====2Fe+3CO2
160
112
100吨×85%
X·96%
某钢铁厂用580吨含Fe3O480%的磁铁矿(其余为不含铁的杂质),可炼得含杂质为4%的生铁多少吨?
解:
Fe3O4
3Fe
232
~
168
580t×80%
x×(1-4%)
设可炼得含杂质为4%的生铁x吨
x = 350t
232
168
=
580t×80%
x×(1-4%)
解:
Fe2O3
2Fe
160
~
112
x×96%
设可炼出含铁质量分数为96%的生铁x吨
x = 62t
160
112
x×96%
=
100t×85%
100t×85%
练习:
1、用1000吨含Fe2O3 85% 的铁矿石,最多可炼出多少吨铁.
2、部分变质的氢氧化钠固体20克,与200克稀盐酸恰好完全反应,反应后测得剩余溶液质量为215.6克,求:
A.氢氧化钠样品中氢氧化钠的质量分数是多少?(47%)
B.稀盐酸的质量分数是多少?
(7.3+8.5775)/200=7.94%
3、以铁粉、氧化铜和稀硫酸为原料,试用两种
方法制取少量的铜,写出化学方程式,并比较那
一个方法好?
(1) ,
;
(2) ,
。
CuO + H2 Cu + H2O
Fe + H2SO4 = FeSO4 + H2↑
Fe + CuSO4 = FeSO4 + Cu
CuO + H2SO4 = CuSO4 + H2O
其中(2)较好。
Cu
CuO
Cu(OH)2
CuCl2(CuSO4)
Cu2(OH)2CO3
铜锈
O2
CO/C/H2
不溶性碱受热易分解
不溶性碱===金属氧化物+水
4、写出下列变化的化学方程式
Cu2(OH)2CO3 2CuO + CO2↑+ H2O
CuO + H2 Cu + H2O
2Cu + O2 2CuO
Cu(OH)2 CuO + H2O
CuO + H2SO4 CuSO4 + H2O
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
2NaOH +CuSO4 = Cu(OH)2↓+ Na2SO4
实验:孔雀石(主要成分为碱式碳酸铜) 的变化
1.观察孔雀石的颜色,写出它的化学式
2.用酒精灯高温加热孔雀石约15分钟,观察现象。用湿润的pH试纸贴在试管壁上观察颜色的变化 。
Cu2(OH)2CO3 === 2CuO+ CO2↑+H2O
Cu2(OH)2CO3
高温
含CaCO3的石灰岩跟CO2和水反应变成Ca(HCO3)2,使石灰岩溶解。
CaCO3 +CO2 +H2O = Ca(HCO3)2
如溶有Ca(HCO3)2的水从溶洞顶部流下,因温度、压强的变化Ca(HCO3)2发生分解反应使CaCO3以沉积物形式析出。
Ca(HCO3)2 = CaCO3 +CO2 ↑+H2O
开始以小突起附着在洞顶,以后逐渐向下增长具有同心圆状结构而形成钟乳石。如从岩洞底部向上生成的CaCO3沉积物则形成石笋。
稀HCl
当鸡蛋遇到盐酸时,会发生如下反应:
CaCO3+2HCl=
CaCl2+CO2↑+H2O
开始时,由于鸡蛋的重力大于其浮力,鸡蛋下沉。随之鸡蛋中的CaCO3与稀盐酸反应,产生大量气泡,附在蛋壳表面,增加了蛋壳的浮力,浮力大于重力,鸡蛋上浮。当气泡到达液面后,气泡逐渐减少,浮力减小,小于鸡蛋的重力,所以下沉。如此反复,犹如“跳舞”。
三、化学反应中的物质类别
Zn+H2SO4 = ZnSO4+H2↑
(金属+酸=盐+氢气)
ZnO+2HNO3 = Zn(NO3)3 + H2O
(金属氧化物+酸=盐+水)
NaOH+HCl = NaCl + H2O
(酸+碱=盐+水)
HCl+AgNO3 = AgCl↓+HNO3
(酸+盐=新酸+新盐)
NaCl+AgNO3==AgCl↓+NaNO3
(盐+盐=两种新盐)
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
(盐+碱=新盐+新碱)
SiO2+2NaOH=Na2SiO3+H2O
(非金属氧化物+可溶性碱=盐+水)
点燃
Cl2+2Na====2NaCl
(金属+非金属=盐)
CaO+CO2 = CaCO3
(金属氧化物+非金属氧化物=含氧酸盐)
金属
金属氧化物
碱
盐
非金属
非金属氧化物
酸
盐
盐
盐
盐
盐
盐
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
