2.2金属的化学性质 同步练习(含解析)
文档属性
| 名称 | 2.2金属的化学性质 同步练习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 83.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-11-19 20:19:06 | ||
图片预览


文档简介
金属的化学性质
一、单选题
1.如图所示,装置气密性良好,弹簧夹处于关闭状态。向试管中加入下表中的物质,挤压胶头滴管加入液体,一段时间后,打开弹簧夹,能使气球a明显鼓起的是( )
试管内物质 胶头滴管内物质
A 氢氧化钠固体 水
B 铁粉 稀盐酸
C 氯化钡溶液 稀硫酸
D 二氧化碳 氢氧化钠溶液
A. A B. B C. C D. D
2.如图所示,将一小块金属钠放入CuSO4溶液中,金属钠立即熔化成小球,并在液面上快速游动,发出“哧哧”的声音,直到消失,同时杯底出现蓝色沉淀,溶液仍为蓝色。下列说法错误的是( )
A. 可推测出金属钠的密度比杯中溶液的密度小、熔点比较低
B. 发生了置换反应、复分解反应
C. 由此实验可得结论:金属钠能将CuSO4溶液中的Cu置换出来
D. 若向反应结束后的烧杯中滴入无色酚酞试液,则试液不变红色
3.下列有关说法正确的是( )
A. O2具有助燃性 B. 铁生锈属于物理变化 C. 金属活动性Cu比Mg强 D. KClO3属于氧化物
4.向一定质量的Mg(NO3)2和Cu(NO3)2混合溶液中加入a克锌粉和铁粉的混合物,充分反应后过滤,得到不饱和的滤液和滤渣,将滤渣洗涤、干燥后再称量,得到的固体质量仍为a克。下列分析合理的是( )
①滤渣中可能有铜 ②向滤渣中加稀盐酸,可能有气泡产生
③滤液中一定有Mg(NO3)2、Zn(NO3)2和Fe(NO3)2,可能有Cu(NO3)2
④若忽略过滤操作中溶液损失,滤液中溶质的质量一定大于原混合溶液溶质的质量
A. ①② B. ①③ C. ②③ D. ②④
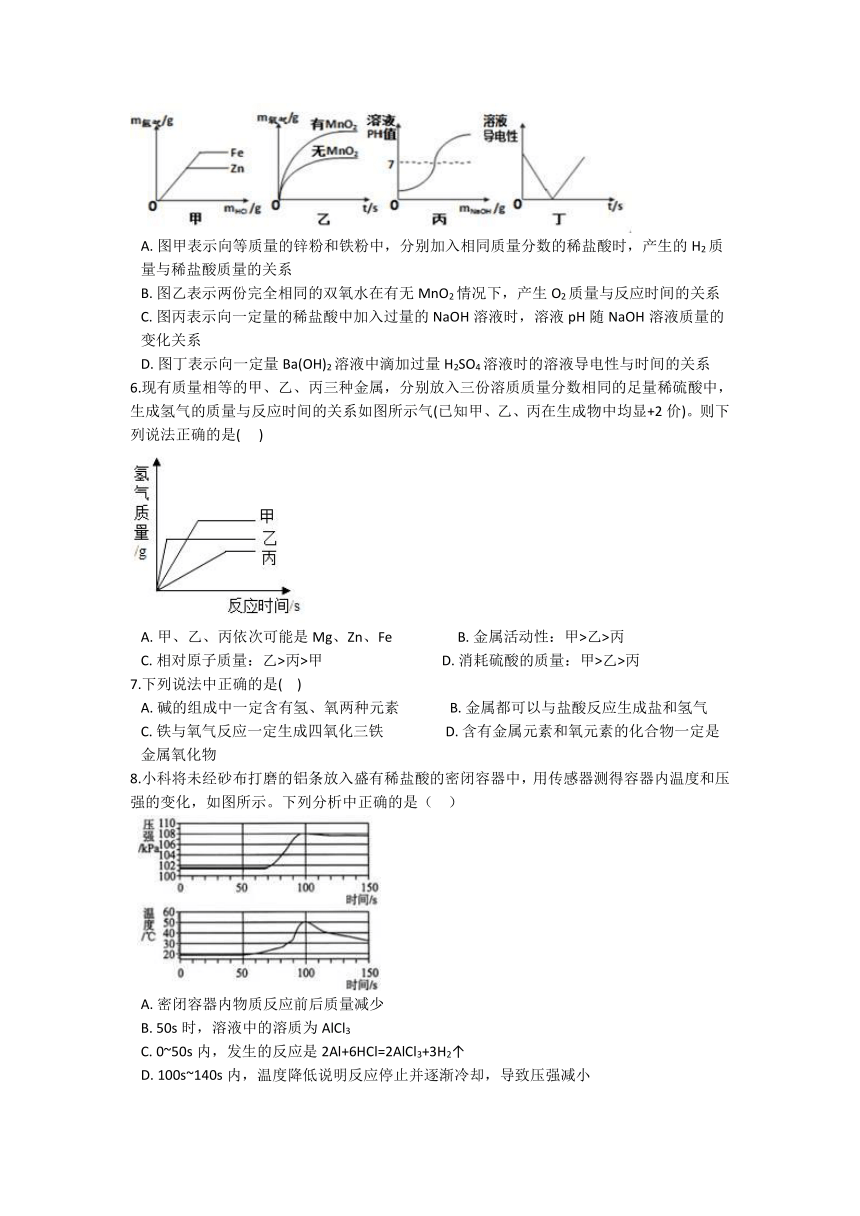
5.下列图像不能正确表示对应变化关系的是( )
A. 图甲表示向等质量的锌粉和铁粉中,分别加入相同质量分数的稀盐酸时,产生的H2质量与稀盐酸质量的关系
B. 图乙表示两份完全相同的双氧水在有无MnO2情况下,产生O2质量与反应时间的关系
C. 图丙表示向一定量的稀盐酸中加入过量的NaOH溶液时,溶液pH随NaOH溶液质量的变化关系
D. 图丁表示向一定量Ba(OH)2溶液中滴加过量H2SO4溶液时的溶液导电性与时间的关系
6.现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示气(已知甲、乙、丙在生成物中均显+2价)。则下列说法正确的是( )
A. 甲、乙、丙依次可能是Mg、Zn、Fe B. 金属活动性:甲>乙>丙
C. 相对原子质量:乙>丙>甲 D. 消耗硫酸的质量:甲>乙>丙
7.下列说法中正确的是( )
A. 碱的组成中一定含有氢、氧两种元素 B. 金属都可以与盐酸反应生成盐和氢气
C. 铁与氧气反应一定生成四氧化三铁 D. 含有金属元素和氧元素的化合物一定是金属氧化物
8.小科将未经砂布打磨的铝条放入盛有稀盐酸的密闭容器中,用传感器测得容器内温度和压强的变化,如图所示。下列分析中正确的是( )
A. 密闭容器内物质反应前后质量减少
B. 50s时,溶液中的溶质为AlCl3
C. 0~50s内,发生的反应是2Al+6HCl=2AlCl3+3H2↑
D. 100s~140s内,温度降低说明反应停止并逐渐冷却,导致压强减小
9.将等质量的镁、铁、锌,分别放入三份质量分数相同的稀盐酸中,反应生成的氢气质量与反应时间的关系如图所示。根据图中信息,下列判断正确的是( )
A. 图线 Y 表示镁的反应情况
B. 镁一定过量
C. 锌一定过量
D. 镁消耗稀盐酸的质量最大 试题卷 Ⅱ
10.常温下向一定质量的稀盐酸中逐渐加入镁条,充分反应(忽略挥发)。下列图像正确的是( )
A. ①② B. ②③ C. ①④ D. ②④
11.工业上用如下反应制取金属钡:2Al+4BaO 3Ba↑+Ba (AlO2)2。则下列说法错误的是( )
A. Al在反应中起氧化剂作用 B. 反应物BaO属于氧化物
C. 反应过程中,铝原子失去电子 D. 该反应属于置换反应
12.如图所示,弹簧秤下挂一重物,重物浸没在AgNO3溶液中,稳定时弹簧秤的读数为F1,再向烧杯中加入适量的铜粉,充分搅拌并静置足够的时间后,溶液的体积未变,此时弹簧秤的读数为F2,下列说法正确的是( )
A. F2F1 C. F2=F1 D. 无法判断
二、填空题
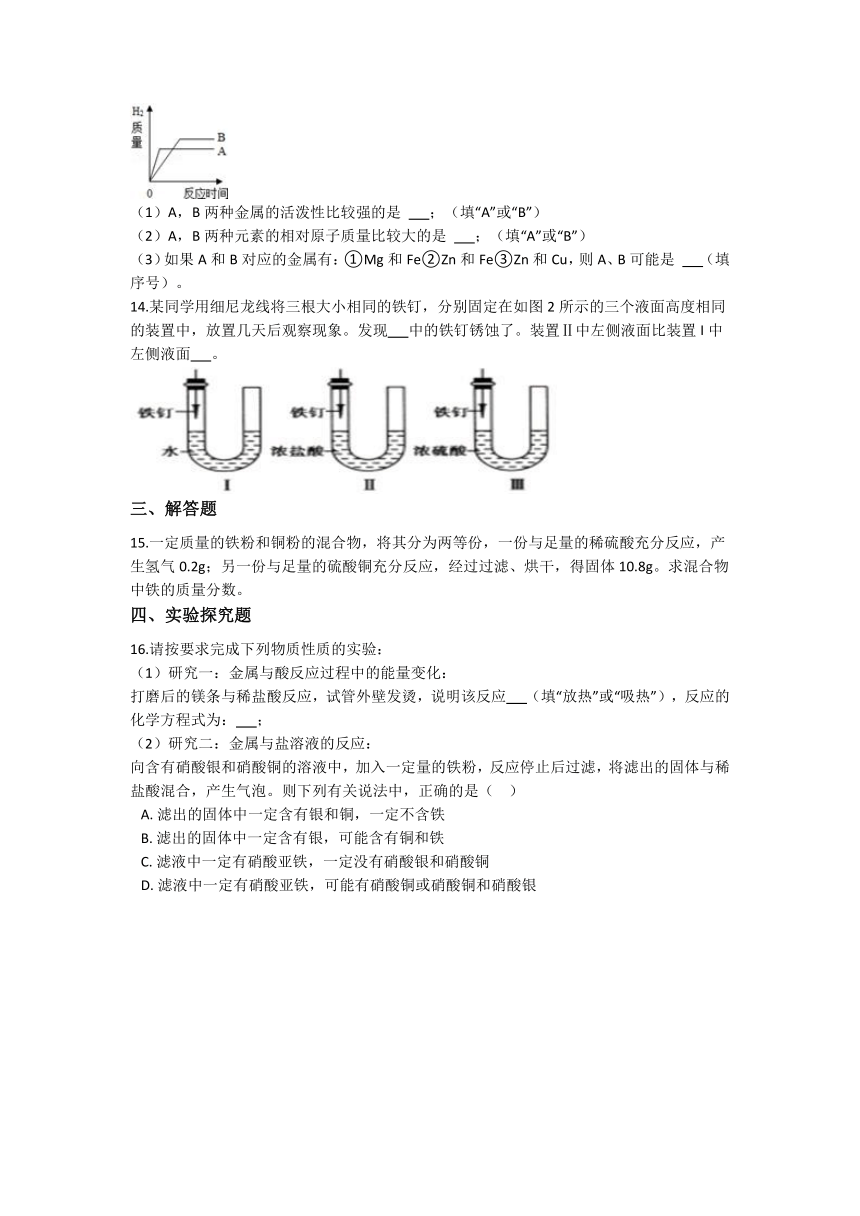
13.将形状相同、质量相同的A、B两种活泼金属薄片(在化合物中的化合价均为+2价)同时放入足量的盛放稀盐酸的烧杯中,产生H2的质量与反应时间的关系如图所示.
(1)A,B两种金属的活泼性比较强的是 ;(填“A”或“B”)
(2)A,B两种元素的相对原子质量比较大的是 ;(填“A”或“B”)
(3)如果A和B对应的金属有:①Mg和Fe②Zn和Fe③Zn和Cu,则A、B可能是 (填序号)。
14.某同学用细尼龙线将三根大小相同的铁钉,分别固定在如图2所示的三个液面高度相同的装置中,放置几天后观察现象。发现 中的铁钉锈蚀了。装置Ⅱ中左侧液面比装置I中左侧液面 。
三、解答题
15.一定质量的铁粉和铜粉的混合物,将其分为两等份,一份与足量的稀硫酸充分反应,产生氢气0.2g;另一份与足量的硫酸铜充分反应,经过过滤、烘干,得固体10.8g。求混合物中铁的质量分数。
四、实验探究题
16.请按要求完成下列物质性质的实验:
(1)研究一:金属与酸反应过程中的能量变化:
打磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应 (填“放热”或“吸热”),反应的化学方程式为: ;
(2)研究二:金属与盐溶液的反应:
向含有硝酸银和硝酸铜的溶液中,加入一定量的铁粉,反应停止后过滤,将滤出的固体与稀盐酸混合,产生气泡。则下列有关说法中,正确的是( )
A. 滤出的固体中一定含有银和铜,一定不含铁
B. 滤出的固体中一定含有银,可能含有铜和铁
C. 滤液中一定有硝酸亚铁,一定没有硝酸银和硝酸铜
D. 滤液中一定有硝酸亚铁,可能有硝酸铜或硝酸铜和硝酸银
答案解析部分
一、单选题
1.【答案】 D
【解析】【分析】气球a明显增大,肯定是装置内气压减小所致,据此分析判断。
【解答】A.氢氧化钠溶于水时放出大量的热,使装置内气压增大,故A不合题意;
B.铁粉和稀盐酸反应,生成氢气放出热量,使装置内气压增大,故B不合题意;
C.氯化钡和稀硫酸反应,生成硫酸钡沉淀和稀盐酸,装置内气压几乎不变,故C不合题意;
D.二氧化碳和氢氧化钠反应,生成碳酸钠和水,使装置内气压减小,故D符合题意。
故选D。
2.【答案】 C
【解析】【分析】(1)根据浮沉条件判断;根据金属钠是否溶液熔化判断;
(2)根据反应物和生成物的种类和种数确定反应类型;
(3)根据反应过程分析得到结论;
(4)无色酚酞试液遇到酸不变色,遇到碱变红色。
【解答】A.金属钠在水面漂浮,根据浮沉条件可知,它的密度小于水;金属钠迅速熔化成小球,说明它熔化时的温度比较低,即熔点较低,故A正确不合题意;
B.金属钠和水反应,生成氢氧化钠和氢气,这个反应为置换反应;氢氧化钠和硫酸铜反应,生成氢氧化铜沉淀和硫酸钠,这个反应为复分解反应,故B正确不合题意;
C.金属钠不会和硫酸铜溶液直接反应,故C错误符合题意;
D.反应结束后,溶质为硫酸钠和硫酸铜,溶液呈中性,滴入酚酞试液不变色,故D正确不合题意。
故选C。
3.【答案】 A
【解析】【分析】A.根据氧气的助燃性分析;
B.有新物质生成的变化为化学变化分析;
C.根据镁的活动性比铜强分析;
D.根据氯酸钾属于盐分析。
【解答】A、 O2具有助燃性 ,符合题意;
B、 铁生锈属于化学变化 ,不符合题意;
C、 金属活动性Cu比Mg弱 ,不符合题意;
D、 KClO3由三种元素组成,不属于氧化物 ,不符合题意;
故选A。
4.【答案】 C
【解析】【分析】根据向一定质量的Mg(NO3)2和Cu(NO3)2混合溶液中加入锌粉和铁粉的混合物, 锌和铁都能与硝酸铜反应,且锌先反应,然后铁再反应,锌与硝酸铜反应固体质量减少,铁与硝酸铜反应固体质量增加分析。
【解答】 向一定质量的Mg(NO3)2和Cu(NO3)2混合溶液中加入a克锌粉和铁粉的混合物, 锌和铁都能与硝酸铜反应,不能与硝酸镁反应,且锌与硝酸铜反应固体质量减少,铁与硝酸铜反应固体质量增加,反应后固体质量不变则说明锌和铁都与硝酸铜发生了反应,由金属活动性顺序可知,锌要与硝酸铜反应完全后铁才能与硝酸铜反应,说明反应后锌一定没有剩余,滤渣中一定有铜,一定没有锌,可能有铁,滤液中一定有硝酸镁、硝酸锌、硝酸亚铁,可能有硝酸铜,①滤渣中可能有铜,错误;②向滤渣中加稀盐酸,可能有气泡产生,正确;③滤液中一定有Mg(NO3)2、Zn(NO3)2和Fe(NO3)2,可能有Cu(NO3)2 , 正确;④若忽略过滤操作中溶液损失,滤液中溶质的质量等于原混合溶液溶质的质量,错误。
故选C。
5.【答案】 B
【解析】【分析】(1)在金属和酸的反应中,如果金属完全反应,那么相对原子质量越小的金属反应生成的氢气质量越多;
(2)催化剂只能改变化学反应的速率,而不能改变生成物的种类和质量;
(3)根据稀盐酸和氢氧化钠的反应分析;
(4)溶液的导电性强弱与离子浓度的大小有关。
【解答】A.质量相同的锌粉和铁粉与足量的稀盐酸反应后,铁粉反应生成氢气的质量大于锌粉,故A正确不合题意;
B.在双氧水分解制取氧气的实验中,加入二氧化锰后反应会加快,生成氧气的速度也会加快,但是最终生成氧气的质量相等,故B错误符合题意;
C.稀盐酸呈酸性,而氢氧化钠呈碱性,二者反应生成氯化钠和水,因此随着氢氧化钠溶液的加入,溶液的pH会不断增大,故C正确不合题意;
D.在开始的一段试剂内,氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,离子浓度逐渐减小到零;当氢氧化钡完全反应后,溶液中离子的浓度又逐渐增大,则溶液的导电性先减小到零再逐渐增大,故D正确不合题意。
故选B。
6.【答案】 D
【解析】【分析】(1)(2)金属越活泼,反应速率越快,反应需要时间越短;
(3)根据方程式M+H2SO4=MSO4+H2↑可知,当金属完全反应时,相对原子质量越大,生成氢气的质量越少;
(4)反应生成的氢气中的氢元素完全来自于硫酸。
【解答】由图中信息可知,完全反应所需时间:乙<甲<丙,则金属活动性强弱是:乙>甲>丙,则甲、乙、丙依次不可能是Mg、Zn、Fe,故A、B错误;
甲、乙、丙在生成物中均显+2价,稀硫酸足量,相对原子质量越大,生成的氢气质量越小,因此相对原子质量:丙>乙>甲,故C错误;
生成的氢气中的氢元素完全来自于硫酸,因此生成氢气质量越大,消耗硫酸质量越大,因此消耗硫酸的质量:甲>乙>丙,故D正确。
故选D。
7.【答案】 A
【解析】【分析】A、根据碱的组成分析;
B、根据活泼金属与盐酸能发生反应分析;
C、根据铁与氧气反应时条件不同产物不同分析;
D、根据金属氧化物定义分析。
【解答】A、 碱中含有氢氧根,组成中一定含有氢、氧两种元素 ,符合题意;
B、 在金属活动性顺序中,排在氢前的金属才能与盐酸反应,排在氢后面的金属不能与盐酸反应,不符合题意;
C、 铁与氧气常温反应生成氧化铁,加热或点燃条件下生成四氧化三铁 ,不符合题意;
D、 含有金属元素和氧元素的化合物可能是金属氧化物 ,也可能是盐,如碳酸钠等,不符合题意;
故选A。
8.【答案】 D
【解析】【分析】根据铝表面有氧化铝膜,加入盐酸时,盐酸先与氧化铝反应,然后再与铝反应,铝和盐酸反应放热,同时产生氢气,使装置内压强增大,反应结束后温度降低,压强再稍减小分析。
【解答】A、密闭容器内物质反应前后质量不变 ,不符合题意;
B、50s时,氧化铝与盐酸发生反应,盐酸有剩余,则溶液中的溶质为AlCl3和HCl ,不符合题意;
C、0~50s内,氧化铝与盐酸发生反应,方程式为Al2O3+6HCl=2AlCl3+3H2O ,不符合题意;
D、反应时放热使温度升高,因反应停止,温度降低,导致压强减小 ,所以100s~140s内反应停止,逐渐冷却,导致压强减小,符合题意;
故选D。
9.【答案】 B
【解析】【分析】根据图示中产生氢气的多少及快慢分析,产生氢气快慢与金属活动性顺序有关,产生氢气多少与其相对原子质量有关。
【解答】A、 三种金属活动性顺序为镁>锌>铁,图线 Y相等时间产生氢气小于X大于Z,说明Y为锌, 不符合题意;
B、Z为镁、Y为锌、Z为铁, 等质量的镁、铁、锌,分别放入三份质量分数相同的稀盐酸中 ,X和Y最终产生氢气相等,Z最多,说明镁一定过量 ,符合题意;
C、锌可能过量也可能刚好完全反应,不符合题意;
D、铁产生氢气最多,则消耗盐酸质量最大,不符合题意;
故选B。
10.【答案】 C
【解析】【分析】根据镁与盐酸反应生成氯化镁和氢气,该反应属于放热反应,及反应中各物质的质量的变化情况分析。
【解答】 常温下向一定质量的稀盐酸中逐渐加入镁条, 由方程式可知,每反应24份质量的镁,产生2份质量的氢气,所以溶液质量在原有基础上会随着反应的发生而增加,直到反应结束后保持不变, ① 正确;金属与酸反应会放出热量,温度升高,但反应停止后由于热传递温度会再恢复到原来的值, ② 错误;气体体积随着反应的发生而增加,盐酸反应结束后要保持不变, ③错误;反应前后氢元素质量保持不变, ④正确;
故选C。
11.【答案】 A
【解析】【分析】A、根据得氧或化合价升高的物质作还原剂分析;
B、根据氧化物为两种元素组成其中一种元素为氧元素的化合物分析;
C、根据铝原子最外层电子数为3易失电子分析;
D、根据置换反应反应物和生成物都一种单质一种化合物分析。
【解答】A、 Al在反应得氧,起还原剂作用 ,符合题意;
B、 反应物BaO属于氧化物 ,不符合题意;
C、反应过程中,铝的化合价由0价升至+3价,铝原子失去电子 ,不符合题意;
D、 该反应反应物和生成物都一种单质一种化合物,属于置换反应 不符合题意;
故选A。
12.【答案】 B
【解析】【分析】根据铜和硝酸银的反应,确定溶液密度的变化,再根据阿基米德原理F浮=ρ液gV排判断重物受到浮力的变化,最后再根据F拉=G-F浮分析测力计示数的改变。
【解答】铜和硝酸银的反应,生成硝酸铜和银单质,由于进入的铜的质量小于析出的银的质量,因此溶液的密度会变小。根据阿基米德原理F浮=ρ液ghV排可知,重物受到的浮力减小了。根据F拉=G-F浮可知,弹簧测力计的示数增大了,故B正确,而A、C、D错误。
故选B。
二、填空题
13.【答案】 (1)A
(2)A
(3)②
【解析】【分析】(1)在金属与酸的反应中,金属的活泼性越强,生成氢气的速率越大;
(2)金属与足量的酸反应,且当金属在生成物中的化合价相同时,通常金属的相对原子质量越大,产生的氢气越少,据此分析判断;
(3)根据两种金属的活泼性强弱和相对原子质量的大小进行判断选择。
【解答】(1)金属的活泼型越强,与酸反应生成氢气的速率越大,在坐标中的斜线越陡。据图可以看出,A的斜线比B陡,则金属活泼型比较强的是A。
(2)金属与足量的酸反应,且当金属在生成物中的化合价相同时,通常金属的相对原子质量越大,产生的氢气越少,据图可以看出A产生的氢气少,故A的相对原子质量比较大。
(3)根据图像可知,A比B的活泼型更强,而A的相对原子质量大于B,则A、B可能是锌和铁,故选②。
14.【答案】 Ⅰ、Ⅱ;低
【解析】【分析】(1)铁生锈的条件:与氧气和水接触;
(2)分析装置II内左侧封闭空间内气压的变化即可。
【解答】(1)装置I、II中,铁钉能够与氧气和水接触,因此会生锈;而III中浓硫酸会吸收空气中的水蒸气,则铁钉只能与氧气接触,不能与水接触,因此不会生锈。
(2)在装置II中,浓盐酸会挥发出氯化氢气体,从而使装置II中左侧气压大于装置I中左侧气压,因此装置Ⅱ中左侧液面比装置I中左侧液面低。
三、解答题
15.【答案】 解:设与稀硫酸反应的铁的质量为x
Fe+H2SO4=FeSO4+ H2↑
56 2
x 0.2g
∴
∴x=5.6g
设铁与硫酸铜反应生成铜的质量为y
Fe+CuSO4=FeSO4+ Cu
56 64
5.6g y
∴
∴ y= 6.4g
∴原混合物中铜的质量:10.8g-6.4g=4.4g
∴原混合物中铁的质量分数: 56%
答:原混合物中铁的质量分数为56%
【解析】【分析】根据生成氢气的质量先计算出反应的铁的质量,再利用反应铁的质量,利用方程式中物质间质量关系计算生成铜的质量,再计算出原混合物中铜的质量,从而确定铁的质量分数分析。
四、实验探究题
16.【答案】 (1)放热;Mg+2HCl═MgCl2+H2↑
(2)C
【解析】【分析】(1)反应时温度升高为放热,温度降低为吸热。确定反应物、反应条件和生成物,据此写出反应的方程式。
(2)根据金属活动性顺序表进行分析判断。
【解答】(1)磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应放热。镁和稀盐酸反应,生成氯化镁和氢气,则反应的方程式为: Mg+2HCl═MgCl2+H2↑ 。
(2)在金属活动性顺序表中,只有铁排在氢的前面,能够和稀盐酸反应生成氢气,而铜和银都排在氢的后面,不能与稀盐酸反应。据此可知,过滤出的产物与稀盐酸混合产生气泡,那么肯定存在铁。而铁先和硝酸银反应,再和硝酸铜反应,既然固体中存在铁,那么溶液中的硝酸铜和硝酸银全部反应,因此滤液中肯定存在反应产物硝酸亚铁,肯定没有硝酸铜和硝酸银,故C正确,D错误;
而固体中肯定存在铁、铜和银,故A、B错误。
故选C。
一、单选题
1.如图所示,装置气密性良好,弹簧夹处于关闭状态。向试管中加入下表中的物质,挤压胶头滴管加入液体,一段时间后,打开弹簧夹,能使气球a明显鼓起的是( )
试管内物质 胶头滴管内物质
A 氢氧化钠固体 水
B 铁粉 稀盐酸
C 氯化钡溶液 稀硫酸
D 二氧化碳 氢氧化钠溶液
A. A B. B C. C D. D
2.如图所示,将一小块金属钠放入CuSO4溶液中,金属钠立即熔化成小球,并在液面上快速游动,发出“哧哧”的声音,直到消失,同时杯底出现蓝色沉淀,溶液仍为蓝色。下列说法错误的是( )
A. 可推测出金属钠的密度比杯中溶液的密度小、熔点比较低
B. 发生了置换反应、复分解反应
C. 由此实验可得结论:金属钠能将CuSO4溶液中的Cu置换出来
D. 若向反应结束后的烧杯中滴入无色酚酞试液,则试液不变红色
3.下列有关说法正确的是( )
A. O2具有助燃性 B. 铁生锈属于物理变化 C. 金属活动性Cu比Mg强 D. KClO3属于氧化物
4.向一定质量的Mg(NO3)2和Cu(NO3)2混合溶液中加入a克锌粉和铁粉的混合物,充分反应后过滤,得到不饱和的滤液和滤渣,将滤渣洗涤、干燥后再称量,得到的固体质量仍为a克。下列分析合理的是( )
①滤渣中可能有铜 ②向滤渣中加稀盐酸,可能有气泡产生
③滤液中一定有Mg(NO3)2、Zn(NO3)2和Fe(NO3)2,可能有Cu(NO3)2
④若忽略过滤操作中溶液损失,滤液中溶质的质量一定大于原混合溶液溶质的质量
A. ①② B. ①③ C. ②③ D. ②④
5.下列图像不能正确表示对应变化关系的是( )
A. 图甲表示向等质量的锌粉和铁粉中,分别加入相同质量分数的稀盐酸时,产生的H2质量与稀盐酸质量的关系
B. 图乙表示两份完全相同的双氧水在有无MnO2情况下,产生O2质量与反应时间的关系
C. 图丙表示向一定量的稀盐酸中加入过量的NaOH溶液时,溶液pH随NaOH溶液质量的变化关系
D. 图丁表示向一定量Ba(OH)2溶液中滴加过量H2SO4溶液时的溶液导电性与时间的关系
6.现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示气(已知甲、乙、丙在生成物中均显+2价)。则下列说法正确的是( )
A. 甲、乙、丙依次可能是Mg、Zn、Fe B. 金属活动性:甲>乙>丙
C. 相对原子质量:乙>丙>甲 D. 消耗硫酸的质量:甲>乙>丙
7.下列说法中正确的是( )
A. 碱的组成中一定含有氢、氧两种元素 B. 金属都可以与盐酸反应生成盐和氢气
C. 铁与氧气反应一定生成四氧化三铁 D. 含有金属元素和氧元素的化合物一定是金属氧化物
8.小科将未经砂布打磨的铝条放入盛有稀盐酸的密闭容器中,用传感器测得容器内温度和压强的变化,如图所示。下列分析中正确的是( )
A. 密闭容器内物质反应前后质量减少
B. 50s时,溶液中的溶质为AlCl3
C. 0~50s内,发生的反应是2Al+6HCl=2AlCl3+3H2↑
D. 100s~140s内,温度降低说明反应停止并逐渐冷却,导致压强减小
9.将等质量的镁、铁、锌,分别放入三份质量分数相同的稀盐酸中,反应生成的氢气质量与反应时间的关系如图所示。根据图中信息,下列判断正确的是( )
A. 图线 Y 表示镁的反应情况
B. 镁一定过量
C. 锌一定过量
D. 镁消耗稀盐酸的质量最大 试题卷 Ⅱ
10.常温下向一定质量的稀盐酸中逐渐加入镁条,充分反应(忽略挥发)。下列图像正确的是( )
A. ①② B. ②③ C. ①④ D. ②④
11.工业上用如下反应制取金属钡:2Al+4BaO 3Ba↑+Ba (AlO2)2。则下列说法错误的是( )
A. Al在反应中起氧化剂作用 B. 反应物BaO属于氧化物
C. 反应过程中,铝原子失去电子 D. 该反应属于置换反应
12.如图所示,弹簧秤下挂一重物,重物浸没在AgNO3溶液中,稳定时弹簧秤的读数为F1,再向烧杯中加入适量的铜粉,充分搅拌并静置足够的时间后,溶液的体积未变,此时弹簧秤的读数为F2,下列说法正确的是( )
A. F2
二、填空题
13.将形状相同、质量相同的A、B两种活泼金属薄片(在化合物中的化合价均为+2价)同时放入足量的盛放稀盐酸的烧杯中,产生H2的质量与反应时间的关系如图所示.
(1)A,B两种金属的活泼性比较强的是 ;(填“A”或“B”)
(2)A,B两种元素的相对原子质量比较大的是 ;(填“A”或“B”)
(3)如果A和B对应的金属有:①Mg和Fe②Zn和Fe③Zn和Cu,则A、B可能是 (填序号)。
14.某同学用细尼龙线将三根大小相同的铁钉,分别固定在如图2所示的三个液面高度相同的装置中,放置几天后观察现象。发现 中的铁钉锈蚀了。装置Ⅱ中左侧液面比装置I中左侧液面 。
三、解答题
15.一定质量的铁粉和铜粉的混合物,将其分为两等份,一份与足量的稀硫酸充分反应,产生氢气0.2g;另一份与足量的硫酸铜充分反应,经过过滤、烘干,得固体10.8g。求混合物中铁的质量分数。
四、实验探究题
16.请按要求完成下列物质性质的实验:
(1)研究一:金属与酸反应过程中的能量变化:
打磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应 (填“放热”或“吸热”),反应的化学方程式为: ;
(2)研究二:金属与盐溶液的反应:
向含有硝酸银和硝酸铜的溶液中,加入一定量的铁粉,反应停止后过滤,将滤出的固体与稀盐酸混合,产生气泡。则下列有关说法中,正确的是( )
A. 滤出的固体中一定含有银和铜,一定不含铁
B. 滤出的固体中一定含有银,可能含有铜和铁
C. 滤液中一定有硝酸亚铁,一定没有硝酸银和硝酸铜
D. 滤液中一定有硝酸亚铁,可能有硝酸铜或硝酸铜和硝酸银
答案解析部分
一、单选题
1.【答案】 D
【解析】【分析】气球a明显增大,肯定是装置内气压减小所致,据此分析判断。
【解答】A.氢氧化钠溶于水时放出大量的热,使装置内气压增大,故A不合题意;
B.铁粉和稀盐酸反应,生成氢气放出热量,使装置内气压增大,故B不合题意;
C.氯化钡和稀硫酸反应,生成硫酸钡沉淀和稀盐酸,装置内气压几乎不变,故C不合题意;
D.二氧化碳和氢氧化钠反应,生成碳酸钠和水,使装置内气压减小,故D符合题意。
故选D。
2.【答案】 C
【解析】【分析】(1)根据浮沉条件判断;根据金属钠是否溶液熔化判断;
(2)根据反应物和生成物的种类和种数确定反应类型;
(3)根据反应过程分析得到结论;
(4)无色酚酞试液遇到酸不变色,遇到碱变红色。
【解答】A.金属钠在水面漂浮,根据浮沉条件可知,它的密度小于水;金属钠迅速熔化成小球,说明它熔化时的温度比较低,即熔点较低,故A正确不合题意;
B.金属钠和水反应,生成氢氧化钠和氢气,这个反应为置换反应;氢氧化钠和硫酸铜反应,生成氢氧化铜沉淀和硫酸钠,这个反应为复分解反应,故B正确不合题意;
C.金属钠不会和硫酸铜溶液直接反应,故C错误符合题意;
D.反应结束后,溶质为硫酸钠和硫酸铜,溶液呈中性,滴入酚酞试液不变色,故D正确不合题意。
故选C。
3.【答案】 A
【解析】【分析】A.根据氧气的助燃性分析;
B.有新物质生成的变化为化学变化分析;
C.根据镁的活动性比铜强分析;
D.根据氯酸钾属于盐分析。
【解答】A、 O2具有助燃性 ,符合题意;
B、 铁生锈属于化学变化 ,不符合题意;
C、 金属活动性Cu比Mg弱 ,不符合题意;
D、 KClO3由三种元素组成,不属于氧化物 ,不符合题意;
故选A。
4.【答案】 C
【解析】【分析】根据向一定质量的Mg(NO3)2和Cu(NO3)2混合溶液中加入锌粉和铁粉的混合物, 锌和铁都能与硝酸铜反应,且锌先反应,然后铁再反应,锌与硝酸铜反应固体质量减少,铁与硝酸铜反应固体质量增加分析。
【解答】 向一定质量的Mg(NO3)2和Cu(NO3)2混合溶液中加入a克锌粉和铁粉的混合物, 锌和铁都能与硝酸铜反应,不能与硝酸镁反应,且锌与硝酸铜反应固体质量减少,铁与硝酸铜反应固体质量增加,反应后固体质量不变则说明锌和铁都与硝酸铜发生了反应,由金属活动性顺序可知,锌要与硝酸铜反应完全后铁才能与硝酸铜反应,说明反应后锌一定没有剩余,滤渣中一定有铜,一定没有锌,可能有铁,滤液中一定有硝酸镁、硝酸锌、硝酸亚铁,可能有硝酸铜,①滤渣中可能有铜,错误;②向滤渣中加稀盐酸,可能有气泡产生,正确;③滤液中一定有Mg(NO3)2、Zn(NO3)2和Fe(NO3)2,可能有Cu(NO3)2 , 正确;④若忽略过滤操作中溶液损失,滤液中溶质的质量等于原混合溶液溶质的质量,错误。
故选C。
5.【答案】 B
【解析】【分析】(1)在金属和酸的反应中,如果金属完全反应,那么相对原子质量越小的金属反应生成的氢气质量越多;
(2)催化剂只能改变化学反应的速率,而不能改变生成物的种类和质量;
(3)根据稀盐酸和氢氧化钠的反应分析;
(4)溶液的导电性强弱与离子浓度的大小有关。
【解答】A.质量相同的锌粉和铁粉与足量的稀盐酸反应后,铁粉反应生成氢气的质量大于锌粉,故A正确不合题意;
B.在双氧水分解制取氧气的实验中,加入二氧化锰后反应会加快,生成氧气的速度也会加快,但是最终生成氧气的质量相等,故B错误符合题意;
C.稀盐酸呈酸性,而氢氧化钠呈碱性,二者反应生成氯化钠和水,因此随着氢氧化钠溶液的加入,溶液的pH会不断增大,故C正确不合题意;
D.在开始的一段试剂内,氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,离子浓度逐渐减小到零;当氢氧化钡完全反应后,溶液中离子的浓度又逐渐增大,则溶液的导电性先减小到零再逐渐增大,故D正确不合题意。
故选B。
6.【答案】 D
【解析】【分析】(1)(2)金属越活泼,反应速率越快,反应需要时间越短;
(3)根据方程式M+H2SO4=MSO4+H2↑可知,当金属完全反应时,相对原子质量越大,生成氢气的质量越少;
(4)反应生成的氢气中的氢元素完全来自于硫酸。
【解答】由图中信息可知,完全反应所需时间:乙<甲<丙,则金属活动性强弱是:乙>甲>丙,则甲、乙、丙依次不可能是Mg、Zn、Fe,故A、B错误;
甲、乙、丙在生成物中均显+2价,稀硫酸足量,相对原子质量越大,生成的氢气质量越小,因此相对原子质量:丙>乙>甲,故C错误;
生成的氢气中的氢元素完全来自于硫酸,因此生成氢气质量越大,消耗硫酸质量越大,因此消耗硫酸的质量:甲>乙>丙,故D正确。
故选D。
7.【答案】 A
【解析】【分析】A、根据碱的组成分析;
B、根据活泼金属与盐酸能发生反应分析;
C、根据铁与氧气反应时条件不同产物不同分析;
D、根据金属氧化物定义分析。
【解答】A、 碱中含有氢氧根,组成中一定含有氢、氧两种元素 ,符合题意;
B、 在金属活动性顺序中,排在氢前的金属才能与盐酸反应,排在氢后面的金属不能与盐酸反应,不符合题意;
C、 铁与氧气常温反应生成氧化铁,加热或点燃条件下生成四氧化三铁 ,不符合题意;
D、 含有金属元素和氧元素的化合物可能是金属氧化物 ,也可能是盐,如碳酸钠等,不符合题意;
故选A。
8.【答案】 D
【解析】【分析】根据铝表面有氧化铝膜,加入盐酸时,盐酸先与氧化铝反应,然后再与铝反应,铝和盐酸反应放热,同时产生氢气,使装置内压强增大,反应结束后温度降低,压强再稍减小分析。
【解答】A、密闭容器内物质反应前后质量不变 ,不符合题意;
B、50s时,氧化铝与盐酸发生反应,盐酸有剩余,则溶液中的溶质为AlCl3和HCl ,不符合题意;
C、0~50s内,氧化铝与盐酸发生反应,方程式为Al2O3+6HCl=2AlCl3+3H2O ,不符合题意;
D、反应时放热使温度升高,因反应停止,温度降低,导致压强减小 ,所以100s~140s内反应停止,逐渐冷却,导致压强减小,符合题意;
故选D。
9.【答案】 B
【解析】【分析】根据图示中产生氢气的多少及快慢分析,产生氢气快慢与金属活动性顺序有关,产生氢气多少与其相对原子质量有关。
【解答】A、 三种金属活动性顺序为镁>锌>铁,图线 Y相等时间产生氢气小于X大于Z,说明Y为锌, 不符合题意;
B、Z为镁、Y为锌、Z为铁, 等质量的镁、铁、锌,分别放入三份质量分数相同的稀盐酸中 ,X和Y最终产生氢气相等,Z最多,说明镁一定过量 ,符合题意;
C、锌可能过量也可能刚好完全反应,不符合题意;
D、铁产生氢气最多,则消耗盐酸质量最大,不符合题意;
故选B。
10.【答案】 C
【解析】【分析】根据镁与盐酸反应生成氯化镁和氢气,该反应属于放热反应,及反应中各物质的质量的变化情况分析。
【解答】 常温下向一定质量的稀盐酸中逐渐加入镁条, 由方程式可知,每反应24份质量的镁,产生2份质量的氢气,所以溶液质量在原有基础上会随着反应的发生而增加,直到反应结束后保持不变, ① 正确;金属与酸反应会放出热量,温度升高,但反应停止后由于热传递温度会再恢复到原来的值, ② 错误;气体体积随着反应的发生而增加,盐酸反应结束后要保持不变, ③错误;反应前后氢元素质量保持不变, ④正确;
故选C。
11.【答案】 A
【解析】【分析】A、根据得氧或化合价升高的物质作还原剂分析;
B、根据氧化物为两种元素组成其中一种元素为氧元素的化合物分析;
C、根据铝原子最外层电子数为3易失电子分析;
D、根据置换反应反应物和生成物都一种单质一种化合物分析。
【解答】A、 Al在反应得氧,起还原剂作用 ,符合题意;
B、 反应物BaO属于氧化物 ,不符合题意;
C、反应过程中,铝的化合价由0价升至+3价,铝原子失去电子 ,不符合题意;
D、 该反应反应物和生成物都一种单质一种化合物,属于置换反应 不符合题意;
故选A。
12.【答案】 B
【解析】【分析】根据铜和硝酸银的反应,确定溶液密度的变化,再根据阿基米德原理F浮=ρ液gV排判断重物受到浮力的变化,最后再根据F拉=G-F浮分析测力计示数的改变。
【解答】铜和硝酸银的反应,生成硝酸铜和银单质,由于进入的铜的质量小于析出的银的质量,因此溶液的密度会变小。根据阿基米德原理F浮=ρ液ghV排可知,重物受到的浮力减小了。根据F拉=G-F浮可知,弹簧测力计的示数增大了,故B正确,而A、C、D错误。
故选B。
二、填空题
13.【答案】 (1)A
(2)A
(3)②
【解析】【分析】(1)在金属与酸的反应中,金属的活泼性越强,生成氢气的速率越大;
(2)金属与足量的酸反应,且当金属在生成物中的化合价相同时,通常金属的相对原子质量越大,产生的氢气越少,据此分析判断;
(3)根据两种金属的活泼性强弱和相对原子质量的大小进行判断选择。
【解答】(1)金属的活泼型越强,与酸反应生成氢气的速率越大,在坐标中的斜线越陡。据图可以看出,A的斜线比B陡,则金属活泼型比较强的是A。
(2)金属与足量的酸反应,且当金属在生成物中的化合价相同时,通常金属的相对原子质量越大,产生的氢气越少,据图可以看出A产生的氢气少,故A的相对原子质量比较大。
(3)根据图像可知,A比B的活泼型更强,而A的相对原子质量大于B,则A、B可能是锌和铁,故选②。
14.【答案】 Ⅰ、Ⅱ;低
【解析】【分析】(1)铁生锈的条件:与氧气和水接触;
(2)分析装置II内左侧封闭空间内气压的变化即可。
【解答】(1)装置I、II中,铁钉能够与氧气和水接触,因此会生锈;而III中浓硫酸会吸收空气中的水蒸气,则铁钉只能与氧气接触,不能与水接触,因此不会生锈。
(2)在装置II中,浓盐酸会挥发出氯化氢气体,从而使装置II中左侧气压大于装置I中左侧气压,因此装置Ⅱ中左侧液面比装置I中左侧液面低。
三、解答题
15.【答案】 解:设与稀硫酸反应的铁的质量为x
Fe+H2SO4=FeSO4+ H2↑
56 2
x 0.2g
∴
∴x=5.6g
设铁与硫酸铜反应生成铜的质量为y
Fe+CuSO4=FeSO4+ Cu
56 64
5.6g y
∴
∴ y= 6.4g
∴原混合物中铜的质量:10.8g-6.4g=4.4g
∴原混合物中铁的质量分数: 56%
答:原混合物中铁的质量分数为56%
【解析】【分析】根据生成氢气的质量先计算出反应的铁的质量,再利用反应铁的质量,利用方程式中物质间质量关系计算生成铜的质量,再计算出原混合物中铜的质量,从而确定铁的质量分数分析。
四、实验探究题
16.【答案】 (1)放热;Mg+2HCl═MgCl2+H2↑
(2)C
【解析】【分析】(1)反应时温度升高为放热,温度降低为吸热。确定反应物、反应条件和生成物,据此写出反应的方程式。
(2)根据金属活动性顺序表进行分析判断。
【解答】(1)磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应放热。镁和稀盐酸反应,生成氯化镁和氢气,则反应的方程式为: Mg+2HCl═MgCl2+H2↑ 。
(2)在金属活动性顺序表中,只有铁排在氢的前面,能够和稀盐酸反应生成氢气,而铜和银都排在氢的后面,不能与稀盐酸反应。据此可知,过滤出的产物与稀盐酸混合产生气泡,那么肯定存在铁。而铁先和硝酸银反应,再和硝酸铜反应,既然固体中存在铁,那么溶液中的硝酸铜和硝酸银全部反应,因此滤液中肯定存在反应产物硝酸亚铁,肯定没有硝酸铜和硝酸银,故C正确,D错误;
而固体中肯定存在铁、铜和银,故A、B错误。
故选C。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
