人教版化学九年级下册 9.4实验活动5 一定溶质质量分数的氯化钠溶液的配制 同步课件(10张PPT)
文档属性
| 名称 | 人教版化学九年级下册 9.4实验活动5 一定溶质质量分数的氯化钠溶液的配制 同步课件(10张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-07 10:08:59 | ||
图片预览




文档简介
(共10张PPT)
空白演示
单击输入您的封面副标题
九年级化学下册(RJ)
教学课件
第九单元 溶液
实验活动5
一定溶质质量分数的氯化钠
溶液的配制
托盘天平、烧杯、量筒、玻璃棒、药匙、胶头滴管。氯化钠、蒸馏水。
【实验目的】
1.练习配制一定溶质质量分数的溶液。
2.加深对溶质的质量分数概念的理解。
【实验用品】
实验探究:配制一定溶质质量分数的溶液
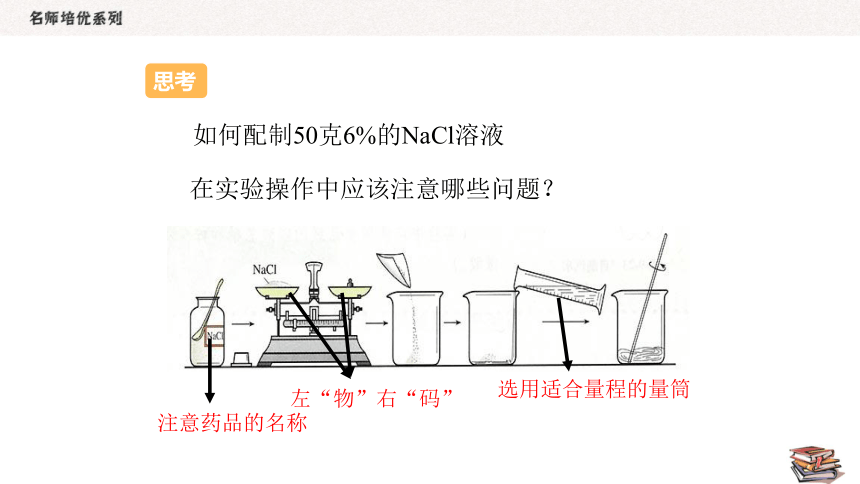
注意药品的名称
左“物”右“码”
选用适合量程的量筒
在实验操作中应该注意哪些问题?
如何配制50克6%的NaCl溶液
思考
托盘天平使用
注意事项:
(1)使用前要调零
(2)两个托盘上各放一张大小相同的称量纸
(3)称量时遵循左物右码的原则
(4)用镊子夹取砝码应按照从大到小的顺序
(5)称量完毕应将砝码放回盒中,游码归零
1.配制 50g 6% 的氯化钠溶液
⑴计算: NaCl g H2O g。
⑵称量:用____称量3g食盐,放入烧杯中。
⑶量取:用__量取47mL水,倒入盛有氯化钠的烧杯中。
⑷溶解:用玻璃棒搅拌,使氯化钠溶解。
3
47
托盘天平
量筒
【实验步骤】
用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
(1)计算:
6%的氯化钠溶液 g
(体积 mL );
水 g。
25
25
24
(2)量取:
用量筒量取24mL的6%氯化钠溶液和25mL的水,倒入烧杯中。
(3)混匀:
用玻璃棒搅拌,使溶液混合均匀。
50g×3%÷6%=25g
25g÷1.04g/cm3=24mL
50g-25g=25g
2.配制质量分数为3%的氯化钠溶液
3.把配制好的上述两种氯化钠溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。
(1)造成实际值偏小的可能原因
①溶质溶解的量变少了:溶质本身不纯;左码右物称量;天平空载时,指针向左偏;溶质有撒落;溶质没有完全溶解就装瓶存放了
②溶剂的量增多了:仰视量取;烧杯内壁上有水;试剂瓶内壁上有水
(2)造成实际值偏大的可能原因
①溶剂的量减少了: 俯视量取溶剂;量取的水没有完全转移到烧杯中
②溶质溶解的量变多了:天平空载时,指针向右偏;称量时,所用砝码已生锈或沾有油污
【问题与交流】
空白演示
单击输入您的封面副标题
九年级化学下册(RJ)
教学课件
第九单元 溶液
实验活动5
一定溶质质量分数的氯化钠
溶液的配制
托盘天平、烧杯、量筒、玻璃棒、药匙、胶头滴管。氯化钠、蒸馏水。
【实验目的】
1.练习配制一定溶质质量分数的溶液。
2.加深对溶质的质量分数概念的理解。
【实验用品】
实验探究:配制一定溶质质量分数的溶液
注意药品的名称
左“物”右“码”
选用适合量程的量筒
在实验操作中应该注意哪些问题?
如何配制50克6%的NaCl溶液
思考
托盘天平使用
注意事项:
(1)使用前要调零
(2)两个托盘上各放一张大小相同的称量纸
(3)称量时遵循左物右码的原则
(4)用镊子夹取砝码应按照从大到小的顺序
(5)称量完毕应将砝码放回盒中,游码归零
1.配制 50g 6% 的氯化钠溶液
⑴计算: NaCl g H2O g。
⑵称量:用____称量3g食盐,放入烧杯中。
⑶量取:用__量取47mL水,倒入盛有氯化钠的烧杯中。
⑷溶解:用玻璃棒搅拌,使氯化钠溶解。
3
47
托盘天平
量筒
【实验步骤】
用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
(1)计算:
6%的氯化钠溶液 g
(体积 mL );
水 g。
25
25
24
(2)量取:
用量筒量取24mL的6%氯化钠溶液和25mL的水,倒入烧杯中。
(3)混匀:
用玻璃棒搅拌,使溶液混合均匀。
50g×3%÷6%=25g
25g÷1.04g/cm3=24mL
50g-25g=25g
2.配制质量分数为3%的氯化钠溶液
3.把配制好的上述两种氯化钠溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。
(1)造成实际值偏小的可能原因
①溶质溶解的量变少了:溶质本身不纯;左码右物称量;天平空载时,指针向左偏;溶质有撒落;溶质没有完全溶解就装瓶存放了
②溶剂的量增多了:仰视量取;烧杯内壁上有水;试剂瓶内壁上有水
(2)造成实际值偏大的可能原因
①溶剂的量减少了: 俯视量取溶剂;量取的水没有完全转移到烧杯中
②溶质溶解的量变多了:天平空载时,指针向右偏;称量时,所用砝码已生锈或沾有油污
【问题与交流】
同课章节目录
