人教版化学九年级下册 9.2.1 饱和溶液与不饱和溶液 同步课件(18张PPT)
文档属性
| 名称 | 人教版化学九年级下册 9.2.1 饱和溶液与不饱和溶液 同步课件(18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-07 10:08:02 | ||
图片预览



文档简介
(共19张PPT)
空白演示
单击输入您的封面副标题
九年级化学下册(RJ)
教学课件
第九单元 溶液
课题2 溶解度
第1课时 饱和溶液和不饱和溶液
我国北方有许多盐碱湖,湖水中溶有大量的食盐(NaCl)和纯碱(Na2CO3),那里的农民冬天捞碱,夏天晒盐,你知道为什么吗?
导入新课
1.知道什么是饱和溶液和不饱和溶液,知道两者之间如何转化;
2.知道饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系;
3.知道结晶的方法。
学习目标
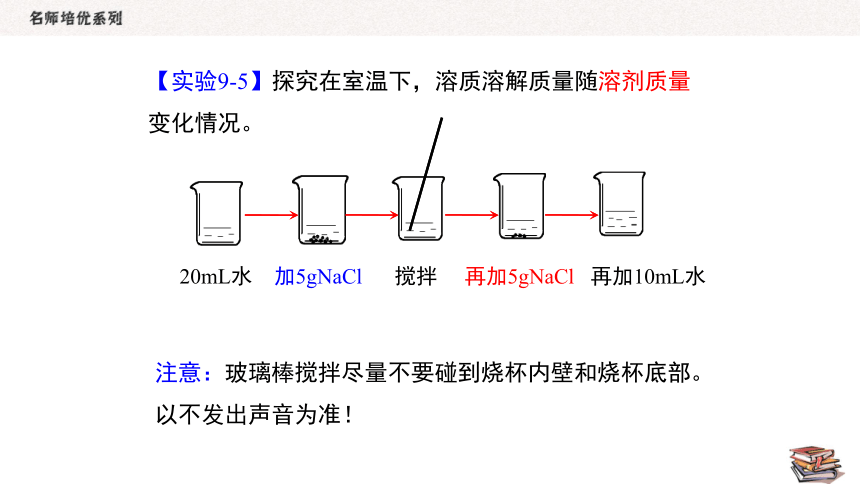
20mL水 加5gNaCl 搅拌 再加5gNaCl 再加10mL水
注意:玻璃棒搅拌尽量不要碰到烧杯内壁和烧杯底部。以不发出声音为准!
【实验9-5】探究在室温下,溶质溶解质量随溶剂质量变化情况。
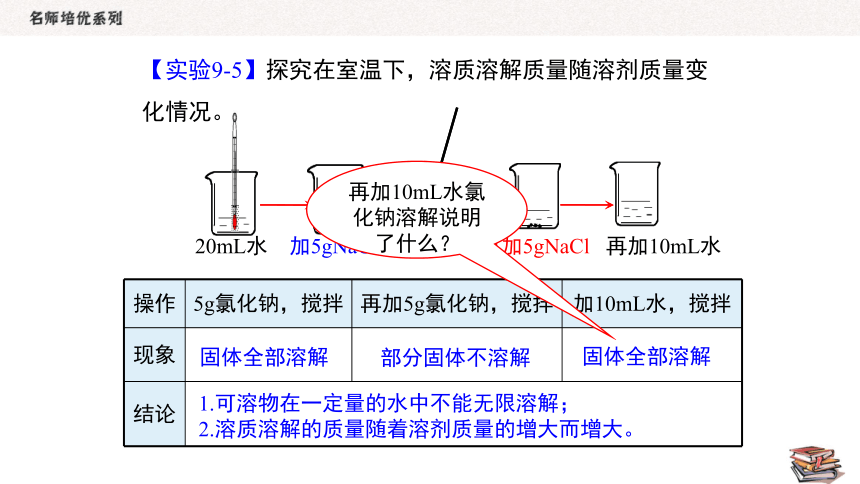
20mL水 加5gNaCl 搅拌 再加5gNaCl 再加10mL水
操作 5g氯化钠,搅拌 再加5g氯化钠,搅拌 加10mL水,搅拌
现象
结论 固体全部溶解
部分固体不溶解
固体全部溶解
1.可溶物在一定量的水中不能无限溶解;
2.溶质溶解的质量随着溶剂质量的增大而增大。
再加10mL水氯化钠溶解说明了什么?
【实验9-5】探究在室温下,溶质溶解质量随溶剂质量变化情况。
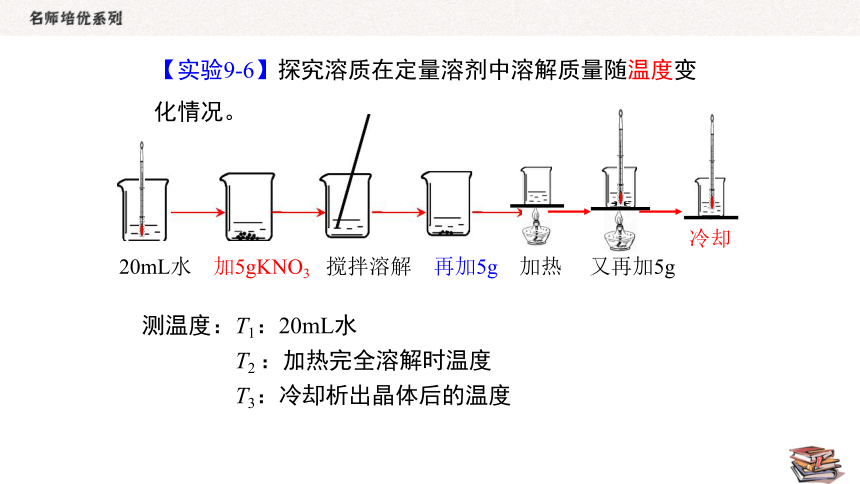
20mL水 加5gKNO3 搅拌溶解 再加5g 加热 又再加5g
【实验9-6】探究溶质在定量溶剂中溶解质量随温度变化情况。
冷却
测温度:T1:20mL水
T2 :加热完全溶解时温度
T3:冷却析出晶体后的温度
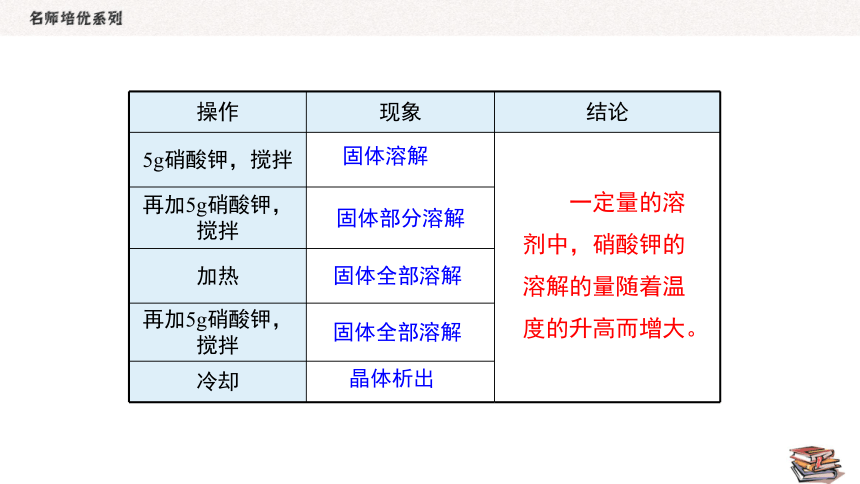
操作 现象 结论
5g硝酸钾,搅拌
再加5g硝酸钾,搅拌 加热 再加5g硝酸钾,搅拌 冷却 固体溶解
固体全部溶解
固体全部溶解
晶体析出
一定量的溶剂中,硝酸钾的溶解的量随着温度的升高而增大。
固体部分溶解
1.饱和溶液与不饱和溶液
(1)饱和溶液: 在一定的温度下,在一定量的溶剂里,不能再溶解某种物质的溶液叫做这种溶质的饱和溶液。
(2 )不饱和溶液: 在一定的温度下,在一定量的溶剂里,还能继续溶解某种物质的溶液叫做这种溶质的不饱和溶液。
一、饱和溶液
只有指明“一定温度”和“一定量溶剂”,“饱和”和“不饱和”才有意义。
讲授新课
饱和溶液是指在一定温度下、一定量的溶剂里,不能继续溶解这种溶质的溶液,但还能溶解其他溶质。因此,表述某溶质的饱和溶液要指明溶质。
如氯化钠饱和溶液、硝酸钾饱和溶液。
如何验证某硝酸钾溶液已经达到饱和?
加入少量
高锰酸钾
取少量冷却后的饱和硝酸钾溶液与小试管中,加入少量高锰酸钾固体,观察高锰酸钾能否溶解?
思考1:20℃时,往盛有饱和食盐水的烧杯中加入5g食盐,加入食盐后的溶液中,质量不变的是( )
A.溶剂的质量 B.溶质的质量
C.溶液的质量 D.溶剂、溶质、溶液的质量
饱和溶液
不包括未溶解的固体!
D
思考2:有一瓶接近饱和的硝酸钾溶液,欲使其成为饱和溶液,可采用的方法有哪些?
加入溶质、蒸发溶剂、改变温度
加入硝酸钾、蒸发掉一些水、降低温度
思考3:将硝酸钾的饱和溶液配成不饱和溶解,可采用的方法有哪些?
增加溶剂、升高温度
饱和溶液 不饱和溶液
加溶剂、改变温度
加入溶质、蒸发溶剂、改变温度
2.饱和溶液和不饱和溶液之间的转化
结晶
蒸发
溶剂
冷却
注:以上为通常情况,不适合所有的物质。
3.晶体的获得
(1)蒸发溶剂
(适用于溶解能力受温度影响较小的物质)
(2)降温结晶
(适用于溶解能力随温度的下降明显下降的物质)
硫酸铜晶体
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工原料
从海水中提取食盐
蒸发溶剂
硝酸钾晶体
雪花晶体
冷却热饱和溶液
【晶体】具有规则几何外形的固体即为晶体。
【结晶】溶解在溶液里的溶质以晶体的形式析出,叫做结晶。
4.饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系
浓度大
浓度小
食盐溶解
食盐的不饱和溶液
10毫升水
10毫升水
熟石灰不完全溶解
熟石灰的饱和溶液
0.2克熟石灰
2克食盐
①对于不同溶质来说,浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液。
②对于同种溶质来说:在一定温度时饱和溶液比不饱和溶液要浓。
饱和溶液
不饱和溶液
浓溶液
稀溶液
溶液在一定条件下可分为饱和溶液和不饱和溶液
不给定条件可分为浓溶液和稀溶液。
1.饱和溶液和不饱和溶液含义
2.饱和溶液和不饱和溶液的相互转化
3.结晶
(1)蒸发溶剂结晶。
(2)冷却热饱和溶液结晶。
①加水②升温
饱和溶液 不饱和溶液
①加溶质②降温③蒸发溶剂
课堂小结
空白演示
单击输入您的封面副标题
九年级化学下册(RJ)
教学课件
第九单元 溶液
课题2 溶解度
第1课时 饱和溶液和不饱和溶液
我国北方有许多盐碱湖,湖水中溶有大量的食盐(NaCl)和纯碱(Na2CO3),那里的农民冬天捞碱,夏天晒盐,你知道为什么吗?
导入新课
1.知道什么是饱和溶液和不饱和溶液,知道两者之间如何转化;
2.知道饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系;
3.知道结晶的方法。
学习目标
20mL水 加5gNaCl 搅拌 再加5gNaCl 再加10mL水
注意:玻璃棒搅拌尽量不要碰到烧杯内壁和烧杯底部。以不发出声音为准!
【实验9-5】探究在室温下,溶质溶解质量随溶剂质量变化情况。
20mL水 加5gNaCl 搅拌 再加5gNaCl 再加10mL水
操作 5g氯化钠,搅拌 再加5g氯化钠,搅拌 加10mL水,搅拌
现象
结论 固体全部溶解
部分固体不溶解
固体全部溶解
1.可溶物在一定量的水中不能无限溶解;
2.溶质溶解的质量随着溶剂质量的增大而增大。
再加10mL水氯化钠溶解说明了什么?
【实验9-5】探究在室温下,溶质溶解质量随溶剂质量变化情况。
20mL水 加5gKNO3 搅拌溶解 再加5g 加热 又再加5g
【实验9-6】探究溶质在定量溶剂中溶解质量随温度变化情况。
冷却
测温度:T1:20mL水
T2 :加热完全溶解时温度
T3:冷却析出晶体后的温度
操作 现象 结论
5g硝酸钾,搅拌
再加5g硝酸钾,搅拌 加热 再加5g硝酸钾,搅拌 冷却 固体溶解
固体全部溶解
固体全部溶解
晶体析出
一定量的溶剂中,硝酸钾的溶解的量随着温度的升高而增大。
固体部分溶解
1.饱和溶液与不饱和溶液
(1)饱和溶液: 在一定的温度下,在一定量的溶剂里,不能再溶解某种物质的溶液叫做这种溶质的饱和溶液。
(2 )不饱和溶液: 在一定的温度下,在一定量的溶剂里,还能继续溶解某种物质的溶液叫做这种溶质的不饱和溶液。
一、饱和溶液
只有指明“一定温度”和“一定量溶剂”,“饱和”和“不饱和”才有意义。
讲授新课
饱和溶液是指在一定温度下、一定量的溶剂里,不能继续溶解这种溶质的溶液,但还能溶解其他溶质。因此,表述某溶质的饱和溶液要指明溶质。
如氯化钠饱和溶液、硝酸钾饱和溶液。
如何验证某硝酸钾溶液已经达到饱和?
加入少量
高锰酸钾
取少量冷却后的饱和硝酸钾溶液与小试管中,加入少量高锰酸钾固体,观察高锰酸钾能否溶解?
思考1:20℃时,往盛有饱和食盐水的烧杯中加入5g食盐,加入食盐后的溶液中,质量不变的是( )
A.溶剂的质量 B.溶质的质量
C.溶液的质量 D.溶剂、溶质、溶液的质量
饱和溶液
不包括未溶解的固体!
D
思考2:有一瓶接近饱和的硝酸钾溶液,欲使其成为饱和溶液,可采用的方法有哪些?
加入溶质、蒸发溶剂、改变温度
加入硝酸钾、蒸发掉一些水、降低温度
思考3:将硝酸钾的饱和溶液配成不饱和溶解,可采用的方法有哪些?
增加溶剂、升高温度
饱和溶液 不饱和溶液
加溶剂、改变温度
加入溶质、蒸发溶剂、改变温度
2.饱和溶液和不饱和溶液之间的转化
结晶
蒸发
溶剂
冷却
注:以上为通常情况,不适合所有的物质。
3.晶体的获得
(1)蒸发溶剂
(适用于溶解能力受温度影响较小的物质)
(2)降温结晶
(适用于溶解能力随温度的下降明显下降的物质)
硫酸铜晶体
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工原料
从海水中提取食盐
蒸发溶剂
硝酸钾晶体
雪花晶体
冷却热饱和溶液
【晶体】具有规则几何外形的固体即为晶体。
【结晶】溶解在溶液里的溶质以晶体的形式析出,叫做结晶。
4.饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系
浓度大
浓度小
食盐溶解
食盐的不饱和溶液
10毫升水
10毫升水
熟石灰不完全溶解
熟石灰的饱和溶液
0.2克熟石灰
2克食盐
①对于不同溶质来说,浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液。
②对于同种溶质来说:在一定温度时饱和溶液比不饱和溶液要浓。
饱和溶液
不饱和溶液
浓溶液
稀溶液
溶液在一定条件下可分为饱和溶液和不饱和溶液
不给定条件可分为浓溶液和稀溶液。
1.饱和溶液和不饱和溶液含义
2.饱和溶液和不饱和溶液的相互转化
3.结晶
(1)蒸发溶剂结晶。
(2)冷却热饱和溶液结晶。
①加水②升温
饱和溶液 不饱和溶液
①加溶质②降温③蒸发溶剂
课堂小结
同课章节目录
