原电池
图片预览





文档简介
(共43张PPT)
第一节 原 电 池
(第一课时)
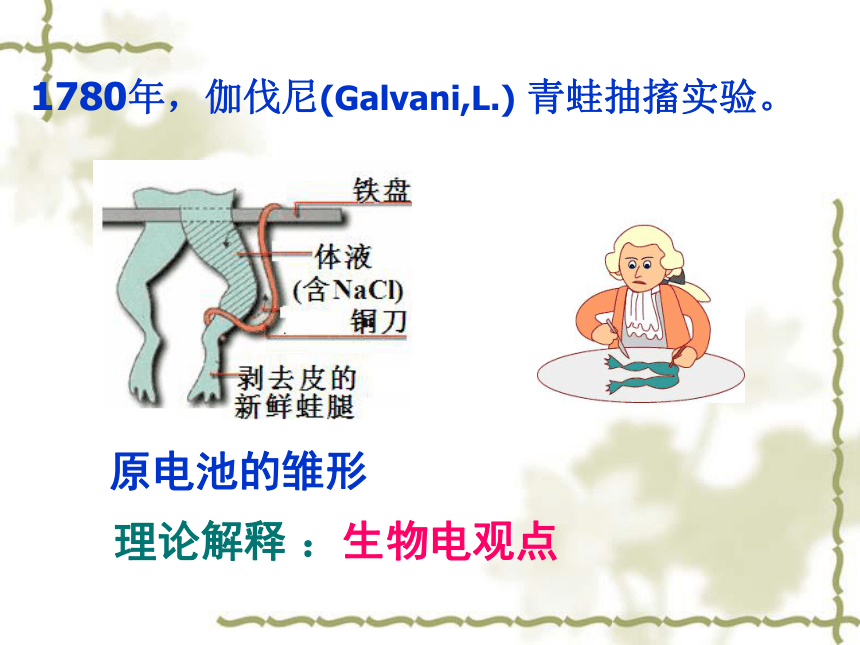
1780年,伽伐尼(Galvani,L.) 青蛙抽搐实验。
原电池的雏形
理论解释 :生物电观点
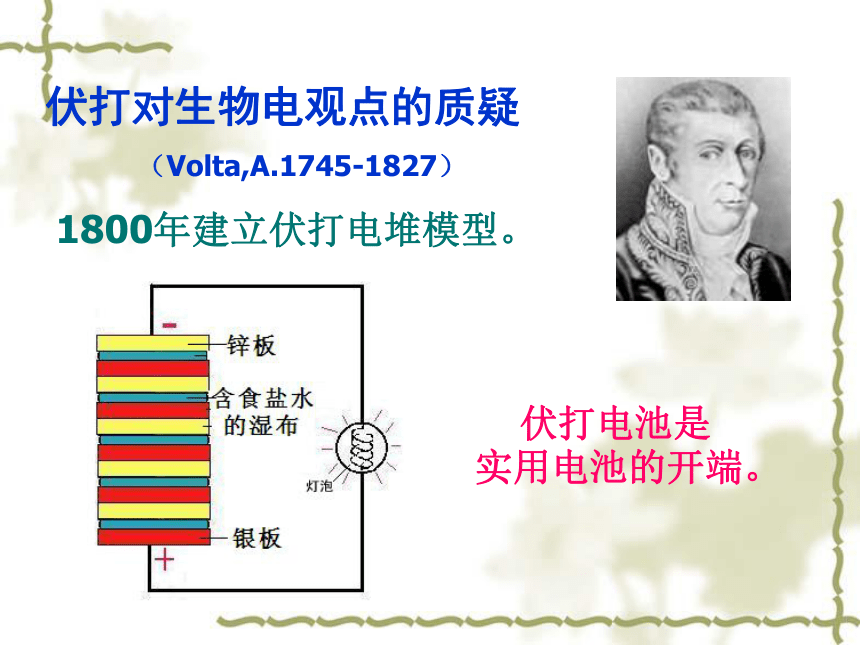
伏打对生物电观点的质疑
(Volta,A.1745-1827)
1800年建立伏打电堆模型。
伏打电池是
实用电池的开端。
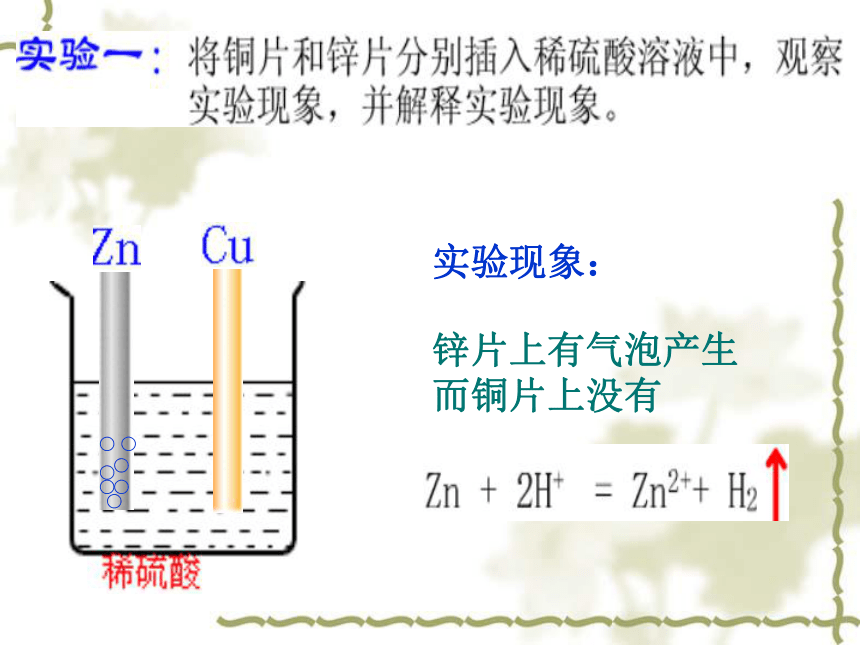
实验现象:
锌片上有气泡产生
而铜片上没有
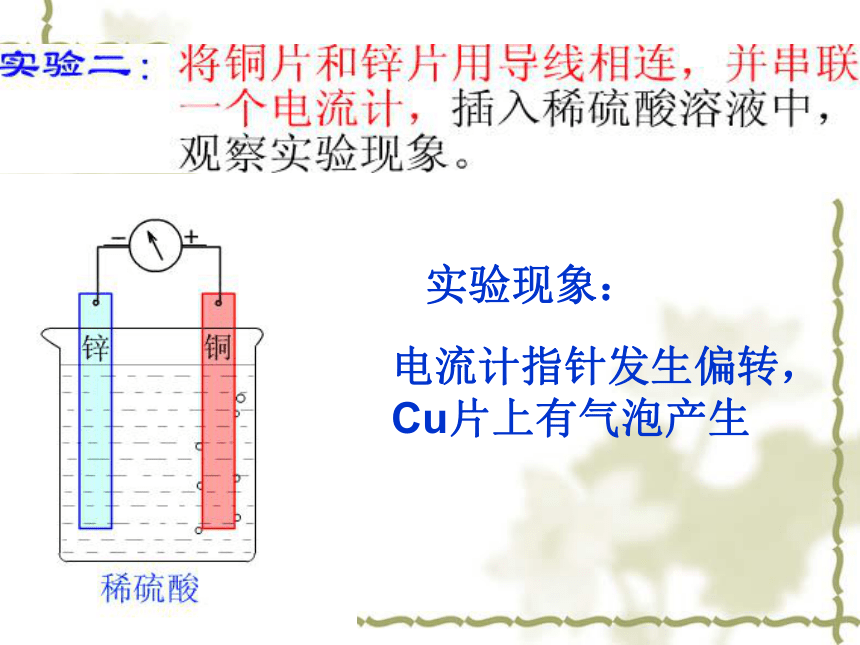
实验现象:
电流计指针发生偏转,
Cu片上有气泡产生
复习回顾
一、原电池是______________________的装置。
原电池反应的本质是_______________反应。
将化学能转化为电能
氧化还原反应
2、如右图所示,组成的原电池:
(1)当电解质溶液为稀H2SO4时:
Zn电极是____(填“正”或“负”)极,
其电极反应为_______________,该反应
是______(填“氧化”或“还原”,下同)反应;
Cu电极是______极,其电极反应为
_______________,该反应是_________反应。
(2)当电解质溶液为CuSO4溶液时: Zn电极
是____极,其电极反应为_____________,
该反应是________反应;Cu电极是____极,
其电极反应为_______________,该反应_________反应.
负
Zn -2e - = Zn 2+
氧化
正
2H+ +2e- =H2↑
还原
负
Zn -2e - = Zn 2+
氧化
正
Cu2+ + 2e - = Cu
还原
氧化反应
Zn-2e=Zn2+
铜锌原电池
电解质溶液
盐桥
失e,沿导线传递,有电流产生
还原反应
2H++2e- =H2↑
阴离子
阳离子
总反应:
负极
正极
2H++2e- =H2↑
Zn-2e- =Zn2+
Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2↑
(离子方程式)
(化学方程式)
电极反应
正极:
负极:
(氧化反应)
(还原反应)
阳离子
二、原 电 池 原 理
外电路
内电路
三、原 电 池 相关的概念
1.电路:
外电路
内电路
电子流向:负极流向正极
电流方向:正极流向负极
阴离子流向负极
阳离子流向正极
2.电极:
正极:电子流入的一极
负极:电子流出的一极
3.电极反应式:
正极: 2H++ 2e-= H2↑
负极: Zn-2e-= Zn2+
4.总反应式:
Zn+ 2H+ = Zn2+ + H2↑
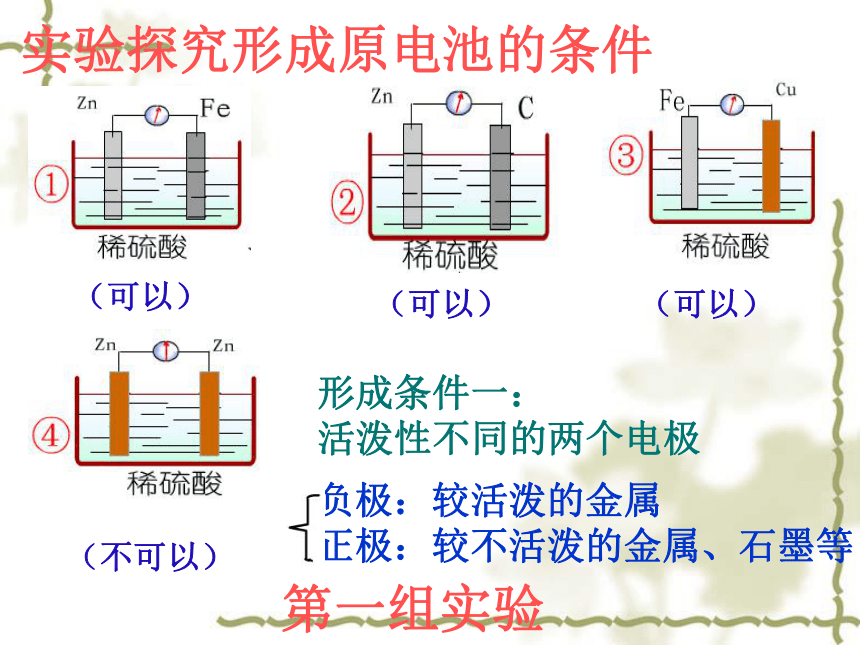
实验探究形成原电池的条件
(可以)
(可以)
(可以)
(不可以)
形成条件一:
活泼性不同的两个电极
负极:较活泼的金属
正极:较不活泼的金属、石墨等
第一组实验
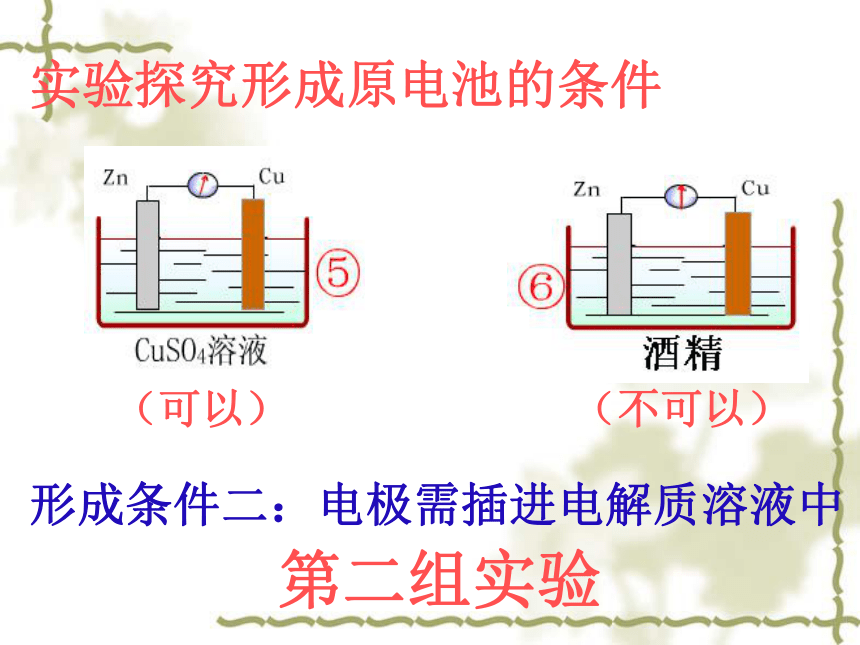
(可以)
(不可以)
形成条件二:电极需插进电解质溶液中
第二组实验
实验探究形成原电池的条件
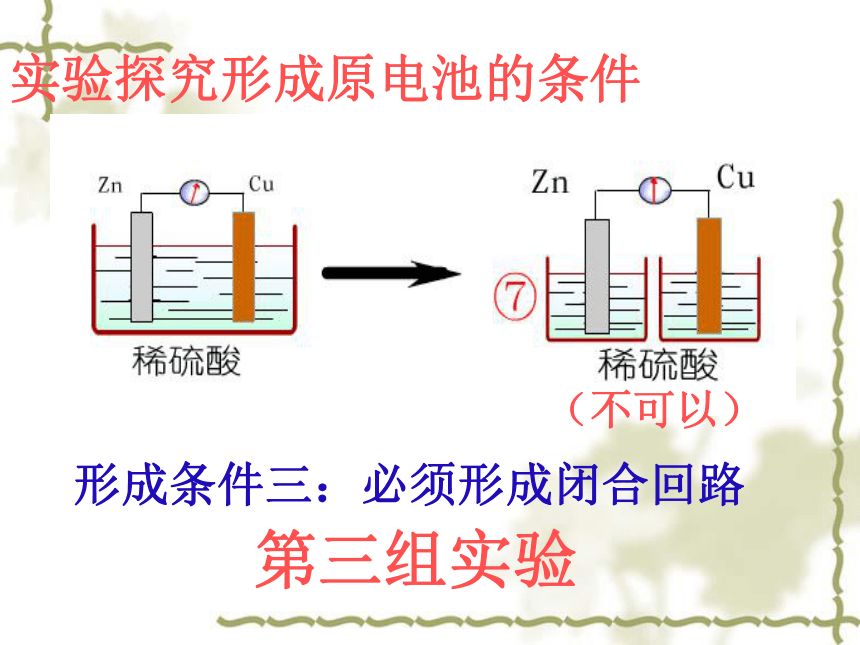
第三组实验
实验探究形成原电池的条件
形成条件三:必须形成闭合回路
(不可以)
(1)有两种活动性不同的金属(或一种是非金属单质或金属氧化物)作电极。
(2)电极材料均插入电解质溶液中。
(3)两极相连形成闭合电路。
(4)内部条件:能自发进行氧化还原反应。
四、组成原电池的条件
A
B
C
D
E
F
M
N
1.下列哪几个装置能形成原电池?
O
V
X
V
V
X
X
X
X
V
典型例题:
2.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )
C
A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
典型例题:
对锌铜原电 池工作原理的进一步探究
上图是我们在必修2中学习过的将锌片和铜片置于稀硫酸的原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?有没有什么改进措施?
造成的主要原因:由于在铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通。这种作用称为极化作用。
为了避免发生这种现象,设计如下图(书P76图4-1)所示的原电池装置,你能解释它的工作原理吗?
实验三(书76页实验4-1)
实验探索
实验现象:
分析:改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?
有盐桥存在时电流计指针发生偏转,即有电流通过电路。取出盐桥,电流计指针即回到零点,说明没有电流通过。
阅读课本P77
小知识
盐桥制法:
1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。
2)将KCl或NH4NO3的饱和溶液装入U形管,用棉花都住管口即可。
盐桥的作用:
(1)使整个装置构成通路,代替两溶液直接接触。
(2)平衡电荷。
得出结论
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到锌片全部溶解或 CuSO4溶液中的 Cu2+几乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀,可用NH4NO3代替KCl作盐桥。
盐桥的作用:
(1)使整个装置构成通路,代替两溶液直接接触。
得出结论
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到锌片全部溶解或 CuSO4溶液中的 Cu2+几乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀,可用NH4NO3代替KCl作盐桥。
(2)平衡电荷。
在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完成的。Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+ 变为Cu ,使得 SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻止电子从锌片流向铜片,造成电流中断。
请同学们思考:
上述原电池装置是将什么反应的化学能转换成电能的?指出电池的正负极,并分别写出其中负极和正极的电极反应式以及该电池的总反应方程式。
负极(锌片): Zn -2e - = Zn 2+ (氧化反应)
正极(铜片): Cu2+ + 2e - = Cu (还原反应)
电池反应(总化学方程式):Zn + Cu2+ = Zn 2+ + Cu
电池符号: Zn ︱ ZnSO4‖ CuSO4 ︱ Cu
负极 盐桥 正极
五、由两个半电池组成原电池的工作原理
把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。
①在这类电池中,用还原性较强的物质作为负极,负极向外电路提供电子;用氧化性较强的物质作为正极,正极从外电路得到电子。
②在原电池的内部,两极浸在电解质溶液中,并通过阴阳离子的定向运动而形成内电路。
新课标人教版选修四化学反应原理
第四章 电化学基础
第一节 原 电 池
(第二课时)
复习回忆
一、原 电 池 原 理:
1、正负极、各发生什么反应:
2、电子流方向:
3、离子流向:
4、原电池反应的本质:
(1)有两种活动性不同的金属(或一种是非金属单质或金属氧化物)作电极。
(2)电极材料均插入电解质溶液中。
(3)两极相连形成闭合电路。
(4)内部条件:能自发进行氧化还原反应。
二、组成原电池的条件
三、什么是盐桥?有何作用?
盐桥的作用:
(1)形成闭合回路。
(2)平衡电荷。
双液原电池的工作原理
1、构造特点:
由两个半电池组成,每个半电池中的电极与电解质溶液互不反应,电池反应的还原剂与氧化剂分别位于两个半电池中,中间通过盐桥连接形成闭合回路。
2、电极反应:
负极(Zn):Zn-2e-=Zn2+
(氧化反应)
正极(Cu):Cu2++2e-=Cu
(还原反应)
电池反应:
Zn+Cu2+=Zn2++Cu
3、电子、电流的流向
外电路:
电子由负极(Zn片)流向正极(Cu片);
电流由正极(Cu片)流向负极(Zn片);
内电路:
阳离子移向正极(Cu片)
阴离子移向负极(Zn片)
4、盐桥的作用
通过阴、阳离子的定向移动,在内电路形成
电流回路而不中断电流。
5、意义:
随开随用,并能长时间产生持续、稳定的电流。
利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设计一个单液原电池,一个双液原电池(使用盐桥),画出原电池的示意图,并写出电极反应。
参考答案
(+)
(-)
G
Zn
Pt
FeCl3
溶液
负极(Zn):Zn-2e-=Zn2+(氧化反应)
正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
(+)
(-)
盐桥
Zn
C
ZnCl2溶液
FeCl3溶液
G
练习
锌铜原电池产生电流时,阳离子( )
A 移向Zn 极,阴离子移向Cu 极
B 移向Cu 极,阴离子移向Zn 极
C 和阴离子都移向Zn极
D 和阴离子都移向Cu 极
B
1.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B
2.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 pH( )
A.不变 B先变大后变小
C逐渐变大 D.逐渐变小
C
典型例题:
3.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为 ( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
4、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是
( D )
A. 铁圈和银圈左右摇摆不定
B. 保持平衡状态
C. 铁圈向下倾斜,银圈向上倾斜
D. 银圈向下倾斜,铁圈向上倾斜
请根据氧化还原反应 :
Cu +2 Fe3+ = Cu2+ + 2Fe2+
设计成原电池。你有哪些可行方案
Cu Cu – 2e- = Cu2+
比Cu不活泼的金属或石墨
2Fe3+ + 2e- = 2Fe2+
Fe2(SO4 )3、FeCl3等
负极:
正极:
电解质溶液:
练一练
若是采用烧杯和盐桥装置图,采用的电解质溶液又是什么?试画出原电池的装置简图。
(1)比较金属活动性强弱。
例1:
下列叙述中,可以说明金属甲比乙活泼性强的是
C.将甲乙作电极组成原电池时甲是负极;
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲 上有H2气放出;
B.在氧化–还原反应中,甲比乙失去的电子多;
D.同价态的阳离子,甲比乙的氧化性强;
(C)
六、原电池原理应用:
(2)比较反应速率
例2 :
下列制氢气的反应速率最快的是
粗锌和 1mol/L 盐酸;
B.
A.
纯锌和1mol/L 硫酸;
纯锌和18 mol/L 硫酸;
C.
粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液。
D.
( D )
(3)比较金属腐蚀的快慢
例3:
下列各情况,在其中Fe片腐蚀由快到慢的
顺序是
(2)
(1)
(3)
例4:
下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是
(4)
(2)
(1)
(3)
(4)判断溶液pH值变化
例5:
在Cu-Zn原电池中,200mLH2SO4 溶液的浓度为0.125mol/L , 若工作一段时间后,从装置中共收集到 0.168L升气体,则流过导线的电子为———— mol,溶液的pH值变_________?(溶液体积变化忽略不计)
大
0.015
(5)原电池原理的综合应用
例6:市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。 “热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。
“热敷袋”是利用 放出热量。
2)炭粉的主要作用是 。
3)加入氯化钠的主要作用是 。
4)木屑的作用是 。
铁被氧化
与铁屑、氯化钠溶液构成原电池,加速铁屑的氧化
氯化钠溶于水、形成电解质溶液
使用“热敷袋”时受热均匀
(1)若烧杯中溶液为稀硫酸,则观察
到的现象。
两极反应式为:正极 ;
负极 。
该装置将 能转化为 能。
(2)若烧杯中溶液为氢氧化钠溶液,
则负极为 ,
总反应方程为 。
镁逐渐溶解,铝极上有气泡冒出,
电流表指针发生偏转;
Al
Mg-2e—=Mg2+
化学能
电能
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2H++2e—=H2↑
小 结
1定义:
(1)由两个半电池组成的锌铜原电池的工作原理
原电池
把化学能转化成电能的装置。
2、原电池的工作原理
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。
负极 正极
电子流向
电流流向
(2)形成原电池的条件
(3)原电池的正负极的判断方法
(4)电极材料的选择(电池的电极必须导电)
第一节 原 电 池
(第一课时)
1780年,伽伐尼(Galvani,L.) 青蛙抽搐实验。
原电池的雏形
理论解释 :生物电观点
伏打对生物电观点的质疑
(Volta,A.1745-1827)
1800年建立伏打电堆模型。
伏打电池是
实用电池的开端。
实验现象:
锌片上有气泡产生
而铜片上没有
实验现象:
电流计指针发生偏转,
Cu片上有气泡产生
复习回顾
一、原电池是______________________的装置。
原电池反应的本质是_______________反应。
将化学能转化为电能
氧化还原反应
2、如右图所示,组成的原电池:
(1)当电解质溶液为稀H2SO4时:
Zn电极是____(填“正”或“负”)极,
其电极反应为_______________,该反应
是______(填“氧化”或“还原”,下同)反应;
Cu电极是______极,其电极反应为
_______________,该反应是_________反应。
(2)当电解质溶液为CuSO4溶液时: Zn电极
是____极,其电极反应为_____________,
该反应是________反应;Cu电极是____极,
其电极反应为_______________,该反应_________反应.
负
Zn -2e - = Zn 2+
氧化
正
2H+ +2e- =H2↑
还原
负
Zn -2e - = Zn 2+
氧化
正
Cu2+ + 2e - = Cu
还原
氧化反应
Zn-2e=Zn2+
铜锌原电池
电解质溶液
盐桥
失e,沿导线传递,有电流产生
还原反应
2H++2e- =H2↑
阴离子
阳离子
总反应:
负极
正极
2H++2e- =H2↑
Zn-2e- =Zn2+
Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2↑
(离子方程式)
(化学方程式)
电极反应
正极:
负极:
(氧化反应)
(还原反应)
阳离子
二、原 电 池 原 理
外电路
内电路
三、原 电 池 相关的概念
1.电路:
外电路
内电路
电子流向:负极流向正极
电流方向:正极流向负极
阴离子流向负极
阳离子流向正极
2.电极:
正极:电子流入的一极
负极:电子流出的一极
3.电极反应式:
正极: 2H++ 2e-= H2↑
负极: Zn-2e-= Zn2+
4.总反应式:
Zn+ 2H+ = Zn2+ + H2↑
实验探究形成原电池的条件
(可以)
(可以)
(可以)
(不可以)
形成条件一:
活泼性不同的两个电极
负极:较活泼的金属
正极:较不活泼的金属、石墨等
第一组实验
(可以)
(不可以)
形成条件二:电极需插进电解质溶液中
第二组实验
实验探究形成原电池的条件
第三组实验
实验探究形成原电池的条件
形成条件三:必须形成闭合回路
(不可以)
(1)有两种活动性不同的金属(或一种是非金属单质或金属氧化物)作电极。
(2)电极材料均插入电解质溶液中。
(3)两极相连形成闭合电路。
(4)内部条件:能自发进行氧化还原反应。
四、组成原电池的条件
A
B
C
D
E
F
M
N
1.下列哪几个装置能形成原电池?
O
V
X
V
V
X
X
X
X
V
典型例题:
2.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )
C
A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
典型例题:
对锌铜原电 池工作原理的进一步探究
上图是我们在必修2中学习过的将锌片和铜片置于稀硫酸的原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?有没有什么改进措施?
造成的主要原因:由于在铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通。这种作用称为极化作用。
为了避免发生这种现象,设计如下图(书P76图4-1)所示的原电池装置,你能解释它的工作原理吗?
实验三(书76页实验4-1)
实验探索
实验现象:
分析:改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?
有盐桥存在时电流计指针发生偏转,即有电流通过电路。取出盐桥,电流计指针即回到零点,说明没有电流通过。
阅读课本P77
小知识
盐桥制法:
1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。
2)将KCl或NH4NO3的饱和溶液装入U形管,用棉花都住管口即可。
盐桥的作用:
(1)使整个装置构成通路,代替两溶液直接接触。
(2)平衡电荷。
得出结论
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到锌片全部溶解或 CuSO4溶液中的 Cu2+几乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀,可用NH4NO3代替KCl作盐桥。
盐桥的作用:
(1)使整个装置构成通路,代替两溶液直接接触。
得出结论
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到锌片全部溶解或 CuSO4溶液中的 Cu2+几乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀,可用NH4NO3代替KCl作盐桥。
(2)平衡电荷。
在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完成的。Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+ 变为Cu ,使得 SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻止电子从锌片流向铜片,造成电流中断。
请同学们思考:
上述原电池装置是将什么反应的化学能转换成电能的?指出电池的正负极,并分别写出其中负极和正极的电极反应式以及该电池的总反应方程式。
负极(锌片): Zn -2e - = Zn 2+ (氧化反应)
正极(铜片): Cu2+ + 2e - = Cu (还原反应)
电池反应(总化学方程式):Zn + Cu2+ = Zn 2+ + Cu
电池符号: Zn ︱ ZnSO4‖ CuSO4 ︱ Cu
负极 盐桥 正极
五、由两个半电池组成原电池的工作原理
把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。
①在这类电池中,用还原性较强的物质作为负极,负极向外电路提供电子;用氧化性较强的物质作为正极,正极从外电路得到电子。
②在原电池的内部,两极浸在电解质溶液中,并通过阴阳离子的定向运动而形成内电路。
新课标人教版选修四化学反应原理
第四章 电化学基础
第一节 原 电 池
(第二课时)
复习回忆
一、原 电 池 原 理:
1、正负极、各发生什么反应:
2、电子流方向:
3、离子流向:
4、原电池反应的本质:
(1)有两种活动性不同的金属(或一种是非金属单质或金属氧化物)作电极。
(2)电极材料均插入电解质溶液中。
(3)两极相连形成闭合电路。
(4)内部条件:能自发进行氧化还原反应。
二、组成原电池的条件
三、什么是盐桥?有何作用?
盐桥的作用:
(1)形成闭合回路。
(2)平衡电荷。
双液原电池的工作原理
1、构造特点:
由两个半电池组成,每个半电池中的电极与电解质溶液互不反应,电池反应的还原剂与氧化剂分别位于两个半电池中,中间通过盐桥连接形成闭合回路。
2、电极反应:
负极(Zn):Zn-2e-=Zn2+
(氧化反应)
正极(Cu):Cu2++2e-=Cu
(还原反应)
电池反应:
Zn+Cu2+=Zn2++Cu
3、电子、电流的流向
外电路:
电子由负极(Zn片)流向正极(Cu片);
电流由正极(Cu片)流向负极(Zn片);
内电路:
阳离子移向正极(Cu片)
阴离子移向负极(Zn片)
4、盐桥的作用
通过阴、阳离子的定向移动,在内电路形成
电流回路而不中断电流。
5、意义:
随开随用,并能长时间产生持续、稳定的电流。
利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设计一个单液原电池,一个双液原电池(使用盐桥),画出原电池的示意图,并写出电极反应。
参考答案
(+)
(-)
G
Zn
Pt
FeCl3
溶液
负极(Zn):Zn-2e-=Zn2+(氧化反应)
正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
(+)
(-)
盐桥
Zn
C
ZnCl2溶液
FeCl3溶液
G
练习
锌铜原电池产生电流时,阳离子( )
A 移向Zn 极,阴离子移向Cu 极
B 移向Cu 极,阴离子移向Zn 极
C 和阴离子都移向Zn极
D 和阴离子都移向Cu 极
B
1.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B
2.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 pH( )
A.不变 B先变大后变小
C逐渐变大 D.逐渐变小
C
典型例题:
3.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为 ( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
4、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是
( D )
A. 铁圈和银圈左右摇摆不定
B. 保持平衡状态
C. 铁圈向下倾斜,银圈向上倾斜
D. 银圈向下倾斜,铁圈向上倾斜
请根据氧化还原反应 :
Cu +2 Fe3+ = Cu2+ + 2Fe2+
设计成原电池。你有哪些可行方案
Cu Cu – 2e- = Cu2+
比Cu不活泼的金属或石墨
2Fe3+ + 2e- = 2Fe2+
Fe2(SO4 )3、FeCl3等
负极:
正极:
电解质溶液:
练一练
若是采用烧杯和盐桥装置图,采用的电解质溶液又是什么?试画出原电池的装置简图。
(1)比较金属活动性强弱。
例1:
下列叙述中,可以说明金属甲比乙活泼性强的是
C.将甲乙作电极组成原电池时甲是负极;
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲 上有H2气放出;
B.在氧化–还原反应中,甲比乙失去的电子多;
D.同价态的阳离子,甲比乙的氧化性强;
(C)
六、原电池原理应用:
(2)比较反应速率
例2 :
下列制氢气的反应速率最快的是
粗锌和 1mol/L 盐酸;
B.
A.
纯锌和1mol/L 硫酸;
纯锌和18 mol/L 硫酸;
C.
粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液。
D.
( D )
(3)比较金属腐蚀的快慢
例3:
下列各情况,在其中Fe片腐蚀由快到慢的
顺序是
(2)
(1)
(3)
例4:
下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是
(4)
(2)
(1)
(3)
(4)判断溶液pH值变化
例5:
在Cu-Zn原电池中,200mLH2SO4 溶液的浓度为0.125mol/L , 若工作一段时间后,从装置中共收集到 0.168L升气体,则流过导线的电子为———— mol,溶液的pH值变_________?(溶液体积变化忽略不计)
大
0.015
(5)原电池原理的综合应用
例6:市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。 “热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。
“热敷袋”是利用 放出热量。
2)炭粉的主要作用是 。
3)加入氯化钠的主要作用是 。
4)木屑的作用是 。
铁被氧化
与铁屑、氯化钠溶液构成原电池,加速铁屑的氧化
氯化钠溶于水、形成电解质溶液
使用“热敷袋”时受热均匀
(1)若烧杯中溶液为稀硫酸,则观察
到的现象。
两极反应式为:正极 ;
负极 。
该装置将 能转化为 能。
(2)若烧杯中溶液为氢氧化钠溶液,
则负极为 ,
总反应方程为 。
镁逐渐溶解,铝极上有气泡冒出,
电流表指针发生偏转;
Al
Mg-2e—=Mg2+
化学能
电能
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2H++2e—=H2↑
小 结
1定义:
(1)由两个半电池组成的锌铜原电池的工作原理
原电池
把化学能转化成电能的装置。
2、原电池的工作原理
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。
负极 正极
电子流向
电流流向
(2)形成原电池的条件
(3)原电池的正负极的判断方法
(4)电极材料的选择(电池的电极必须导电)
