2021-2022学年高一上学期人教版(2019)化学必修第一册第四章《物质结构元素周期律》测试题(word版含答案)
文档属性
| 名称 | 2021-2022学年高一上学期人教版(2019)化学必修第一册第四章《物质结构元素周期律》测试题(word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 275.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-19 21:30:59 | ||
图片预览



文档简介
第四章《物质结构元素周期律》测试题
一、单选题(共12题)
1.为纪念元素周期表诞生150周年,联合国宣布2019年为“元素周期表年”。硅是第14号元素,如图是硅元素在元素周期表中的相关信息,下列说法正确的是
A.硅元素属于金属元素 B.硅元素的相对原子质量为28.09g
C.SiO2中硅元素的化合价为+4 D.硅元素是地壳中含量最高的元素
2.以下发明或发现属于中国在化学方面对世界有重大贡献的是
①造纸 ②印刷技术 ③黑火药 ④指南针 ⑤炼铜、炼铁、炼钢 ⑥合成有机高分子材料 ⑦人工合成牛胰岛素 ⑧提出原子—分子论学说
A.①②③④⑧ B.①③⑤⑦ C.②④⑥ D.⑤⑥⑦⑧
3.有A、B两种原子,A原子的第三电子层比B原子的第三电子层少3个电子,B原子的第二电子层电子数恰好为A原子第二电子层电子数的2倍.A和B分别是
A.硅原子和钠原子 B.硼原子和氦原子 C.氯原子和碳原子 D.碳原子和铝原子
4.下列说法正确的是
A.某元素从单质转变为化合物,该元素一定被氧化
B.金属氧化物一定是碱性氧化物
C.复分解反应不一定是氧化还原反应
D.由离子构成的化合物在熔融状态下一定能导电
5.下列有关锂和钠元素的说法正确的是
A.二者原子半径大小:Li>Na
B.二者单质加热条件下都能与氧气反应生成过氧化物
C.二者单质与水反应时都浮在水面上,并且钠比锂反应剧烈
D.氢氧化物碱性:LiOH>NaOH
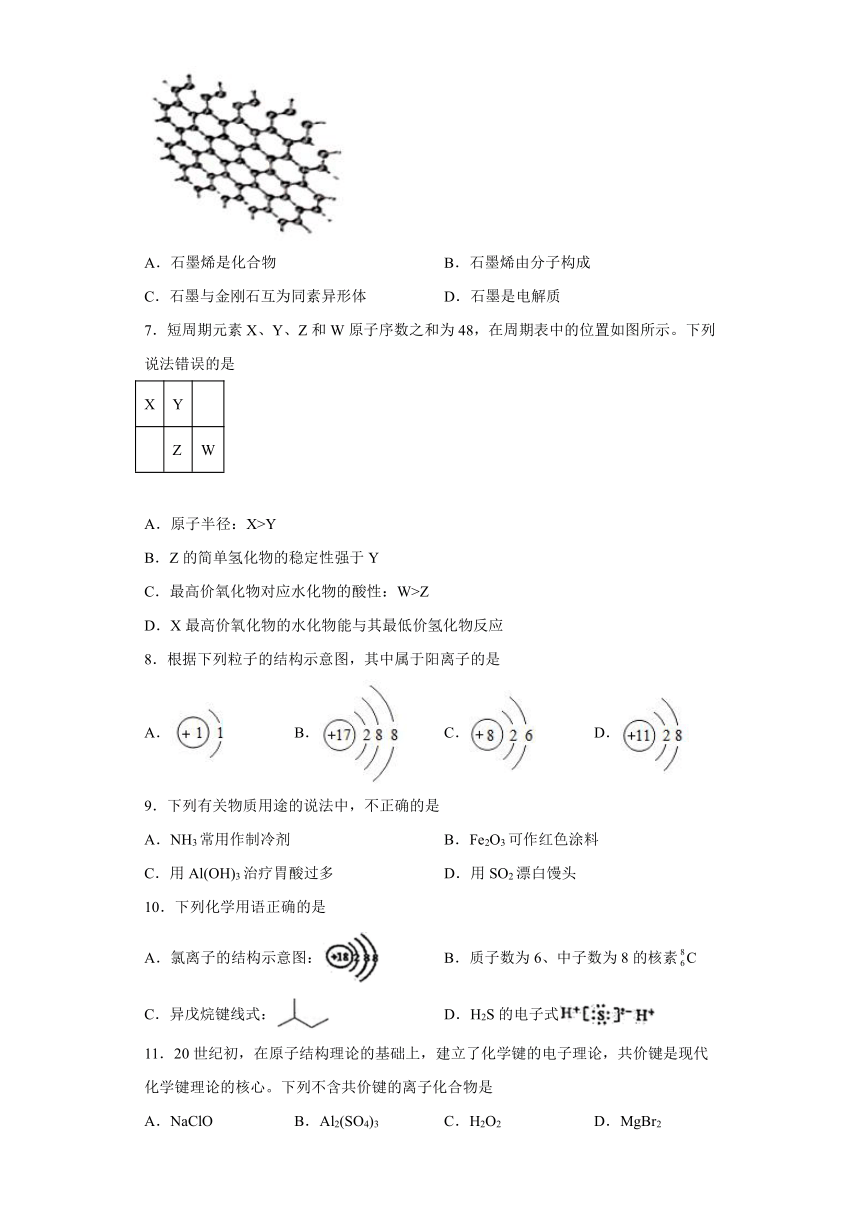
6.石墨烯是用微机械剥离法从石墨中分离出的单层石墨,被认为是一种未来革命性的材料。下列说法正确的是
A.石墨烯是化合物 B.石墨烯由分子构成
C.石墨与金刚石互为同素异形体 D.石墨是电解质
7.短周期元素X、Y、Z和W原子序数之和为48,在周期表中的位置如图所示。下列说法错误的是
X Y
Z W
A.原子半径:X>Y
B.Z的简单氢化物的稳定性强于Y
C.最高价氧化物对应水化物的酸性:W>Z
D.X最高价氧化物的水化物能与其最低价氢化物反应
8.根据下列粒子的结构示意图,其中属于阳离子的是
A. B. C. D.
9.下列有关物质用途的说法中,不正确的是
A.NH3常用作制冷剂 B.Fe2O3可作红色涂料
C.用Al(OH)3治疗胃酸过多 D.用SO2漂白馒头
10.下列化学用语正确的是
A.氯离子的结构示意图: B.质子数为6、中子数为8的核素C
C.异戊烷键线式: D.H2S的电子式
11.20世纪初,在原子结构理论的基础上,建立了化学键的电子理论,共价键是现代化学键理论的核心。下列不含共价键的离子化合物是
A.NaClO B.Al2(SO4)3 C.H2O2 D.MgBr2
12.为原子序数依次增大的短周期元素,其中原子的质子数是其层电子数的三倍,与与相邻,与同主族。下列说法正确的是
A.原子半径:
B.最高价氧化物对应水化物的酸性:
C.最简单气态氢化物的热稳定性:
D.元素的最高化合价分别与其主族序数相等
二、非选择题(共10题)
13.X、Y、Z、R、W是原子序数依次增大的短周期主族元素,其中两种为金属元素。X的某同素异形体是天然存在的最硬物质;Y与W同主族,Y的最外层电子数是其周期数的三倍;将Z单质投入水中,浮在水面并剧烈反应;R的简单离子半径在同周期中最小。
(1)W在元素周期表中的位置是___________;Z的离子结构示意图为___________。
(2)H2Y2的电子式为___________;将W的氢化物通入H2Y2溶液中,溶液变浑浊,发生反应的化学方程式为___________。
(3)某盐组成为NH4R(WY4)2,向10mL1mol·L-1该盐溶液中滴加1mol·L-1NaOH溶液,沉淀的物质的量随加入NaOH溶液体积的变化如图所示。
①写出m点发生反应的离子方程式___________。
②若在该盐溶液中改加20mL1.2mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为___________mol。
14.下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系(部分反应条件已省略),其中A、B是单质,A的焰色反应为黄色,C、D是化合物,其他物质已经给出化学式,依据转化关系回答下列问题(出现A、B、C、D请用元素符号表示):
(1)C物质的名称_______;①的基本反应类型_______。
(2)形成单质B的元素在周期表中位于第_______周期第_______族。
(3)离子半径A+_______O2-(填“<”“>”或“=”)
(4)D的电子式_______,A的原子结构示意图_______。
(5)D气体与氨气在空气中相遇发生反应,产生的现象是_______;其化学反应方程式_______。写出足量的D溶液与碳酸钠溶液反应的离子反应方程式_______。
15.元素周期表是学习化学的重要工具,它隐含许多信息和规律。
(1)用元素符号写出:C___________,E___________。
(2)D元素处于周期表中___________周期___________族。
(3)上述五种元素的最高价氧化物对应水化物酸性最强的是_______,具有两性的物质是_______。(均填化学式)
(4)写出氧化铝和氢氧化钠溶液反应的离子方程式:___________。
(5)用电子式表示镁和氯形成化合物的过程:___________。
16.某粒子(原子或离子)的结构示意图如图所示,请回答下列问题:
(1)若m = 11,则该粒子所对应元素的符号为___________;
(2)若该粒子带两个单位负电荷,且n = 8,则该粒子的符号为___________;
(3)若m-n<10,则该粒子是一个___________(选填“原子”、“阳离子”或“阴离子”)。
17.《石雅》云:“青金石色相如天,或复金屑散乱,光辉灿烂,若众星丽于天也”。青金石的化学组成可表示为。
回答下列问题:
(1)钠在周期表中的位置是___________;质子数与中子数相等的硅原子符号为___________;钙离子的结构示意图为___________。
(2)的电子式为___________,的电子式为___________。
(3)与的化学性质相似,则与溶液反应的化学方程式是___________
(4)宏观辨识与微观探析是化学学科的核心素养之一、下列能说明的非金属性比S强的事实是___________(填标号)。
A.氯、硫的最低负价分别为、 B.中氯显价,硫显价
C.的酸性比的强 D.向水溶液中通入有淡黄色沉淀生成
E.硫化氢在时开始分解,在时开始缓慢分解
18.I、实验室用50 mL浓盐酸跟足量的氯酸钾固体共热制取氯气,该反应的化学方程式为KClO3+6HCl(浓) =3Cl2↑+KCl+3H2O。
(1)浓盐酸在此反应中所具有的性质是___________(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)若产生0.3 mol Cl2,求反应中转移的电子数______。
II.离子反应是中学化学中重要的反应类型,回答下列问题:
(3)在发生离子反应的反应物或生成物中,一定存在______ (填编号)。
A.单质 B.氧化物 C.电解质 D.盐 E.化合物
(4)有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的第二层电子数是第一层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
①写出下列元素的名称:A___________,B___________,C___________,D___________。
②写出AB2与C2B2反应的化学方程式:___________。
19.消毒剂在生产生活中有极重要的作用,广谱、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)(还原产物为)、(1 mol 转化为1 mol 和1 mol )等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是_______(填序号)。
A. B. C. D.
(2)有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:=,则生成物A的化学式为_______,被称为“绿色氧化剂”的理由是_______,的结构式是_______ 。
(3)漂白剂亚氯酸钠()在常温、黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为(未配平)。该反应中,有1 mol 生成转移的电子数约为_______ 。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是_______(用离子方程式表示)。利用氯碱工业的产物可生产“84”消毒液,写出有关反应的化学方程式:_______。
20.图表是元素周期表中的一部分。
根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是_______,氧化性最强的单质是_______,还原性最强的单质是_______。
(2)最高价氧化物对应的水化物中,碱性最强的是_______,酸性最强的是_______,呈两性的是_______。
(3)A分别与E、F、G、H、I形成的简单气态化合物中,最稳定的是_______。
(4)在B、C、D、G、I中,原子半径最大的是_______。
(5)D的最高价氧化物的水化物是两性氧化物,写出它与B的最高价氧化物的水化物反应的化学方程式_______。
21.将镁、铝的混合物共0.2mol,溶于200mL4mol·L—1的盐酸溶液中,然后再滴加2mol·L—1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160mL时,则金属粉末中n(Mg)=_______________mol;
(2)0~V1段发生的反应的离子方程式为_______________;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+ 刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=_______________mL;
(4)试计算V2的值: V2=_______________mL。
22.将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.
(1)Mg和Al的总质量为 g
(2)硫酸的物质的量浓度为 .
(3)NaOH溶液的物质的量浓度为 .
参考答案
1.C 2.B 3.D 4.D 5.C 6.C 7.B 8.D 9.D 10.C 11.D 12.B
13.(1) 第三周期第VIA族
(2) H2S+H2O2=S↓+2H2O
(3) NH+OH-=NH3·H2O 0.022
14.(1) 过氧化钠 化合反应
(2) 一 ⅠA
(3)<
(4)
(5) 有白烟生成 HCl+NH3=NH4Cl 2H++CO=H2O+CO2↑
15.(1) Al Cl
(2) 三 VIA
(3) HClO4 Al(OH)3
(4)Al(OH)3+OH-= +2H2O
(5)
16.(1)Na
(2)S2-
(3)阴离子
17.(1) 第三周期ⅠA族
(2)
(3)
(4)BDE
18.(1)②
(2)0.5NA
(3)CE
(4) 碳 氧 钠 硫 2CO2+2Na2O=2Na2CO3+O2
19.(1)C
(2) 是氧化剂,其产物没有污染性 H-O-O-H
(3)
(4) = =
20.(1) Ne F2 Na
(2) NaOH HClO4 Al(OH)3
(3)HF
(4)Na>Mg>Al>S>Cl
(5)Al(OH)3+NaOH=NaAlO2+2H2O
21.0.12 H++OH-=H2O 400 440
22.(1)9.0g(2)1.0mol/L(3)5.0mol/L
一、单选题(共12题)
1.为纪念元素周期表诞生150周年,联合国宣布2019年为“元素周期表年”。硅是第14号元素,如图是硅元素在元素周期表中的相关信息,下列说法正确的是
A.硅元素属于金属元素 B.硅元素的相对原子质量为28.09g
C.SiO2中硅元素的化合价为+4 D.硅元素是地壳中含量最高的元素
2.以下发明或发现属于中国在化学方面对世界有重大贡献的是
①造纸 ②印刷技术 ③黑火药 ④指南针 ⑤炼铜、炼铁、炼钢 ⑥合成有机高分子材料 ⑦人工合成牛胰岛素 ⑧提出原子—分子论学说
A.①②③④⑧ B.①③⑤⑦ C.②④⑥ D.⑤⑥⑦⑧
3.有A、B两种原子,A原子的第三电子层比B原子的第三电子层少3个电子,B原子的第二电子层电子数恰好为A原子第二电子层电子数的2倍.A和B分别是
A.硅原子和钠原子 B.硼原子和氦原子 C.氯原子和碳原子 D.碳原子和铝原子
4.下列说法正确的是
A.某元素从单质转变为化合物,该元素一定被氧化
B.金属氧化物一定是碱性氧化物
C.复分解反应不一定是氧化还原反应
D.由离子构成的化合物在熔融状态下一定能导电
5.下列有关锂和钠元素的说法正确的是
A.二者原子半径大小:Li>Na
B.二者单质加热条件下都能与氧气反应生成过氧化物
C.二者单质与水反应时都浮在水面上,并且钠比锂反应剧烈
D.氢氧化物碱性:LiOH>NaOH
6.石墨烯是用微机械剥离法从石墨中分离出的单层石墨,被认为是一种未来革命性的材料。下列说法正确的是
A.石墨烯是化合物 B.石墨烯由分子构成
C.石墨与金刚石互为同素异形体 D.石墨是电解质
7.短周期元素X、Y、Z和W原子序数之和为48,在周期表中的位置如图所示。下列说法错误的是
X Y
Z W
A.原子半径:X>Y
B.Z的简单氢化物的稳定性强于Y
C.最高价氧化物对应水化物的酸性:W>Z
D.X最高价氧化物的水化物能与其最低价氢化物反应
8.根据下列粒子的结构示意图,其中属于阳离子的是
A. B. C. D.
9.下列有关物质用途的说法中,不正确的是
A.NH3常用作制冷剂 B.Fe2O3可作红色涂料
C.用Al(OH)3治疗胃酸过多 D.用SO2漂白馒头
10.下列化学用语正确的是
A.氯离子的结构示意图: B.质子数为6、中子数为8的核素C
C.异戊烷键线式: D.H2S的电子式
11.20世纪初,在原子结构理论的基础上,建立了化学键的电子理论,共价键是现代化学键理论的核心。下列不含共价键的离子化合物是
A.NaClO B.Al2(SO4)3 C.H2O2 D.MgBr2
12.为原子序数依次增大的短周期元素,其中原子的质子数是其层电子数的三倍,与与相邻,与同主族。下列说法正确的是
A.原子半径:
B.最高价氧化物对应水化物的酸性:
C.最简单气态氢化物的热稳定性:
D.元素的最高化合价分别与其主族序数相等
二、非选择题(共10题)
13.X、Y、Z、R、W是原子序数依次增大的短周期主族元素,其中两种为金属元素。X的某同素异形体是天然存在的最硬物质;Y与W同主族,Y的最外层电子数是其周期数的三倍;将Z单质投入水中,浮在水面并剧烈反应;R的简单离子半径在同周期中最小。
(1)W在元素周期表中的位置是___________;Z的离子结构示意图为___________。
(2)H2Y2的电子式为___________;将W的氢化物通入H2Y2溶液中,溶液变浑浊,发生反应的化学方程式为___________。
(3)某盐组成为NH4R(WY4)2,向10mL1mol·L-1该盐溶液中滴加1mol·L-1NaOH溶液,沉淀的物质的量随加入NaOH溶液体积的变化如图所示。
①写出m点发生反应的离子方程式___________。
②若在该盐溶液中改加20mL1.2mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为___________mol。
14.下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系(部分反应条件已省略),其中A、B是单质,A的焰色反应为黄色,C、D是化合物,其他物质已经给出化学式,依据转化关系回答下列问题(出现A、B、C、D请用元素符号表示):
(1)C物质的名称_______;①的基本反应类型_______。
(2)形成单质B的元素在周期表中位于第_______周期第_______族。
(3)离子半径A+_______O2-(填“<”“>”或“=”)
(4)D的电子式_______,A的原子结构示意图_______。
(5)D气体与氨气在空气中相遇发生反应,产生的现象是_______;其化学反应方程式_______。写出足量的D溶液与碳酸钠溶液反应的离子反应方程式_______。
15.元素周期表是学习化学的重要工具,它隐含许多信息和规律。
(1)用元素符号写出:C___________,E___________。
(2)D元素处于周期表中___________周期___________族。
(3)上述五种元素的最高价氧化物对应水化物酸性最强的是_______,具有两性的物质是_______。(均填化学式)
(4)写出氧化铝和氢氧化钠溶液反应的离子方程式:___________。
(5)用电子式表示镁和氯形成化合物的过程:___________。
16.某粒子(原子或离子)的结构示意图如图所示,请回答下列问题:
(1)若m = 11,则该粒子所对应元素的符号为___________;
(2)若该粒子带两个单位负电荷,且n = 8,则该粒子的符号为___________;
(3)若m-n<10,则该粒子是一个___________(选填“原子”、“阳离子”或“阴离子”)。
17.《石雅》云:“青金石色相如天,或复金屑散乱,光辉灿烂,若众星丽于天也”。青金石的化学组成可表示为。
回答下列问题:
(1)钠在周期表中的位置是___________;质子数与中子数相等的硅原子符号为___________;钙离子的结构示意图为___________。
(2)的电子式为___________,的电子式为___________。
(3)与的化学性质相似,则与溶液反应的化学方程式是___________
(4)宏观辨识与微观探析是化学学科的核心素养之一、下列能说明的非金属性比S强的事实是___________(填标号)。
A.氯、硫的最低负价分别为、 B.中氯显价,硫显价
C.的酸性比的强 D.向水溶液中通入有淡黄色沉淀生成
E.硫化氢在时开始分解,在时开始缓慢分解
18.I、实验室用50 mL浓盐酸跟足量的氯酸钾固体共热制取氯气,该反应的化学方程式为KClO3+6HCl(浓) =3Cl2↑+KCl+3H2O。
(1)浓盐酸在此反应中所具有的性质是___________(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)若产生0.3 mol Cl2,求反应中转移的电子数______。
II.离子反应是中学化学中重要的反应类型,回答下列问题:
(3)在发生离子反应的反应物或生成物中,一定存在______ (填编号)。
A.单质 B.氧化物 C.电解质 D.盐 E.化合物
(4)有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的第二层电子数是第一层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
①写出下列元素的名称:A___________,B___________,C___________,D___________。
②写出AB2与C2B2反应的化学方程式:___________。
19.消毒剂在生产生活中有极重要的作用,广谱、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)(还原产物为)、(1 mol 转化为1 mol 和1 mol )等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是_______(填序号)。
A. B. C. D.
(2)有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:=,则生成物A的化学式为_______,被称为“绿色氧化剂”的理由是_______,的结构式是_______ 。
(3)漂白剂亚氯酸钠()在常温、黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为(未配平)。该反应中,有1 mol 生成转移的电子数约为_______ 。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是_______(用离子方程式表示)。利用氯碱工业的产物可生产“84”消毒液,写出有关反应的化学方程式:_______。
20.图表是元素周期表中的一部分。
根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是_______,氧化性最强的单质是_______,还原性最强的单质是_______。
(2)最高价氧化物对应的水化物中,碱性最强的是_______,酸性最强的是_______,呈两性的是_______。
(3)A分别与E、F、G、H、I形成的简单气态化合物中,最稳定的是_______。
(4)在B、C、D、G、I中,原子半径最大的是_______。
(5)D的最高价氧化物的水化物是两性氧化物,写出它与B的最高价氧化物的水化物反应的化学方程式_______。
21.将镁、铝的混合物共0.2mol,溶于200mL4mol·L—1的盐酸溶液中,然后再滴加2mol·L—1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160mL时,则金属粉末中n(Mg)=_______________mol;
(2)0~V1段发生的反应的离子方程式为_______________;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+ 刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=_______________mL;
(4)试计算V2的值: V2=_______________mL。
22.将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.
(1)Mg和Al的总质量为 g
(2)硫酸的物质的量浓度为 .
(3)NaOH溶液的物质的量浓度为 .
参考答案
1.C 2.B 3.D 4.D 5.C 6.C 7.B 8.D 9.D 10.C 11.D 12.B
13.(1) 第三周期第VIA族
(2) H2S+H2O2=S↓+2H2O
(3) NH+OH-=NH3·H2O 0.022
14.(1) 过氧化钠 化合反应
(2) 一 ⅠA
(3)<
(4)
(5) 有白烟生成 HCl+NH3=NH4Cl 2H++CO=H2O+CO2↑
15.(1) Al Cl
(2) 三 VIA
(3) HClO4 Al(OH)3
(4)Al(OH)3+OH-= +2H2O
(5)
16.(1)Na
(2)S2-
(3)阴离子
17.(1) 第三周期ⅠA族
(2)
(3)
(4)BDE
18.(1)②
(2)0.5NA
(3)CE
(4) 碳 氧 钠 硫 2CO2+2Na2O=2Na2CO3+O2
19.(1)C
(2) 是氧化剂,其产物没有污染性 H-O-O-H
(3)
(4) = =
20.(1) Ne F2 Na
(2) NaOH HClO4 Al(OH)3
(3)HF
(4)Na>Mg>Al>S>Cl
(5)Al(OH)3+NaOH=NaAlO2+2H2O
21.0.12 H++OH-=H2O 400 440
22.(1)9.0g(2)1.0mol/L(3)5.0mol/L
