人教版(五四制)九年级全一册化学 实验活动5 粗盐中难溶性杂质的去除(课件)(13张PPT)
文档属性
| 名称 | 人教版(五四制)九年级全一册化学 实验活动5 粗盐中难溶性杂质的去除(课件)(13张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-20 08:41:57 | ||
图片预览





文档简介
(共13张PPT)
实验活动8 粗盐中难溶性杂质的去除
海 水 晒 盐
海盐
岩盐
湖盐
井盐
粗 盐
粗盐 精盐
粗盐提纯
一.不可溶性杂志
二.可溶性杂质
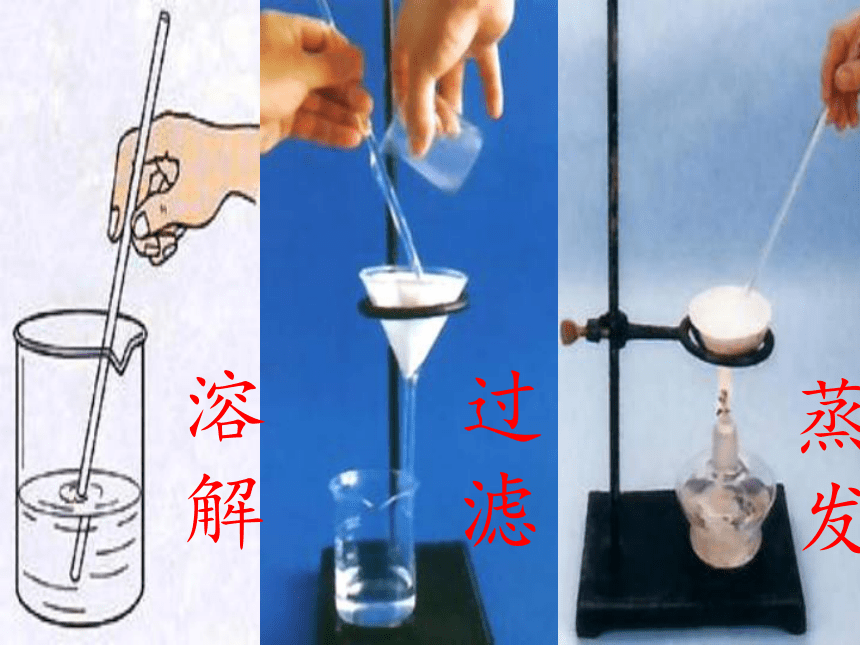
溶解
过滤
蒸发
溶解时玻璃棒的作用是
过滤时玻璃棒的作用是
蒸发时玻璃棒的作用是
加快溶解速率
引流
使液体受热均匀,防止液体飞溅
思考探究:
粗盐中可溶性杂质主要是CaCl2 、 MgCl2 、Na2SO4,
如何除去
1.主要物质NaCl,
(杂质:CaCl2、MgCl2、Na2SO4)
杂质中有哪些杂质离子?
2.针对每一种杂质离子,该用什么试剂除去?
3.加入试剂的顺序应该怎样排列?
问题分解
杂 质 加入的试剂 化学方程式
Na2SO4 BaCl2 BaCl2+Na2SO4=BaSO4↓+2NaCl
MgCl2 NaOH MgCl2+2NaOH=Mg(OH)2↓+2NaCl
CaCl2 Na2CO3 CaCl2+Na2CO3=CaCO3↓+2NaCl
温馨提示:
首先要选试剂,若试剂不只一种,要考虑试剂的加入顺序。
提纯和分离遵循三个原则:
不增(不增加新杂质)、
不减(不减少主要成分)、
易分离(反应后物质状态不同,便于分离)
方案
1、BaCl2,NaOH,Na2CO3 过滤 盐酸
2、BaCl2 , Na2CO3, NaOH,过滤 , 盐酸
3、 NaOH , BaCl2 , Na2CO3, 过滤 ,盐酸
Na+ Cl-
H2O
SO42- Ca2+ Mg2+
⑤适量 HCI
Na+ Cl- H2O
Ca2+ Mg2+ 、 Ba2+ BaSO4
Na+ Cl-H2O Mg2+ CO32-BaSO4 CaCO3
BaCO3
Na+ Cl- H2O CO32- OH- BaSO4
CaCO3
Mg(OH)2
BaCO3
①过量BaCl2溶液
Na+ Cl-H2O
②过量Na2CO3溶液
④ 过滤
③过量NaOH溶液
Na+ Cl- CO32-
OH-H2O
Na+ Cl-
⑥蒸发
PH试纸
红色物质都要去掉
谢 谢
实验活动8 粗盐中难溶性杂质的去除
海 水 晒 盐
海盐
岩盐
湖盐
井盐
粗 盐
粗盐 精盐
粗盐提纯
一.不可溶性杂志
二.可溶性杂质
溶解
过滤
蒸发
溶解时玻璃棒的作用是
过滤时玻璃棒的作用是
蒸发时玻璃棒的作用是
加快溶解速率
引流
使液体受热均匀,防止液体飞溅
思考探究:
粗盐中可溶性杂质主要是CaCl2 、 MgCl2 、Na2SO4,
如何除去
1.主要物质NaCl,
(杂质:CaCl2、MgCl2、Na2SO4)
杂质中有哪些杂质离子?
2.针对每一种杂质离子,该用什么试剂除去?
3.加入试剂的顺序应该怎样排列?
问题分解
杂 质 加入的试剂 化学方程式
Na2SO4 BaCl2 BaCl2+Na2SO4=BaSO4↓+2NaCl
MgCl2 NaOH MgCl2+2NaOH=Mg(OH)2↓+2NaCl
CaCl2 Na2CO3 CaCl2+Na2CO3=CaCO3↓+2NaCl
温馨提示:
首先要选试剂,若试剂不只一种,要考虑试剂的加入顺序。
提纯和分离遵循三个原则:
不增(不增加新杂质)、
不减(不减少主要成分)、
易分离(反应后物质状态不同,便于分离)
方案
1、BaCl2,NaOH,Na2CO3 过滤 盐酸
2、BaCl2 , Na2CO3, NaOH,过滤 , 盐酸
3、 NaOH , BaCl2 , Na2CO3, 过滤 ,盐酸
Na+ Cl-
H2O
SO42- Ca2+ Mg2+
⑤适量 HCI
Na+ Cl- H2O
Ca2+ Mg2+ 、 Ba2+ BaSO4
Na+ Cl-H2O Mg2+ CO32-BaSO4 CaCO3
BaCO3
Na+ Cl- H2O CO32- OH- BaSO4
CaCO3
Mg(OH)2
BaCO3
①过量BaCl2溶液
Na+ Cl-H2O
②过量Na2CO3溶液
④ 过滤
③过量NaOH溶液
Na+ Cl- CO32-
OH-H2O
Na+ Cl-
⑥蒸发
PH试纸
红色物质都要去掉
谢 谢
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
