高中化学苏教版(2021) 选择性必修2 专题1 第一单元 物质结构研究的内容(60张PPT)
文档属性
| 名称 | 高中化学苏教版(2021) 选择性必修2 专题1 第一单元 物质结构研究的内容(60张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-19 22:04:13 | ||
图片预览











文档简介
(共60张PPT)
第一单元
物质结构研究的内容
核心素养发展目标
1.能结合已有的知识描述常见物质的微观结构,分析物质结构与其
性质之间的关系。
2.能从物质的微观结构出发解释或预测物质的宏观性质。
3.认识物质结构研究对化学科学发展的重要意义。
随堂演练
知识落实
课时
对点练
内容索引
一、认识物质的特征结构
二、揭示物质结构和性质的关系
一、认识物质的特征结构
1.元素性质周期性变化的主要原因是 。
2.人们通过深入研究原子的结构,特别是 发生的变化,以此判断元素的性质。如钠原子在化学反应中容易失去最外电子层上的1个电子,形成Na+,钠元素表现出强的 ;氯原子在化学反应中倾向于获得1个电子,形成Cl-,氯元素表现出强的 ,Na+和Cl-再通过 生成氯化钠。
元素原子最外层电子排布的周期性
最外电子层上
金属性
非金属性
静电作用力
3.研究物质之间的化学反应,其本质就是研究从 (反应物)如何转变为另一种 (生成物),这就需要对反应物、生成物的特征结构进行针对性的研究,考察反应物中什么原子或原子团上的化学键容易发生断裂,继而在什么位置上生成新的化学键。
一种结构
新的结构
正误判断
(1)物质的结构仅包括构成物质的微粒间的相互作用和分子的结构( )
(2)物质随着人们的认识或研究的发展,经常发生一些小的变化( )
(3)物质有宏观和微观两个方面的认识,从宏观上说物质是由元素组成的,从微观上说物质是由分子构成的( )
(4)原子失去电子数越多,金属性越强,得电子数越多,非金属性越强
( )
×
√
×
×
深度思考
1.假若你是一位化学科研工作者,在研究物质的特征结构时需要思考那些问题?
提示 同一元素或不同种元素的原子之间为什么能彼此结合?为什么物质中直接相邻原子之间的化学键类型不同?为什么原子、分子或离子可以构成不同的晶体?晶体中的微粒间是通过怎样的相互作用结合的?为什么分子具有一定的空间构型?为什么有机化合物有同分异构体现象?为什么有些元素能形成几种同素异形体?
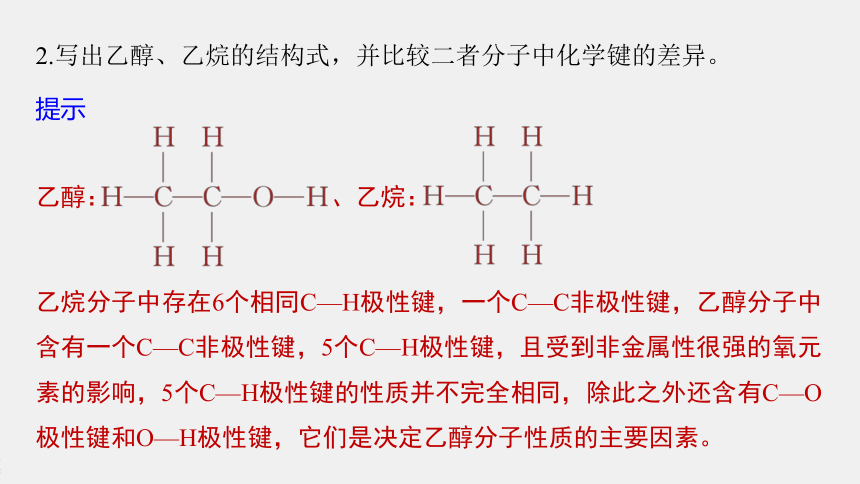
2.写出乙醇、乙烷的结构式,并比较二者分子中化学键的差异。
提示
乙醇: 、乙烷:
乙烷分子中存在6个相同C—H极性键,一个C—C非极性键,乙醇分子中含有一个C—C非极性键,5个C—H极性键,且受到非金属性很强的氧元素的影响,5个C—H极性键的性质并不完全相同,除此之外还含有C—O极性键和O—H极性键,它们是决定乙醇分子性质的主要因素。
3.写出过氧化氢的电子式和结构式,指出其分子中存在的化学键类型,试从氧元素化合价的角度解释过氧化氢具有强氧化性的原因。
提示 ,H—O—O—H。过氧化氢分子中存在两个O—H极性键和一个O—O非极性键。分子中氧的化合价为-1价,容易得一个电子形成稳定的-2价氧原子,因而过氧化氢具有强氧化性。
返回
二、揭示物质结构和性质的关系
物质的结构决定物质的性质,物质的性质反映物质的结构。
1.同素异形体
(1)概念: 。
(2)性质:同素异形体的物理性质 ,化学性质 。
同素异形体性质不同的原因是因为组成它们的结构微粒排列方式不同造成的。
由同一种元素形成的不同种单质
不同
相似
2.磷的两种同素异形体——白磷和红磷
白磷是由 组成的分子晶体,分子呈 ,键角为 ,因其中的 键弯曲而具有较大的张力,其键能较小,易断裂,所以白磷在常温、常压下有很高的反应活性,而红磷呈 结构,比较稳定,室温下不与氧气反应。
白磷分子
正四面体结构
60°
P—P
链状
3.碳的五种同素异形体
(1)金刚石
碳原子间结合牢固。金刚石也是自然界中天然存在的最坚硬的物质,可用于切割金属。
(2)木炭
碳原子不规则结合,又称无定型碳。
(3)富勒烯结构
碳原子结合形状呈中空足球状,其中空部分可以填入其他原子或分子。
(4)碳纳米管结构
中空管状的富勒烯又称碳纳米管。它强度高、弹性佳,应用前景广泛。
(5)石墨
碳原子呈六边形结合成网状并层层重叠,层与层之间引力微弱,可以滑动。常用作润滑剂。
深度思考
1.为什么分子组成都是C2H6O的乙醇和二甲醚在性质上差异很大?例如,乙醇能与金属钠反应放出氢气而二甲醚却不能,乙醇易溶于水而二甲醚却不溶于水。
提示 乙醇的结构式为 ,二甲醚的结构式为
,由于组成乙醇、二甲醚的微粒的排列方式不同,
造成它们的性质差异很大;在乙醇中含有—OH,所以能和Na反应放出H2,—OH能和H2O之间形成氢键,所以乙醇易溶于水。
2.许多磷的化合物的结构与P4的正四面体有关,如白磷在空气中燃烧,生成的产物之一是P4O6。试从结构上对该反应进行解释。
提示 白磷的正四面体结构为 ,其中P—P键弯曲而具有较大的张
力,其键能较小,易断裂,共有6个P—P键,所以可结合6个氧原子,所以生成物之一为P4O6。
应用体验
1.下列有关物质结构与性质的说法中,不正确的是
A.N2通常条件下很稳定的原因是氮分子中氮氮三键的键能大
B.根据石墨易传热、能导电的性质,可以推测出石墨晶体中有自由移动
的电子
C.X射线衍射实验可以“看到”原子的内部结构
D.研究材料结构与性质的关系,有助于新材料的研发
√
2.最近医学界通过用放射性14C来标记C60,发现C60的一种羧酸衍生物在特定条件下可通过断裂DNA来杀死细胞,从而抑制艾滋病(AIDS)。下列有关14C的叙述正确的是
A.与12C原子的化学性质不同
B.与14N含有的中子数相同
C.是C60的同素异形体
D.与12C互为同位素
√
3.C60虽然与金刚石互为同素异形体,但两者的物理性质差异较大。下列关于C60的说法正确的是
A.易溶于水
B.易溶于氯化钠溶液
C.易溶于氨水
D.可溶于苯等有机溶剂
√
返回
随堂演练 知识落实
1.金刚石和石墨的物理性质存在着较大差异,原因是
A.它们是由不同种元素构成的
B.它们各自的原子排列方式不同
C.它们具有不同的几何外形
D.石墨能导电而金刚石不能
√
1
2
3
4
5
2.科学家发现由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料。下列说法正确的是
A.黑磷属于化合物
B.黑磷导电属于化学变化
C.黑磷高温下在空气中可以稳定存在
D.黑磷与白磷互为同素异形体
1
2
3
4
5
√
3.下列说法正确的是
A.红磷转化为白磷,属于物理变化
B.石墨导电、金刚石不导电,故二者不是同素异形体
C.O2和O3分子式不同,性质相同
D.硫有S2、S4、S6等单质,它们都是硫的同素异形体
√
1
2
3
4
5
4.重水(D2O)是重要的核工业原料,下列说法错误的是
A.氘(D)原子核外有1个电子
B.1H与D互为同位素
C.H2O与D2O互为同素异形体
D.H218O与D216O的相对分子质量相同
√
1
2
3
4
5
5.钋(Po)是一种低熔点金属,极其稀有,毒性和放射性极强。回答下列问题:
(1) 具有放射性,经α衰变成稳定的Pb原子,在衰变过程中释放一个
。生成的Pb的原子核中质子数为____,中子数为____。Po元素能形
成较稳定的+4价离子,w g 含有的电子的物质的量为________。
1
2
3
4
5
82
124
(2)下列有关说法正确的是____(填字母)。
a.由 衰变为铅的变化是化学变化
b.钋元素的相对原子质量为210
c.210Po比209Po原子核多一个中子
d.研究表明,烟草中含有210Po和209Po等,它们互为同位素
1
2
3
4
5
cd
1
2
3
4
5
47.09 g
返回
课 时 对 点 练
基础对点练
题组一 物质的特征结构
1.(2020·咸阳高二检测)下列说法正确的是
A.原子是不可再分的
B.原子中肯定含有中子
C.原子由原子核和核外电子构成,原子核又可以分为质子和中子,然后
不能再分
D.随着科学的发展,人们发现原子组成中还存在更小的微粒,如夸克
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
2.原子的种类决定于原子的
A.原子量大小 B.核内质子数和中子数
C.最外层电子数 D.核电荷数
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 原子中质量数=质子数+中子数,原子不同,质量数不同,即质子数、中子数的和不同,所以原子的种类决定于原子的核内质子数和中子数。
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wüthrich等人为此获得了2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是
A.13C与15N有相同的中子数
B.13C与C60互为同素异形体
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 根据质量数(A)=质子数(Z)+中子数(N),可得13C、15N的中子数分别为7、8;同素异形体是由同一元素形成的不同单质;15N的核外电子数与中子数分别为7、8。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
5.科学工作者发现另一种“足球分子”N60,它的结构与C60相似。下列说法正确的是
A.N60和C60互为同素异形体
B.N60是一种新型化合物
C.N60和N2是同素异形体
D.N60和14N都是氮的同系物
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 N60和C60是不同元素组成的单质,所以不是同素异形体,故A错误;
N60中只含一种元素,所以是单质,故B错误;
N60和N2是N的不同单质,所以是同素异形体,故C正确;
N60是单质,14N是原子,所以不是同系物,且同系物多用于有机化合物,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
6.(2021·咸阳百灵学校高一月考)下列表达方式正确的是
A.用电子式表示HCl的形成过程:
B.质子数为17、中子数为20的氯原子:
C.HClO的结构式:H—O—Cl
D.NH4Cl的电子式:
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 HCl为共价化合物,用电子式表示其形成过程:H·+ ―→
,故A错误;
质子数为17、中子数为20的氯原子,其质量数为37,可表示为 ,故B错误;
HClO中O原子分别与H原子和Cl原子形成共价键,故其结构式为H—O—Cl,故C正确;
NH4Cl是由 和Cl-构成的离子化合物,其电子式为 ,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
题组二 物质结构与性质的关系
7.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知质子数或中子数为奇数的原子核才有NMR现象,而质子数和中子数均为偶数的原子不产生核磁共振,下列原子组一定能产生NMR现象的是
A.18O、31P、119Sn B.27Al、19F、12C
C.12C、32S、19F D.1H、13C、35Cl
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 A中18O的质子数为8、中子数为10,不符合题意;
B中12C的质子数和中子数均为6,不符合题意;
C中12C的质子数、中子数均为6,32S的质子数和中子数均为16,不符合题意;
D中1H质子数为1,13C中子数为7,35Cl中质子数为17,符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
8.(2021·浙江衢州高一期末)下列说法正确的是
A.H2O的沸点较高是因为水分子间存在较强的化学键
B.HCl气体溶于水后,共价键被破坏,形成了H+和Cl-
C.H2S分子中所有原子最外电子层都具有8电子的稳定结构
D.NaOH和MgCl2所含化学键类型完全相同
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 水的沸点较高是因为水分子间存在氢键,氢键是分子间作用力,不属于化学键,A错误;
氯化氢气体溶于水时,H—Cl共价键断裂,生成H+和Cl-,B正确;
H2S分子中H最外电子层上有2个电子,不具有8电子稳定结构,C错误;
NaOH含有离子键和共价键,MgCl2只含离子键,两者化学键类型不完全相同,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
9.已知下列数据:
碳原子核间距离/10-10 m 断裂碳碳键所需能量/(kJ·mol-1)
H3C—CH3 1.54 348
H2C==CH2 1.33 615
HC≡CH 1.20 812
下列事实可用上述数据解释的是
A.乙烯的熔、沸点比乙烷的低 B.乙炔在水中的溶解度比乙烯的大
C.乙炔燃烧时有浓烟产生 D.乙烯、乙炔都易发生加成反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 分子晶体的熔、沸点与分子间作用力有关,组成和结构相似的物质,相对分子质量越大,熔、沸点越高,与键长、键能无关,故A错误;
键长和键能与物质的溶解性无关,故B错误;
是否产生浓烟与含碳量有关,与键长、键能无关,故C错误;
乙烯和乙炔中的双键和三键并不是碳碳单键的加和,平均键能比碳碳单键的小,所以碳碳双键和碳碳三键易发生加成反应,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
10.碳纳米管是一种纳米尺度的、具有完整分子结构的新型材料,它是由一层碳原子卷曲而成的无缝、中空的管体,具有质轻、可弯曲、强度好、弹性强的特点。下列关于碳纳米管的可能用途不正确的是
A.用它可做成攀登月球的“太空天梯”
B.能解决室温下,低气压、高容量储存氢气的难题
C.作为优秀的绝缘材料
D.制成电脑芯片可大大提升计算机系统的计算能力
√
综合强化练
解析 碳纳米管由碳原子构成,能导电,不可作为绝缘材料。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
B.N60的发现开辟了能源世界的新天地,将来可能成为很好的火箭燃料
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
N60与C60结构相似,并在受热或机械撞击后,其中积蓄的巨大能量会在瞬间释放出来,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
12.NH3是一种重要的化工原料,在半导体光催化的作用下,N2分子被光催化材料捕获进而实现N2―→NH3的转化(过程如图)。下列说法错误的是
A.N2在光催化材料表面断开了N≡N键
B.该反应中,N2被还原
C.该反应过程中有旧化学键断裂和新化学键形成
D.该反应的类型是化合反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 由图知,N2在光催化材料表面断开了N≡N键,A正确;
该反应中,N2转变为氨气,氮元素化合价从0降低到-3,被还原,B正确;
该反应过程中N2、水参加反应,化学键断裂,生成氨气、氧气,化学键形成,有旧化学键断裂和新化学键形成,C正确;
由图知,反应中有氨气、氧气生成,则该反应的类型不可能是化合反应,D不正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13.据报道,科研人员应用电子计算机模拟出了类似C60的物质N60。已知N60分子中每个氮原子之间均以氮氮共价键结合三个氮原子,所有的氮原子都具有最外层为8个电子的稳定结构。N—N键键能为167 kJ·mol-1,N==N键键能为418 kJ·mol-1,N≡N键键能为942 kJ·mol-1。
试回答:
(1)根据键能和物质化学变化中的能量变化原理计算,1 mol N60全部分解为N2所吸收或放出的能量(热量)为________ kJ。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13 230
解析 1 mol N60分子含有90 mol N—N键,它分解生成30 mol N≡N键。1 mol N60分子中化学键拆开吸收的能量为90 mol×167 kJ·mol-1=15 030 kJ,30 mol N2分子中化学键的形成放出的能量为30 mol×942 kJ·mol-1=28 260 kJ。放出的总能量比吸收的总能量多13 230 kJ,化学反应是放热反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)根据(1)的计算结论推断,下列N60的用途正确的是_____(填字母)。
A.可用作高能炸药
B.可用作高能燃料
1
2
3
4
5
6
7
8
9
10
11
12
13
14
AB
解析 由于N60的分解放出大量的热,因此N60用作高能炸药和高能燃料都是可以的。
14.科学家正在设法探寻“反物质”。所谓“反物质”是由“反粒子”构成的,“反粒子”与其对应的正粒子具有相同的质量和相同的电量,但电荷符号相反。
(1)若有α粒子(即氦离子)的反粒子,称为反α粒子,则该粒子的质量数为____,电荷数为____,反α粒子的符号可表示为______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4
-2
He2-
(2)近几年,欧洲和美国的科学研究机构先后宣布,他们分别制出9个和7个反氢原子,这是人类探索反物质的一大进步。试推测反氢原子的构造是___(填字母)。
A.由一个带正电荷的质子与一个带负电荷的电子构成
B.由一个带负电荷的质子与一个带正电荷的电子构成
C.由一个不带电荷的中子与一个带负电荷的电子构成
D.由一个带负电荷的质子与一个带负电荷的电子构成
1
2
3
4
5
6
7
8
9
10
11
12
13
14
B
解析 所谓“反物质”,它的原子核是由反质子和反中子构成的,反质子的质量数为1,带负电荷,反中子的质量数也为1,不带电;核外是反电子,质量可忽略不计,带正电荷。正常的氢原子是由一个质子和一个电子构成的,反氢原子则是由一个反质子和一个反电子构成。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
返回
本课结束
第一单元
物质结构研究的内容
核心素养发展目标
1.能结合已有的知识描述常见物质的微观结构,分析物质结构与其
性质之间的关系。
2.能从物质的微观结构出发解释或预测物质的宏观性质。
3.认识物质结构研究对化学科学发展的重要意义。
随堂演练
知识落实
课时
对点练
内容索引
一、认识物质的特征结构
二、揭示物质结构和性质的关系
一、认识物质的特征结构
1.元素性质周期性变化的主要原因是 。
2.人们通过深入研究原子的结构,特别是 发生的变化,以此判断元素的性质。如钠原子在化学反应中容易失去最外电子层上的1个电子,形成Na+,钠元素表现出强的 ;氯原子在化学反应中倾向于获得1个电子,形成Cl-,氯元素表现出强的 ,Na+和Cl-再通过 生成氯化钠。
元素原子最外层电子排布的周期性
最外电子层上
金属性
非金属性
静电作用力
3.研究物质之间的化学反应,其本质就是研究从 (反应物)如何转变为另一种 (生成物),这就需要对反应物、生成物的特征结构进行针对性的研究,考察反应物中什么原子或原子团上的化学键容易发生断裂,继而在什么位置上生成新的化学键。
一种结构
新的结构
正误判断
(1)物质的结构仅包括构成物质的微粒间的相互作用和分子的结构( )
(2)物质随着人们的认识或研究的发展,经常发生一些小的变化( )
(3)物质有宏观和微观两个方面的认识,从宏观上说物质是由元素组成的,从微观上说物质是由分子构成的( )
(4)原子失去电子数越多,金属性越强,得电子数越多,非金属性越强
( )
×
√
×
×
深度思考
1.假若你是一位化学科研工作者,在研究物质的特征结构时需要思考那些问题?
提示 同一元素或不同种元素的原子之间为什么能彼此结合?为什么物质中直接相邻原子之间的化学键类型不同?为什么原子、分子或离子可以构成不同的晶体?晶体中的微粒间是通过怎样的相互作用结合的?为什么分子具有一定的空间构型?为什么有机化合物有同分异构体现象?为什么有些元素能形成几种同素异形体?
2.写出乙醇、乙烷的结构式,并比较二者分子中化学键的差异。
提示
乙醇: 、乙烷:
乙烷分子中存在6个相同C—H极性键,一个C—C非极性键,乙醇分子中含有一个C—C非极性键,5个C—H极性键,且受到非金属性很强的氧元素的影响,5个C—H极性键的性质并不完全相同,除此之外还含有C—O极性键和O—H极性键,它们是决定乙醇分子性质的主要因素。
3.写出过氧化氢的电子式和结构式,指出其分子中存在的化学键类型,试从氧元素化合价的角度解释过氧化氢具有强氧化性的原因。
提示 ,H—O—O—H。过氧化氢分子中存在两个O—H极性键和一个O—O非极性键。分子中氧的化合价为-1价,容易得一个电子形成稳定的-2价氧原子,因而过氧化氢具有强氧化性。
返回
二、揭示物质结构和性质的关系
物质的结构决定物质的性质,物质的性质反映物质的结构。
1.同素异形体
(1)概念: 。
(2)性质:同素异形体的物理性质 ,化学性质 。
同素异形体性质不同的原因是因为组成它们的结构微粒排列方式不同造成的。
由同一种元素形成的不同种单质
不同
相似
2.磷的两种同素异形体——白磷和红磷
白磷是由 组成的分子晶体,分子呈 ,键角为 ,因其中的 键弯曲而具有较大的张力,其键能较小,易断裂,所以白磷在常温、常压下有很高的反应活性,而红磷呈 结构,比较稳定,室温下不与氧气反应。
白磷分子
正四面体结构
60°
P—P
链状
3.碳的五种同素异形体
(1)金刚石
碳原子间结合牢固。金刚石也是自然界中天然存在的最坚硬的物质,可用于切割金属。
(2)木炭
碳原子不规则结合,又称无定型碳。
(3)富勒烯结构
碳原子结合形状呈中空足球状,其中空部分可以填入其他原子或分子。
(4)碳纳米管结构
中空管状的富勒烯又称碳纳米管。它强度高、弹性佳,应用前景广泛。
(5)石墨
碳原子呈六边形结合成网状并层层重叠,层与层之间引力微弱,可以滑动。常用作润滑剂。
深度思考
1.为什么分子组成都是C2H6O的乙醇和二甲醚在性质上差异很大?例如,乙醇能与金属钠反应放出氢气而二甲醚却不能,乙醇易溶于水而二甲醚却不溶于水。
提示 乙醇的结构式为 ,二甲醚的结构式为
,由于组成乙醇、二甲醚的微粒的排列方式不同,
造成它们的性质差异很大;在乙醇中含有—OH,所以能和Na反应放出H2,—OH能和H2O之间形成氢键,所以乙醇易溶于水。
2.许多磷的化合物的结构与P4的正四面体有关,如白磷在空气中燃烧,生成的产物之一是P4O6。试从结构上对该反应进行解释。
提示 白磷的正四面体结构为 ,其中P—P键弯曲而具有较大的张
力,其键能较小,易断裂,共有6个P—P键,所以可结合6个氧原子,所以生成物之一为P4O6。
应用体验
1.下列有关物质结构与性质的说法中,不正确的是
A.N2通常条件下很稳定的原因是氮分子中氮氮三键的键能大
B.根据石墨易传热、能导电的性质,可以推测出石墨晶体中有自由移动
的电子
C.X射线衍射实验可以“看到”原子的内部结构
D.研究材料结构与性质的关系,有助于新材料的研发
√
2.最近医学界通过用放射性14C来标记C60,发现C60的一种羧酸衍生物在特定条件下可通过断裂DNA来杀死细胞,从而抑制艾滋病(AIDS)。下列有关14C的叙述正确的是
A.与12C原子的化学性质不同
B.与14N含有的中子数相同
C.是C60的同素异形体
D.与12C互为同位素
√
3.C60虽然与金刚石互为同素异形体,但两者的物理性质差异较大。下列关于C60的说法正确的是
A.易溶于水
B.易溶于氯化钠溶液
C.易溶于氨水
D.可溶于苯等有机溶剂
√
返回
随堂演练 知识落实
1.金刚石和石墨的物理性质存在着较大差异,原因是
A.它们是由不同种元素构成的
B.它们各自的原子排列方式不同
C.它们具有不同的几何外形
D.石墨能导电而金刚石不能
√
1
2
3
4
5
2.科学家发现由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料。下列说法正确的是
A.黑磷属于化合物
B.黑磷导电属于化学变化
C.黑磷高温下在空气中可以稳定存在
D.黑磷与白磷互为同素异形体
1
2
3
4
5
√
3.下列说法正确的是
A.红磷转化为白磷,属于物理变化
B.石墨导电、金刚石不导电,故二者不是同素异形体
C.O2和O3分子式不同,性质相同
D.硫有S2、S4、S6等单质,它们都是硫的同素异形体
√
1
2
3
4
5
4.重水(D2O)是重要的核工业原料,下列说法错误的是
A.氘(D)原子核外有1个电子
B.1H与D互为同位素
C.H2O与D2O互为同素异形体
D.H218O与D216O的相对分子质量相同
√
1
2
3
4
5
5.钋(Po)是一种低熔点金属,极其稀有,毒性和放射性极强。回答下列问题:
(1) 具有放射性,经α衰变成稳定的Pb原子,在衰变过程中释放一个
。生成的Pb的原子核中质子数为____,中子数为____。Po元素能形
成较稳定的+4价离子,w g 含有的电子的物质的量为________。
1
2
3
4
5
82
124
(2)下列有关说法正确的是____(填字母)。
a.由 衰变为铅的变化是化学变化
b.钋元素的相对原子质量为210
c.210Po比209Po原子核多一个中子
d.研究表明,烟草中含有210Po和209Po等,它们互为同位素
1
2
3
4
5
cd
1
2
3
4
5
47.09 g
返回
课 时 对 点 练
基础对点练
题组一 物质的特征结构
1.(2020·咸阳高二检测)下列说法正确的是
A.原子是不可再分的
B.原子中肯定含有中子
C.原子由原子核和核外电子构成,原子核又可以分为质子和中子,然后
不能再分
D.随着科学的发展,人们发现原子组成中还存在更小的微粒,如夸克
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
2.原子的种类决定于原子的
A.原子量大小 B.核内质子数和中子数
C.最外层电子数 D.核电荷数
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 原子中质量数=质子数+中子数,原子不同,质量数不同,即质子数、中子数的和不同,所以原子的种类决定于原子的核内质子数和中子数。
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wüthrich等人为此获得了2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是
A.13C与15N有相同的中子数
B.13C与C60互为同素异形体
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 根据质量数(A)=质子数(Z)+中子数(N),可得13C、15N的中子数分别为7、8;同素异形体是由同一元素形成的不同单质;15N的核外电子数与中子数分别为7、8。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
5.科学工作者发现另一种“足球分子”N60,它的结构与C60相似。下列说法正确的是
A.N60和C60互为同素异形体
B.N60是一种新型化合物
C.N60和N2是同素异形体
D.N60和14N都是氮的同系物
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 N60和C60是不同元素组成的单质,所以不是同素异形体,故A错误;
N60中只含一种元素,所以是单质,故B错误;
N60和N2是N的不同单质,所以是同素异形体,故C正确;
N60是单质,14N是原子,所以不是同系物,且同系物多用于有机化合物,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
6.(2021·咸阳百灵学校高一月考)下列表达方式正确的是
A.用电子式表示HCl的形成过程:
B.质子数为17、中子数为20的氯原子:
C.HClO的结构式:H—O—Cl
D.NH4Cl的电子式:
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 HCl为共价化合物,用电子式表示其形成过程:H·+ ―→
,故A错误;
质子数为17、中子数为20的氯原子,其质量数为37,可表示为 ,故B错误;
HClO中O原子分别与H原子和Cl原子形成共价键,故其结构式为H—O—Cl,故C正确;
NH4Cl是由 和Cl-构成的离子化合物,其电子式为 ,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
题组二 物质结构与性质的关系
7.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知质子数或中子数为奇数的原子核才有NMR现象,而质子数和中子数均为偶数的原子不产生核磁共振,下列原子组一定能产生NMR现象的是
A.18O、31P、119Sn B.27Al、19F、12C
C.12C、32S、19F D.1H、13C、35Cl
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 A中18O的质子数为8、中子数为10,不符合题意;
B中12C的质子数和中子数均为6,不符合题意;
C中12C的质子数、中子数均为6,32S的质子数和中子数均为16,不符合题意;
D中1H质子数为1,13C中子数为7,35Cl中质子数为17,符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
8.(2021·浙江衢州高一期末)下列说法正确的是
A.H2O的沸点较高是因为水分子间存在较强的化学键
B.HCl气体溶于水后,共价键被破坏,形成了H+和Cl-
C.H2S分子中所有原子最外电子层都具有8电子的稳定结构
D.NaOH和MgCl2所含化学键类型完全相同
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 水的沸点较高是因为水分子间存在氢键,氢键是分子间作用力,不属于化学键,A错误;
氯化氢气体溶于水时,H—Cl共价键断裂,生成H+和Cl-,B正确;
H2S分子中H最外电子层上有2个电子,不具有8电子稳定结构,C错误;
NaOH含有离子键和共价键,MgCl2只含离子键,两者化学键类型不完全相同,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
9.已知下列数据:
碳原子核间距离/10-10 m 断裂碳碳键所需能量/(kJ·mol-1)
H3C—CH3 1.54 348
H2C==CH2 1.33 615
HC≡CH 1.20 812
下列事实可用上述数据解释的是
A.乙烯的熔、沸点比乙烷的低 B.乙炔在水中的溶解度比乙烯的大
C.乙炔燃烧时有浓烟产生 D.乙烯、乙炔都易发生加成反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 分子晶体的熔、沸点与分子间作用力有关,组成和结构相似的物质,相对分子质量越大,熔、沸点越高,与键长、键能无关,故A错误;
键长和键能与物质的溶解性无关,故B错误;
是否产生浓烟与含碳量有关,与键长、键能无关,故C错误;
乙烯和乙炔中的双键和三键并不是碳碳单键的加和,平均键能比碳碳单键的小,所以碳碳双键和碳碳三键易发生加成反应,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
10.碳纳米管是一种纳米尺度的、具有完整分子结构的新型材料,它是由一层碳原子卷曲而成的无缝、中空的管体,具有质轻、可弯曲、强度好、弹性强的特点。下列关于碳纳米管的可能用途不正确的是
A.用它可做成攀登月球的“太空天梯”
B.能解决室温下,低气压、高容量储存氢气的难题
C.作为优秀的绝缘材料
D.制成电脑芯片可大大提升计算机系统的计算能力
√
综合强化练
解析 碳纳米管由碳原子构成,能导电,不可作为绝缘材料。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
B.N60的发现开辟了能源世界的新天地,将来可能成为很好的火箭燃料
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
N60与C60结构相似,并在受热或机械撞击后,其中积蓄的巨大能量会在瞬间释放出来,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
12.NH3是一种重要的化工原料,在半导体光催化的作用下,N2分子被光催化材料捕获进而实现N2―→NH3的转化(过程如图)。下列说法错误的是
A.N2在光催化材料表面断开了N≡N键
B.该反应中,N2被还原
C.该反应过程中有旧化学键断裂和新化学键形成
D.该反应的类型是化合反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 由图知,N2在光催化材料表面断开了N≡N键,A正确;
该反应中,N2转变为氨气,氮元素化合价从0降低到-3,被还原,B正确;
该反应过程中N2、水参加反应,化学键断裂,生成氨气、氧气,化学键形成,有旧化学键断裂和新化学键形成,C正确;
由图知,反应中有氨气、氧气生成,则该反应的类型不可能是化合反应,D不正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13.据报道,科研人员应用电子计算机模拟出了类似C60的物质N60。已知N60分子中每个氮原子之间均以氮氮共价键结合三个氮原子,所有的氮原子都具有最外层为8个电子的稳定结构。N—N键键能为167 kJ·mol-1,N==N键键能为418 kJ·mol-1,N≡N键键能为942 kJ·mol-1。
试回答:
(1)根据键能和物质化学变化中的能量变化原理计算,1 mol N60全部分解为N2所吸收或放出的能量(热量)为________ kJ。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13 230
解析 1 mol N60分子含有90 mol N—N键,它分解生成30 mol N≡N键。1 mol N60分子中化学键拆开吸收的能量为90 mol×167 kJ·mol-1=15 030 kJ,30 mol N2分子中化学键的形成放出的能量为30 mol×942 kJ·mol-1=28 260 kJ。放出的总能量比吸收的总能量多13 230 kJ,化学反应是放热反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)根据(1)的计算结论推断,下列N60的用途正确的是_____(填字母)。
A.可用作高能炸药
B.可用作高能燃料
1
2
3
4
5
6
7
8
9
10
11
12
13
14
AB
解析 由于N60的分解放出大量的热,因此N60用作高能炸药和高能燃料都是可以的。
14.科学家正在设法探寻“反物质”。所谓“反物质”是由“反粒子”构成的,“反粒子”与其对应的正粒子具有相同的质量和相同的电量,但电荷符号相反。
(1)若有α粒子(即氦离子)的反粒子,称为反α粒子,则该粒子的质量数为____,电荷数为____,反α粒子的符号可表示为______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4
-2
He2-
(2)近几年,欧洲和美国的科学研究机构先后宣布,他们分别制出9个和7个反氢原子,这是人类探索反物质的一大进步。试推测反氢原子的构造是___(填字母)。
A.由一个带正电荷的质子与一个带负电荷的电子构成
B.由一个带负电荷的质子与一个带正电荷的电子构成
C.由一个不带电荷的中子与一个带负电荷的电子构成
D.由一个带负电荷的质子与一个带负电荷的电子构成
1
2
3
4
5
6
7
8
9
10
11
12
13
14
B
解析 所谓“反物质”,它的原子核是由反质子和反中子构成的,反质子的质量数为1,带负电荷,反中子的质量数也为1,不带电;核外是反电子,质量可忽略不计,带正电荷。正常的氢原子是由一个质子和一个电子构成的,反氢原子则是由一个反质子和一个反电子构成。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
返回
本课结束
