高中化学苏教版(2021) 选择性必修2 专题2 第二单元 微专题2 元素推断与元素周期律的综合应用(18张PPT)
文档属性
| 名称 | 高中化学苏教版(2021) 选择性必修2 专题2 第二单元 微专题2 元素推断与元素周期律的综合应用(18张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 576.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-19 22:36:32 | ||
图片预览






文档简介
(共18张PPT)
微专题2
元素推断与元素周期律的综合应用
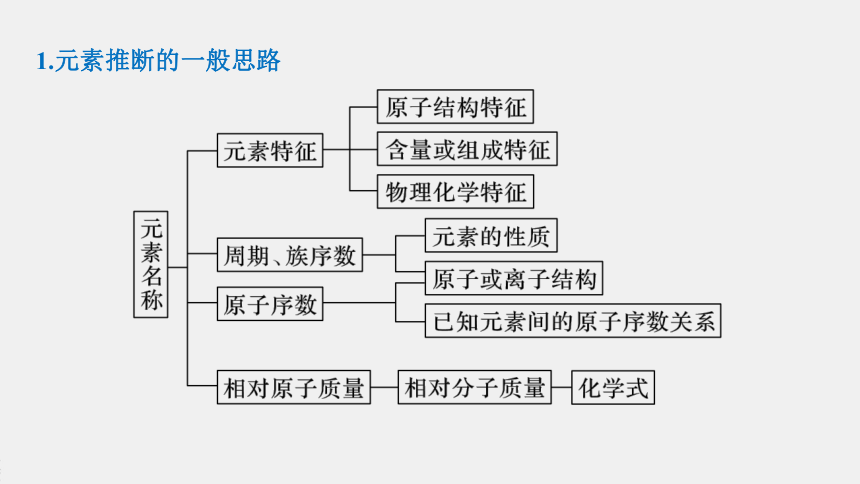
1.元素推断的一般思路
2.推断元素的常用方法
(1)利用稀有气体元素原子结构的特殊性。
(2)利用常见元素及化合物的特征性质。
3.由基态原子的外围电子排布确定元素在周期表中的位置
(1)周期序数=电子层数
(2)主族元素的族序数=外围电子数
(3)第ⅢB族~第ⅦB族的外围电子排布为(n-1)d1~5ns1~2(镧系、锕系除外),族序数=外围电子数。如锰的外围电子排布为3d54s2,它位于元素周期表中第4周期ⅦB族。
(4)第ⅠB族和第ⅡB族的外围电子排布为(n-1)d10ns1~2,族序数=ns能级上的电子数。
跟踪训练
1.元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的外围电子排布式为nsn-1npn+1,则下列说法不正确的是
A.Y元素原子的外围电子排布式为4s24p4
B.Y元素在元素周期表的第3周期ⅥA族
C.X元素所在周期中所含非金属元素最多
D.Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
1
2
3
4
5
X
Y
Z
√
解析 因为Y元素原子的外围电子排布式中出现了np轨道,故其ns轨道已经充满且只能为2个电子,则n-1=2,n=3,即Y元素原子的外围电子排布式为3s23p4,故A项错误、B项正确;
1
2
3
4
5
Y为S元素,X为F元素,第2周期所含非金属元素最多,故C项正确;
Z为As元素,核外电子排布式为1s22s22p63s23p63d104s24p3,故D项正确。
X
Y
Z
2.如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是
A.31d和33d属于同种核素
B.第一电离能:d>e,电负性:dC.气态氢化物的稳定性:a>d>e
D.a和b形成的化合物不可能含共价键
√
1
2
3
4
5
解析 短周期元素中,a为-2价,e为+6价,均处于第ⅥA族,可推知a为O,e为S,b有+1价,原子序数大于O,则b为Na,由原子序数可知d处于第3周期,化合价为+5,则d为P。31P和33P质子数相同,中子
1
2
3
4
5
数不同,是不同的核素,互为同位素,A错误;
同周期主族元素从左到右第一电离能增大,但是P原子3p轨道电子为半充满稳定状态,第一电离能较大,则第一电离能:P>S,电负性:P1
2
3
4
5
元素的非金属性越强,其气态氢化物的稳定性越强,则稳定性:H2O>H2S>PH3,C错误;
O和Na形成的化合物Na2O2中含有共价键,D错误。
3.[2020·新高考全国卷Ⅰ(山东),3]短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是
A.第一电离能:W>X>Y>Z
B.简单离子的还原性:Y>X>W
C.简单离子的半径:W>X>Y>Z
D.氢化物水溶液的酸性:Y>W
√
1
2
3
4
5
解析 根据短周期主族元素Z与X形成淡黄色化合物Z2X2,结合所学元素化合物知识推断Z2X2是Na2O2,则X是O元素,Z是Na元素。基态O原子的核外电子排布式是1s22s22p4,电子总数是8,最高能级电子数是4,符合题意。再根据Y、W最外层电子数相同,且主族元素X、Y、Z、W的原子序数依次增大,可以判断Y、W分别是F元素、Cl元素。同主族元素从上到下,第一电离能逐渐减小,同周期元素从左到右,第一电离能呈增大趋势,故第一电离能:F>Cl,F>O,A项错误;
元素电负性由大到小的顺序是F、O、Cl,则单质得电子能力由强到弱的顺序也是F、O、Cl,因此简单离子的还原性由强到弱的顺序是Cl、O、F,B项错误;
1
2
3
4
5
O、F、Na、Cl对应的简单离子中,Cl-电子层数最多,半径最大,O、F、Na对应的简单离子电子层数相同,原子序数越大,半径越小,故简单离子半径由大到小的顺序是Cl、O、F、Na,C项正确;
F、Cl对应的氢化物分别是HF和HCl,HCl是强酸,HF是弱酸,D项错误。
1
2
3
4
5
4.有A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第3周期第一电离能最小的元素;D元素在第3周期中电负性最大。
(1)试推断A、B、C、D四种元素的符号:
A.____,B.____,C.____,D.____。
(2)写出A元素原子的核外电子排布式:_________;用轨道表示式表示C
原子的核外电子排布情况:_______________________________。
O
Ca
Na
Cl
1s22s22p4
1
2
3
4
5
(3)比较四种元素的第一电离能和电负性的大小(写元素符号):
第一电离能:_______________;电负性:_______________。
1
2
3
4
5
Na<Ca<Cl<O
Na<Ca<Cl<O
解析 A是氧元素,B的电子排布式为1s22s22p63s23p64s2,是钙元素,C是钠元素,D是氯元素。
5.有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,A和E属同一族,它们原子最外层电子排布式为ns1;B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍;C原子最外层上电子数等于D原子最外层上电子数的一半。
请回答下列问题:
(1)A是____(填元素符号,下同),B是___,C是____,D是___,E是____。
(2)由这五种元素组成的一种化合物是________________(填化学式)。写出该物质的一种主要用途:_________。
H
O
Al
S
K
KAl(SO4)2·12H2O
作净水剂
1
2
3
4
5
(3)写出C元素基态原子的核外电子排布:_____________。
(4)用轨道表示式表示D元素原子的外围电子排布为__________________。
(5)元素B与D的电负性的大小关系是B______(填“>”“<”或“=”,下同)D,C与E的第一电离能的大小关系是C______E。
1
2
3
4
5
1s22s22p63s23p1
>
>
解析 A、B、C、D、E 5种元素的核电荷数都小于20,故都为主族元素。A、E属同一族且最外层电子排布式为ns1,故为第ⅠA族元素,而A为非金属元素,则A为氢;B、D为同一族,其原子最外层的p能级电子数是s能级电子数的两倍,故其最外层电子排布式为ns2np4,为第ⅥA族元素,B核电荷数小于D,则B为氧,D为硫,E为钾;C原子最外层上的电子数为硫原子最外层上电子数的一半,则C为铝;同主族元素自上而下电负性逐渐减小,故B(氧)的电负性大于D(硫),E(钾)的第一电离能小于钠,钠的第一电离能小于C(铝),故第一电离能:Al>K。
1
2
3
4
5
本课结束
微专题2
元素推断与元素周期律的综合应用
1.元素推断的一般思路
2.推断元素的常用方法
(1)利用稀有气体元素原子结构的特殊性。
(2)利用常见元素及化合物的特征性质。
3.由基态原子的外围电子排布确定元素在周期表中的位置
(1)周期序数=电子层数
(2)主族元素的族序数=外围电子数
(3)第ⅢB族~第ⅦB族的外围电子排布为(n-1)d1~5ns1~2(镧系、锕系除外),族序数=外围电子数。如锰的外围电子排布为3d54s2,它位于元素周期表中第4周期ⅦB族。
(4)第ⅠB族和第ⅡB族的外围电子排布为(n-1)d10ns1~2,族序数=ns能级上的电子数。
跟踪训练
1.元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的外围电子排布式为nsn-1npn+1,则下列说法不正确的是
A.Y元素原子的外围电子排布式为4s24p4
B.Y元素在元素周期表的第3周期ⅥA族
C.X元素所在周期中所含非金属元素最多
D.Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
1
2
3
4
5
X
Y
Z
√
解析 因为Y元素原子的外围电子排布式中出现了np轨道,故其ns轨道已经充满且只能为2个电子,则n-1=2,n=3,即Y元素原子的外围电子排布式为3s23p4,故A项错误、B项正确;
1
2
3
4
5
Y为S元素,X为F元素,第2周期所含非金属元素最多,故C项正确;
Z为As元素,核外电子排布式为1s22s22p63s23p63d104s24p3,故D项正确。
X
Y
Z
2.如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是
A.31d和33d属于同种核素
B.第一电离能:d>e,电负性:d
D.a和b形成的化合物不可能含共价键
√
1
2
3
4
5
解析 短周期元素中,a为-2价,e为+6价,均处于第ⅥA族,可推知a为O,e为S,b有+1价,原子序数大于O,则b为Na,由原子序数可知d处于第3周期,化合价为+5,则d为P。31P和33P质子数相同,中子
1
2
3
4
5
数不同,是不同的核素,互为同位素,A错误;
同周期主族元素从左到右第一电离能增大,但是P原子3p轨道电子为半充满稳定状态,第一电离能较大,则第一电离能:P>S,电负性:P
2
3
4
5
元素的非金属性越强,其气态氢化物的稳定性越强,则稳定性:H2O>H2S>PH3,C错误;
O和Na形成的化合物Na2O2中含有共价键,D错误。
3.[2020·新高考全国卷Ⅰ(山东),3]短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是
A.第一电离能:W>X>Y>Z
B.简单离子的还原性:Y>X>W
C.简单离子的半径:W>X>Y>Z
D.氢化物水溶液的酸性:Y>W
√
1
2
3
4
5
解析 根据短周期主族元素Z与X形成淡黄色化合物Z2X2,结合所学元素化合物知识推断Z2X2是Na2O2,则X是O元素,Z是Na元素。基态O原子的核外电子排布式是1s22s22p4,电子总数是8,最高能级电子数是4,符合题意。再根据Y、W最外层电子数相同,且主族元素X、Y、Z、W的原子序数依次增大,可以判断Y、W分别是F元素、Cl元素。同主族元素从上到下,第一电离能逐渐减小,同周期元素从左到右,第一电离能呈增大趋势,故第一电离能:F>Cl,F>O,A项错误;
元素电负性由大到小的顺序是F、O、Cl,则单质得电子能力由强到弱的顺序也是F、O、Cl,因此简单离子的还原性由强到弱的顺序是Cl、O、F,B项错误;
1
2
3
4
5
O、F、Na、Cl对应的简单离子中,Cl-电子层数最多,半径最大,O、F、Na对应的简单离子电子层数相同,原子序数越大,半径越小,故简单离子半径由大到小的顺序是Cl、O、F、Na,C项正确;
F、Cl对应的氢化物分别是HF和HCl,HCl是强酸,HF是弱酸,D项错误。
1
2
3
4
5
4.有A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第3周期第一电离能最小的元素;D元素在第3周期中电负性最大。
(1)试推断A、B、C、D四种元素的符号:
A.____,B.____,C.____,D.____。
(2)写出A元素原子的核外电子排布式:_________;用轨道表示式表示C
原子的核外电子排布情况:_______________________________。
O
Ca
Na
Cl
1s22s22p4
1
2
3
4
5
(3)比较四种元素的第一电离能和电负性的大小(写元素符号):
第一电离能:_______________;电负性:_______________。
1
2
3
4
5
Na<Ca<Cl<O
Na<Ca<Cl<O
解析 A是氧元素,B的电子排布式为1s22s22p63s23p64s2,是钙元素,C是钠元素,D是氯元素。
5.有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,A和E属同一族,它们原子最外层电子排布式为ns1;B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍;C原子最外层上电子数等于D原子最外层上电子数的一半。
请回答下列问题:
(1)A是____(填元素符号,下同),B是___,C是____,D是___,E是____。
(2)由这五种元素组成的一种化合物是________________(填化学式)。写出该物质的一种主要用途:_________。
H
O
Al
S
K
KAl(SO4)2·12H2O
作净水剂
1
2
3
4
5
(3)写出C元素基态原子的核外电子排布:_____________。
(4)用轨道表示式表示D元素原子的外围电子排布为__________________。
(5)元素B与D的电负性的大小关系是B______(填“>”“<”或“=”,下同)D,C与E的第一电离能的大小关系是C______E。
1
2
3
4
5
1s22s22p63s23p1
>
>
解析 A、B、C、D、E 5种元素的核电荷数都小于20,故都为主族元素。A、E属同一族且最外层电子排布式为ns1,故为第ⅠA族元素,而A为非金属元素,则A为氢;B、D为同一族,其原子最外层的p能级电子数是s能级电子数的两倍,故其最外层电子排布式为ns2np4,为第ⅥA族元素,B核电荷数小于D,则B为氧,D为硫,E为钾;C原子最外层上的电子数为硫原子最外层上电子数的一半,则C为铝;同主族元素自上而下电负性逐渐减小,故B(氧)的电负性大于D(硫),E(钾)的第一电离能小于钠,钠的第一电离能小于C(铝),故第一电离能:Al>K。
1
2
3
4
5
本课结束
