高中化学苏教版(2021) 选择性必修2 专题4 第一单元 第1课时 杂化轨道理论与分子空间结构(67张PPT)
文档属性
| 名称 | 高中化学苏教版(2021) 选择性必修2 专题4 第一单元 第1课时 杂化轨道理论与分子空间结构(67张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-19 23:52:37 | ||
图片预览










文档简介
(共67张PPT)
第1课时
杂化轨道理论与分子空间结构
核心素养发展目标
1.了解杂化轨道理论,能从微观角度理解中心原子的杂化轨道类型
对分子空间结构的影响。
2.通过对杂化轨道理论的学习,掌握中心原子杂化轨道类型的判断
方法,建立分子空间结构分析的思维模型。
随堂演练
知识落实
课时
对点练
内容索引
一、杂化轨道及其理论要点
二、用杂化轨道理论解释分子的形成及分子中的成键情况
一、杂化轨道及其理论要点
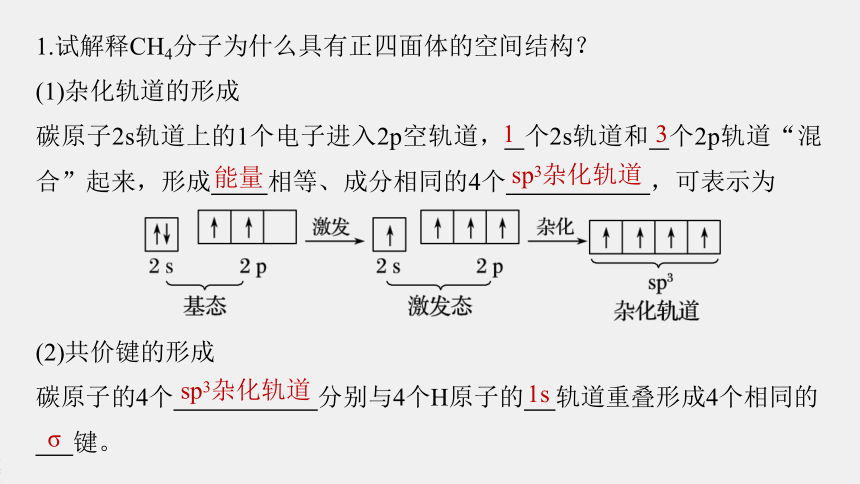
1.试解释CH4分子为什么具有正四面体的空间结构?
(1)杂化轨道的形成
碳原子2s轨道上的1个电子进入2p空轨道, 个2s轨道和 个2p轨道“混合”起来,形成 相等、成分相同的4个 ,可表示为
1
3
能量
sp3杂化轨道
(2)共价键的形成
碳原子的4个 分别与4个H原子的 轨道重叠形成4个相同的
键。
sp3杂化轨道
1s
σ
(3)CH4分子的空间结构
甲烷分子中的4个C—H键是等同的,C—H键之间的夹角——键角都是
,形成正四面体型分子。
109°28′
2.轨道杂化与杂化轨道
(1)轨道的杂化:在外界条件影响下,原子内部能量 的原子轨道重新组合形成一组新轨道的过程叫做原子轨道的杂化。
(2)杂化轨道:重新组合后的新的原子轨道,叫做杂化原子轨道,简称杂化轨道。
(3)轨道杂化的过程: → → 。
相近
激发
激发
轨道重叠
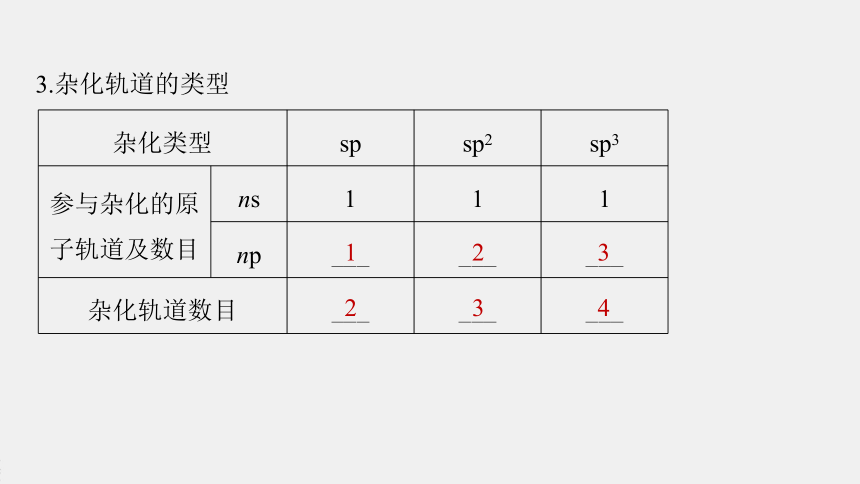
3.杂化轨道的类型
杂化类型 sp sp2 sp3
参与杂化的原 子轨道及数目 ns 1 1 1
np ___ ___ ___
杂化轨道数目 ___ ___ ___
1
2
3
2
3
4
深度思考
1.正误判断,正确的打“√”,错误的打“×”
(1)发生轨道杂化的原子一定是中心原子( )
(2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的( )
(3)只有能量相近的轨道才能杂化( )
√
√
√
2.常见的杂化轨道类型有哪些?什么是sp3杂化?
提示 常见的杂化轨道类型有sp、sp2、sp3。同一原子内由1个ns轨道和3个np轨道参与的杂化称为sp3杂化。
应用体验
1.下列关于杂化轨道的说法错误的是
A.所有原子轨道都参与杂化形成杂化轨道
B.同一原子中能量相近的原子轨道参与杂化
C.杂化轨道能量集中,有利于牢固成键
D.杂化轨道中不一定有一个电子
√
解析 参与杂化的原子轨道,其能量不能相差太大,如1s轨道与2s、2p轨道能量相差太大,不能形成杂化轨道,即只有能量相近的原子轨道才能参与杂化,故A项错误、B项正确;
杂化轨道的电子云一头大一头小,成键时利用大的一头,可使电子云重叠程度更大,形成牢固的化学键,故C项正确;
并不是所有的杂化轨道中都会有电子,也可以是空轨道,也可以有一对孤电子对(如NH3),故D项正确。
2.下列有关sp2杂化轨道的说法错误的是
A.由同一电子层上的s轨道与p轨道杂化而成
B.共有3个能量相同的杂化轨道
C.每个sp2杂化轨道中s轨道成分占三分之一
D.sp2杂化轨道最多可形成2个σ键
√
解析 同一电子层上s轨道与p轨道的能量差异不是很大,相互杂化的轨道的能量差异也不能过大,A项正确;
同种类型的杂化轨道能量相同,B项正确;
sp2杂化轨道是由一个s轨道与2个p轨道杂化而成的,C项正确;
sp2杂化轨道最多可形成3个σ键,D项错误。
归纳总结
杂化轨道理论的要点
(1)原子形成分子时,通常存在激发、杂化和轨道重叠等过程。发生轨道杂化的原子一定是中心原子。
(2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的。
(3)只有能量相近的轨道才能杂化(如2s、2p)。
(4)杂化前后原子轨道数目不变(参加杂化的轨道数目等于形成的杂化轨道数目),且杂化轨道的能量相同。
(5)杂化轨道成键时要满足化学键间最小排斥原理,使轨道在空间取得最大夹角分布。故杂化后轨道的伸展方向、形状发生改变,但杂化轨道的形状完全相同。
返回
二、用杂化轨道理论解释分子的形成及分子中的成键情况
1.用杂化轨道理论解释BeCl2、BF3分子的形成
(1)BeCl2分子的形成
杂化后的2个sp杂化轨道分别与氯原子的3p轨道发生重叠,形成2个σ键,构成直线形的BeCl2分子。
(2)BF3分子的形成
2.用杂化轨道理论解释乙烯、乙炔分子中的成键情况
(1)乙烯分子中的成键情况
在乙烯分子中,C原子采取 杂化,形成3个杂化轨道,两个碳原子各以1个杂化轨道互相重叠,形成1个C—C σ键,每个C原子的另外两个杂化轨道分别与2个氢原子的1s轨道重叠,形成2个C—H σ键,这样形成的5个键在同一平面上,此外每个C原子还剩下1个未杂化的2p轨道,它们发生重叠,形成1个 键。其结构示意图如下:
sp2
π
(2)乙炔分子中的成键情况
在乙炔分子中,碳原子采取 杂化,形成2个杂化轨道,两个碳原子各以1个杂化轨道互相重叠,形成1个C—C σ键,每一个碳原子又各以1个杂化轨道分别与1个氢原子形成C—H σ键,这样形成的3个键在同一直线上,此外每个碳原子还有2个未杂化的2p轨道,它们发生重叠,形成2个
键。其结构示意图如下:
sp
π
归纳总结
杂化轨道的类型与分子空间结构的关系
杂化类型 sp sp2 sp3
杂化轨道间的夹角 180° 120° 109°28′
空间结构 直线形 平面三角形 正四面体型
实例 BeCl2、CO2、CS2等 BCl3、BF3、BBr3等 CF4、SiCl4、SiH4等
特别提醒 杂化轨道只能形成σ键,不能形成π键。
(1)杂化轨道与参与杂化的原子轨道的数目相同,但能量不同( )
(2)杂化轨道的键角与分子内的键角不一定相同( )
(3)只要分子的空间结构为平面三角形,中心原子均为sp2杂化( )
(4)杂化方式相同的分子,空间结构一定相同( )
正误判断
√
√
√
×
应用体验
1.有关杂化轨道的说法不正确的是
A.杂化前后的轨道数不变,但轨道的形状发生了改变
B.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
C.杂化轨道既可形成σ键,又可形成π键
D.已知CO2为直线形分子,其分子结构可以用sp杂化轨道解释
√
解析 杂化前后的轨道数不变,杂化后,各个轨道尽可能分散、对称分布,导致轨道的形状发生了改变,A正确;
sp3、sp2、sp杂化轨道其空间结构分别是正四面体型、平面三角形、直线形,所以其夹角分别为109°28′、120°、180°,B正确;
杂化轨道只能形成σ键,C错误;
直线形分子的键角为180°,中心原子的杂化方式是sp,D正确。
A.sp、sp2、sp3 B.sp3、sp2、sp
C.sp2、sp、sp3 D.sp3、sp、sp2
√
3.在 中,中间的碳原子和两边的碳原子分别采用的杂化方式是
A.sp2、sp2 B.sp3、sp3
C.sp2、sp3 D.sp、sp3
√
解析 杂化轨道数=中心原子上的孤电子对数+中心原子的σ键个数。中间的碳原子上的孤电子对数为0,σ键个数为3,则杂化方式是sp2杂化;两边的碳原子上的孤电子对数为0,σ键个数为4,则杂化方式是sp3。
方法规律——中心原子杂化类型的判断方法
(1)根据杂化轨道之间的夹角判断:若杂化轨道之间的夹角为109°28′,则中心原子发生sp3杂化;若杂化轨道之间的夹角为120°,则中心原子发生sp2杂化;若杂化轨道之间的夹角为180°,则中心原子发生sp杂化。
(2)有机物中碳原子杂化类型的判断:饱和碳原子采取sp3杂化,连接双键的碳原子采取sp2杂化,连接三键的碳原子采取sp杂化。
返回
随堂演练 知识落实
1.鲍林是两位获得诺贝尔奖不同奖项的人之一,杂化轨道是鲍林为了解释分子的空间结构提出的。下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是
A.sp杂化轨道的夹角最大
B.sp2杂化轨道的夹角最大
C.sp3杂化轨道的夹角最大
D.sp3、sp2、sp杂化轨道的夹角相等
√
解析 sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°,故A项正确。
1
2
3
4
5
2.下列有关sp杂化轨道的叙述正确的是
A.是由一个1s轨道和一个2p轨道线性组合而成
B.sp杂化轨道中的两个杂化轨道完全相同
C.sp杂化轨道可与其他原子轨道形成σ键和π键
D.sp杂化轨道有两个,一个能量高,另一个能量低
√
1
2
3
4
5
解析 sp杂化轨道是同一原子内同一电子层,能量相近的轨道发生的杂化,A项错误;
不同类型能量相近的原子轨道混合起来,重新组合成一组新的轨道,所形成两个能量等同的sp杂化轨道,B项正确、D项错误;
杂化轨道用于形成σ键,未杂化的轨道形成π键,不是杂化轨道形成π键,C项错误。
1
2
3
4
5
3.乙烯分子中含有4个C—H键和1个C==C键,6个原子在同一平面上。下列关于乙烯分子的成键情况分析正确的是
①每个C原子的2s轨道与2p轨道杂化,形成两个sp杂化轨道 ②每个C原子的2s轨道与2个2p轨道杂化,形成3个sp2杂化轨道 ③每个C原子的2s轨道与3个2p轨道杂化,形成4个sp3杂化轨道 ④每个C原子的3个外围电子占据3个杂化轨道,1个外围电子占据1个2p轨道
A.①③ B.②④ C.①④ D.②③
√
解析 乙烯分子中键角为120°,为sp2杂化,形成3个sp2杂化轨道,1个外围电子占据1个2p轨道,2个C原子成键时形成1个π键,②④正确。
1
2
3
4
5
4.在乙炔分子中有3个σ键、2个π键,它们分别是
A.sp杂化轨道形成σ键、未杂化的2个2p轨道形成2个π键,且互相垂直
B.sp杂化轨道形成σ键、未杂化的2个2p轨道形成2个π键,且互相平行
C.C—H键之间是sp杂化轨道形成的σ键,C—C键之间是未参加杂化的2p
轨道形成的π键
D.C—C键之间是sp杂化轨道形成的σ键,C—H键之间是未参加杂化的2p
轨道形成的π键
√
1
2
3
4
5
解析 碳原子形成乙炔时,一个2s轨道和一个2p轨道杂化成两个sp轨道,另外的两个2p轨道保持不变,其中一个sp轨道与氢原子的1s轨道“头碰头”重叠形成C—Hσ键,另一个sp轨道则与另一个碳原子的sp轨道“头碰头”重叠形成C—C σ键,碳原子剩下的两个2p轨道则“肩并肩”重叠形成两个C—C π键,且这两个π键互相垂直。
1
2
3
4
5
5.石墨烯(图甲)是一种由单层碳原子构成的平面结构新型材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。
(1)图甲中,1号C与相邻C形成σ键的个数为___。
3
解析 图甲中,1号C与相邻的3个C形成1个碳碳双键和2个碳碳单键,即形成3个σ键和1个π键。
1
2
3
4
5
(2)图乙中,1号C的杂化方式是____,该C与相邻C形成的键角___(填“>”“<”或“=”)图甲中1号C 与相邻C形成的键角。
sp3
<
解析 图乙中,1号C除与3个C形成化学键外,还与羟基氧原子形成化学键,故该C原子采取sp3杂化。
1
2
3
4
5
返回
课 时 对 点 练
基础对点练
题组一 原子轨道杂化与杂化轨道
1.下列说法错误的是
A.第ⅠA族元素成键时不可能有杂化轨道
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和1个C原子的2p轨道
混合起来而形成的
C.孤电子对有可能参加杂化
D.s轨道和p轨道杂化不可能有sp4出现
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 第ⅠA族元素的外围电子排布式为ns1,由于只有1个ns电子,因此不可能形成杂化轨道;H2O分子中的氧原子采取sp3杂化,其sp3杂化轨道有2个是由孤电子对占据的,所以孤电子对有可能参加杂化;由于np能级只有3个原子轨道,所以s轨道和p轨道杂化只有sp3、sp2、sp 3种,不可能出现sp4杂化。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2.氨气分子空间结构是三角锥型,而甲烷是正四面体型,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3
杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化
轨道
C.NH3分子中有一对未成键的孤电子对,它对成键电子对的排斥作用较强
D.氨气的相对分子质量大于甲烷
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 本题考查分子空间结构的判断。NH3中N原子形成3个σ键,有一对未成键的孤电子对,杂化轨道数为4,采取sp3杂化,孤电子对对成键电子对的排斥作用较强,N—H键之间的键角小于109°28′,所以氨气分子空间结构是三角锥型;CH4分子中C原子采取sp3杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,C—H键之间的键角相等为109°28′,故CH4的空间结构为正四面体型,故A、B、D错误,C正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
3.下列有关杂化轨道的说法不正确的是
A.原子中能量相近的某些轨道,在成键时,能重新组合成能量相等的新
轨道
B.轨道数目杂化前后可以相等,也可以不等
C.杂化轨道成键时,要满足原子轨道最大重叠原理、能量最低原理
D.CH4分子中任意两个C—H键的夹角均为109°28′
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 原子轨道形成杂化轨道前后,轨道数目不变化,用于形成杂化轨道的原子轨道的能量相近,并满足最大重叠程度,故选B。
题组二 杂化类型的判断
4.BF3是典型的平面三角形分子,它溶于氢氟酸或NaF溶液中都形成 ,则BF3和 中B原子的杂化轨道类型分别是
A.sp2、sp2 B.sp3、sp3
C.sp2、sp3 D.sp、sp2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
5.甲烷中的碳原子是sp3杂化,下列用*表示的碳原子的杂化和甲烷中的碳原子杂化类型一致的是
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 D项中用*表示的碳原子形成了四个σ键,与甲烷类似,其为sp3杂化。
6.下列分子或离子中,不存在sp3杂化的是
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
B项,NH3中N原子采取sp3杂化,错误;
C项,C2H6中C原子采取sp3杂化,错误;
D项,SO2中S原子采取sp2杂化,正确。
C.甲醛[ ] D.丙炔[ ]
7.下列分子所含原子中,既有sp3杂化,又有sp2杂化的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.乙醛[ ] B.丙烯腈[ ]
√
解析 乙醛中甲基的碳原子采取sp3杂化,醛基中碳原子采取sp2杂化;丙烯腈中碳碳双键的两个碳原子采取sp2杂化,另一个碳原子采取sp杂化;甲醛中碳原子采取sp2杂化;丙炔中甲基碳原子采取sp3杂化,碳碳三键中两个碳原子采取sp杂化。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
8.下列分子中的中心原子为sp杂化,分子的空间结构为直线形,且分子中没有形成π键的是
A.CH≡CH B.CO2 C.BeCl2 D.BBr3
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 CH≡CH和CO2中的C原子均采取sp杂化,且都含有π键;
BeCl2分子中Be采取sp杂化,没形成π键;
BBr3中B原子采取sp2杂化,且没有π键。
题组三 杂化轨道理论的应用
9.形成下列分子时,中心原子采用sp3杂化轨道和另一个原子的p轨道成键的是
①PF3 ②CF4 ③NH3 ④H2O
A.①② B.②③ C.③④ D.①④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 PF3、CF4、NH3、H2O分子中P原子、C原子、N原子、O原子都采取sp3杂化,NH3和H2O分子中H原子以1s轨道与N和O原子形成σ键,PF3和CF4分子中F原子以2p轨道分别与P和C原子形成σ键。
10.(2020·兰州高二月考)sp3杂化形成的AB4型分子的空间结构是
A.平面四边形 B.正四面体型
C.三角锥型 D.平面三角形
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.氮的最高价氧化物为无色晶体,它由 和 构成,已知其阴离子结构为平面三角形,阳离子中氮的杂化方式为sp,则其阳离子的结构和阴离子中氮的杂化方式为
A.直线形 sp2 B.V形 sp
C.平面三角形 sp2 D.平面三角形 sp3
√
综合强化练
解析 结构为平面三角形,其中氮原子的杂化方式为sp2;
中氮的杂化方式为sp,结构为直线形。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
12.化合物A是一种新型锅炉水除氧剂,其结构式如图所示:
,下列说法正确的是
A.碳、氮原子的杂化类型相同
B.氮原子与碳原子分别为sp3杂化与sp2杂化
C.1 mol A分子中所含σ键的数目为10NA
D.编号为a的氮原子和与其成键的另外三个原子在同一平面内
√
解析 A分子中碳、氮原子各形成了3个σ键,氮原子有一对孤电子对而碳原子没有,故氮原子是sp3杂化而碳原子是sp2杂化,A项错误、B项正确;
A分子中有一个碳氧双键,故有12对共用电子对、11个σ键,C项错误;
氮原子为sp3杂化,相应的四个原子形成的是三角锥型结构,不可能共平面,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.白磷是一种能自燃的单质,其分子的结构模型如图所示: ,下列叙述错误的是
A.每个磷原子形成3个σ键,磷原子为sp2杂化
B.磷原子均为sp3杂化
C.1 mol白磷中共含6 mol非极性键
D.白磷分子的空间结构为正四面体型
√
解析 由白磷分子的结构模型图可知,每个磷原子均形成了3个σ键,且每个磷原子还有一对孤电子对,故磷原子为sp3杂化,A项错误、B项正确;
由图可知C、D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
14.如图是甲醛分子的结构模型,根据该图和所学化学知识回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(1)甲醛分子中碳原子的杂化方式是____,作出该判断的主要理由是____
__________________________。
sp2
甲醛
分子的空间结构为平面三角形
解析 原子的杂化轨道类型不同,分子的空间结构也不同。由图可知,甲醛分子为平面三角形,所以甲醛分子中的碳原子采取sp2杂化。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是______(填序号)。
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
②⑤
解析 醛类分子中都含有C==O键,所以甲醛分子中的碳氧键是双键。一般来说,双键是σ键和π键的组合。
(3)甲醛分子中C—H键与C—H键之间的夹角___(填“=”“>”或“<”)
120°,出现该现象的主要原因是_________________________________
_____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 由于碳氧双键中存在π键,它对C—H键的排斥作用较强,所以甲醛分子中C—H键与C—H键间的夹角小于120°。
<
碳氧双键中存在π键,它对C—H键的
排斥作用较强
15.2001年是伟大的化学家、1954年诺贝尔化学奖得主、著名的化学结构大师、20世纪的科学怪杰鲍林(L.C.Pauling)教授的诞辰100周年。1994年这位老人谢世后,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中一个结构式如图所示。老人为什么画这个结构式?它能合成吗?
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
它有什么性质?不得而知。这是鲍林留给世人的一个谜,也许这是永远无法解开的谜,也许有朝一日你就能解开它。不管结果如何,让我们先对这个结构作一番了解。
(1)它的分子式是____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C6H2O2N10
解析 根据有机物分子结构简式的书写规则,不难确定,每个环上除3个氮原子外还有3个碳原子,由此可以确定其分子式。
(2)它是否带有电荷?____(填“是”或“否”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
否
解析 由电子数可以确定,该分子不带电荷。
(3)该分子中为sp杂化的氮原子有___个;sp2杂化的氮原子有___个;sp3杂化的氮原子有___个。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
解析 根据氮原子的成键特征和结构可以确定,采取sp2杂化方式的氮原子数为9个,采取sp杂化方式的氮原子数为1个,无sp3杂化方式。
9
0
(4)为什么人们推测它是炸药?_______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
它分解能产生大量很稳定的气体N2
16.“三鹿奶粉事件”在社会上引起了人们对食品质量的恐慌,三鹿奶粉中掺杂了被称为“蛋白精”的工业原料三聚氰胺。已知三聚氰胺的结构简式如图所示。三聚氰胺是氰胺(H2N—C≡N)的三聚体,请回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(1)写出基态碳原子的电子排布式:________。
1s22s22p2
(2)氰胺中—C≡N中的氮原子、三聚氰胺环状结构中的氮原子和氨基中的氮原子,这三种氮原子的杂化轨道类型分别是____、____、____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 氰胺中—C≡N中的N原子、三聚氰胺环上的N原子、—NH2中的N原子分别形成1、2、3个σ键且均有一对未成键电子对,所以分别采取sp、sp2、sp3杂化。
sp
sp2
sp3
(3)一个三聚氰胺分子中有____个σ键。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 除每个双键上有1个π键外,其余均为σ键,共15个。
15
(4)三聚氰胺与三聚氰酸( )分子相互之间通过氢键结合,在肾
脏内易形成结石。三聚氰酸分子中C原子采取____杂化。该分子的结构简式中,每个碳氧原子之间的共价键是___(填字母)。
A.2个σ键 B.2个π键 C.1个σ键、1个π键
sp2
C
解析 由于该分子中C与O形成双键,则应采取sp2方式成键,sp2杂化的C原子与氧原子间有1个σ键、1个π键。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
返回
本课结束
第1课时
杂化轨道理论与分子空间结构
核心素养发展目标
1.了解杂化轨道理论,能从微观角度理解中心原子的杂化轨道类型
对分子空间结构的影响。
2.通过对杂化轨道理论的学习,掌握中心原子杂化轨道类型的判断
方法,建立分子空间结构分析的思维模型。
随堂演练
知识落实
课时
对点练
内容索引
一、杂化轨道及其理论要点
二、用杂化轨道理论解释分子的形成及分子中的成键情况
一、杂化轨道及其理论要点
1.试解释CH4分子为什么具有正四面体的空间结构?
(1)杂化轨道的形成
碳原子2s轨道上的1个电子进入2p空轨道, 个2s轨道和 个2p轨道“混合”起来,形成 相等、成分相同的4个 ,可表示为
1
3
能量
sp3杂化轨道
(2)共价键的形成
碳原子的4个 分别与4个H原子的 轨道重叠形成4个相同的
键。
sp3杂化轨道
1s
σ
(3)CH4分子的空间结构
甲烷分子中的4个C—H键是等同的,C—H键之间的夹角——键角都是
,形成正四面体型分子。
109°28′
2.轨道杂化与杂化轨道
(1)轨道的杂化:在外界条件影响下,原子内部能量 的原子轨道重新组合形成一组新轨道的过程叫做原子轨道的杂化。
(2)杂化轨道:重新组合后的新的原子轨道,叫做杂化原子轨道,简称杂化轨道。
(3)轨道杂化的过程: → → 。
相近
激发
激发
轨道重叠
3.杂化轨道的类型
杂化类型 sp sp2 sp3
参与杂化的原 子轨道及数目 ns 1 1 1
np ___ ___ ___
杂化轨道数目 ___ ___ ___
1
2
3
2
3
4
深度思考
1.正误判断,正确的打“√”,错误的打“×”
(1)发生轨道杂化的原子一定是中心原子( )
(2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的( )
(3)只有能量相近的轨道才能杂化( )
√
√
√
2.常见的杂化轨道类型有哪些?什么是sp3杂化?
提示 常见的杂化轨道类型有sp、sp2、sp3。同一原子内由1个ns轨道和3个np轨道参与的杂化称为sp3杂化。
应用体验
1.下列关于杂化轨道的说法错误的是
A.所有原子轨道都参与杂化形成杂化轨道
B.同一原子中能量相近的原子轨道参与杂化
C.杂化轨道能量集中,有利于牢固成键
D.杂化轨道中不一定有一个电子
√
解析 参与杂化的原子轨道,其能量不能相差太大,如1s轨道与2s、2p轨道能量相差太大,不能形成杂化轨道,即只有能量相近的原子轨道才能参与杂化,故A项错误、B项正确;
杂化轨道的电子云一头大一头小,成键时利用大的一头,可使电子云重叠程度更大,形成牢固的化学键,故C项正确;
并不是所有的杂化轨道中都会有电子,也可以是空轨道,也可以有一对孤电子对(如NH3),故D项正确。
2.下列有关sp2杂化轨道的说法错误的是
A.由同一电子层上的s轨道与p轨道杂化而成
B.共有3个能量相同的杂化轨道
C.每个sp2杂化轨道中s轨道成分占三分之一
D.sp2杂化轨道最多可形成2个σ键
√
解析 同一电子层上s轨道与p轨道的能量差异不是很大,相互杂化的轨道的能量差异也不能过大,A项正确;
同种类型的杂化轨道能量相同,B项正确;
sp2杂化轨道是由一个s轨道与2个p轨道杂化而成的,C项正确;
sp2杂化轨道最多可形成3个σ键,D项错误。
归纳总结
杂化轨道理论的要点
(1)原子形成分子时,通常存在激发、杂化和轨道重叠等过程。发生轨道杂化的原子一定是中心原子。
(2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的。
(3)只有能量相近的轨道才能杂化(如2s、2p)。
(4)杂化前后原子轨道数目不变(参加杂化的轨道数目等于形成的杂化轨道数目),且杂化轨道的能量相同。
(5)杂化轨道成键时要满足化学键间最小排斥原理,使轨道在空间取得最大夹角分布。故杂化后轨道的伸展方向、形状发生改变,但杂化轨道的形状完全相同。
返回
二、用杂化轨道理论解释分子的形成及分子中的成键情况
1.用杂化轨道理论解释BeCl2、BF3分子的形成
(1)BeCl2分子的形成
杂化后的2个sp杂化轨道分别与氯原子的3p轨道发生重叠,形成2个σ键,构成直线形的BeCl2分子。
(2)BF3分子的形成
2.用杂化轨道理论解释乙烯、乙炔分子中的成键情况
(1)乙烯分子中的成键情况
在乙烯分子中,C原子采取 杂化,形成3个杂化轨道,两个碳原子各以1个杂化轨道互相重叠,形成1个C—C σ键,每个C原子的另外两个杂化轨道分别与2个氢原子的1s轨道重叠,形成2个C—H σ键,这样形成的5个键在同一平面上,此外每个C原子还剩下1个未杂化的2p轨道,它们发生重叠,形成1个 键。其结构示意图如下:
sp2
π
(2)乙炔分子中的成键情况
在乙炔分子中,碳原子采取 杂化,形成2个杂化轨道,两个碳原子各以1个杂化轨道互相重叠,形成1个C—C σ键,每一个碳原子又各以1个杂化轨道分别与1个氢原子形成C—H σ键,这样形成的3个键在同一直线上,此外每个碳原子还有2个未杂化的2p轨道,它们发生重叠,形成2个
键。其结构示意图如下:
sp
π
归纳总结
杂化轨道的类型与分子空间结构的关系
杂化类型 sp sp2 sp3
杂化轨道间的夹角 180° 120° 109°28′
空间结构 直线形 平面三角形 正四面体型
实例 BeCl2、CO2、CS2等 BCl3、BF3、BBr3等 CF4、SiCl4、SiH4等
特别提醒 杂化轨道只能形成σ键,不能形成π键。
(1)杂化轨道与参与杂化的原子轨道的数目相同,但能量不同( )
(2)杂化轨道的键角与分子内的键角不一定相同( )
(3)只要分子的空间结构为平面三角形,中心原子均为sp2杂化( )
(4)杂化方式相同的分子,空间结构一定相同( )
正误判断
√
√
√
×
应用体验
1.有关杂化轨道的说法不正确的是
A.杂化前后的轨道数不变,但轨道的形状发生了改变
B.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
C.杂化轨道既可形成σ键,又可形成π键
D.已知CO2为直线形分子,其分子结构可以用sp杂化轨道解释
√
解析 杂化前后的轨道数不变,杂化后,各个轨道尽可能分散、对称分布,导致轨道的形状发生了改变,A正确;
sp3、sp2、sp杂化轨道其空间结构分别是正四面体型、平面三角形、直线形,所以其夹角分别为109°28′、120°、180°,B正确;
杂化轨道只能形成σ键,C错误;
直线形分子的键角为180°,中心原子的杂化方式是sp,D正确。
A.sp、sp2、sp3 B.sp3、sp2、sp
C.sp2、sp、sp3 D.sp3、sp、sp2
√
3.在 中,中间的碳原子和两边的碳原子分别采用的杂化方式是
A.sp2、sp2 B.sp3、sp3
C.sp2、sp3 D.sp、sp3
√
解析 杂化轨道数=中心原子上的孤电子对数+中心原子的σ键个数。中间的碳原子上的孤电子对数为0,σ键个数为3,则杂化方式是sp2杂化;两边的碳原子上的孤电子对数为0,σ键个数为4,则杂化方式是sp3。
方法规律——中心原子杂化类型的判断方法
(1)根据杂化轨道之间的夹角判断:若杂化轨道之间的夹角为109°28′,则中心原子发生sp3杂化;若杂化轨道之间的夹角为120°,则中心原子发生sp2杂化;若杂化轨道之间的夹角为180°,则中心原子发生sp杂化。
(2)有机物中碳原子杂化类型的判断:饱和碳原子采取sp3杂化,连接双键的碳原子采取sp2杂化,连接三键的碳原子采取sp杂化。
返回
随堂演练 知识落实
1.鲍林是两位获得诺贝尔奖不同奖项的人之一,杂化轨道是鲍林为了解释分子的空间结构提出的。下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是
A.sp杂化轨道的夹角最大
B.sp2杂化轨道的夹角最大
C.sp3杂化轨道的夹角最大
D.sp3、sp2、sp杂化轨道的夹角相等
√
解析 sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°,故A项正确。
1
2
3
4
5
2.下列有关sp杂化轨道的叙述正确的是
A.是由一个1s轨道和一个2p轨道线性组合而成
B.sp杂化轨道中的两个杂化轨道完全相同
C.sp杂化轨道可与其他原子轨道形成σ键和π键
D.sp杂化轨道有两个,一个能量高,另一个能量低
√
1
2
3
4
5
解析 sp杂化轨道是同一原子内同一电子层,能量相近的轨道发生的杂化,A项错误;
不同类型能量相近的原子轨道混合起来,重新组合成一组新的轨道,所形成两个能量等同的sp杂化轨道,B项正确、D项错误;
杂化轨道用于形成σ键,未杂化的轨道形成π键,不是杂化轨道形成π键,C项错误。
1
2
3
4
5
3.乙烯分子中含有4个C—H键和1个C==C键,6个原子在同一平面上。下列关于乙烯分子的成键情况分析正确的是
①每个C原子的2s轨道与2p轨道杂化,形成两个sp杂化轨道 ②每个C原子的2s轨道与2个2p轨道杂化,形成3个sp2杂化轨道 ③每个C原子的2s轨道与3个2p轨道杂化,形成4个sp3杂化轨道 ④每个C原子的3个外围电子占据3个杂化轨道,1个外围电子占据1个2p轨道
A.①③ B.②④ C.①④ D.②③
√
解析 乙烯分子中键角为120°,为sp2杂化,形成3个sp2杂化轨道,1个外围电子占据1个2p轨道,2个C原子成键时形成1个π键,②④正确。
1
2
3
4
5
4.在乙炔分子中有3个σ键、2个π键,它们分别是
A.sp杂化轨道形成σ键、未杂化的2个2p轨道形成2个π键,且互相垂直
B.sp杂化轨道形成σ键、未杂化的2个2p轨道形成2个π键,且互相平行
C.C—H键之间是sp杂化轨道形成的σ键,C—C键之间是未参加杂化的2p
轨道形成的π键
D.C—C键之间是sp杂化轨道形成的σ键,C—H键之间是未参加杂化的2p
轨道形成的π键
√
1
2
3
4
5
解析 碳原子形成乙炔时,一个2s轨道和一个2p轨道杂化成两个sp轨道,另外的两个2p轨道保持不变,其中一个sp轨道与氢原子的1s轨道“头碰头”重叠形成C—Hσ键,另一个sp轨道则与另一个碳原子的sp轨道“头碰头”重叠形成C—C σ键,碳原子剩下的两个2p轨道则“肩并肩”重叠形成两个C—C π键,且这两个π键互相垂直。
1
2
3
4
5
5.石墨烯(图甲)是一种由单层碳原子构成的平面结构新型材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。
(1)图甲中,1号C与相邻C形成σ键的个数为___。
3
解析 图甲中,1号C与相邻的3个C形成1个碳碳双键和2个碳碳单键,即形成3个σ键和1个π键。
1
2
3
4
5
(2)图乙中,1号C的杂化方式是____,该C与相邻C形成的键角___(填“>”“<”或“=”)图甲中1号C 与相邻C形成的键角。
sp3
<
解析 图乙中,1号C除与3个C形成化学键外,还与羟基氧原子形成化学键,故该C原子采取sp3杂化。
1
2
3
4
5
返回
课 时 对 点 练
基础对点练
题组一 原子轨道杂化与杂化轨道
1.下列说法错误的是
A.第ⅠA族元素成键时不可能有杂化轨道
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和1个C原子的2p轨道
混合起来而形成的
C.孤电子对有可能参加杂化
D.s轨道和p轨道杂化不可能有sp4出现
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 第ⅠA族元素的外围电子排布式为ns1,由于只有1个ns电子,因此不可能形成杂化轨道;H2O分子中的氧原子采取sp3杂化,其sp3杂化轨道有2个是由孤电子对占据的,所以孤电子对有可能参加杂化;由于np能级只有3个原子轨道,所以s轨道和p轨道杂化只有sp3、sp2、sp 3种,不可能出现sp4杂化。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2.氨气分子空间结构是三角锥型,而甲烷是正四面体型,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3
杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化
轨道
C.NH3分子中有一对未成键的孤电子对,它对成键电子对的排斥作用较强
D.氨气的相对分子质量大于甲烷
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 本题考查分子空间结构的判断。NH3中N原子形成3个σ键,有一对未成键的孤电子对,杂化轨道数为4,采取sp3杂化,孤电子对对成键电子对的排斥作用较强,N—H键之间的键角小于109°28′,所以氨气分子空间结构是三角锥型;CH4分子中C原子采取sp3杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,C—H键之间的键角相等为109°28′,故CH4的空间结构为正四面体型,故A、B、D错误,C正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
3.下列有关杂化轨道的说法不正确的是
A.原子中能量相近的某些轨道,在成键时,能重新组合成能量相等的新
轨道
B.轨道数目杂化前后可以相等,也可以不等
C.杂化轨道成键时,要满足原子轨道最大重叠原理、能量最低原理
D.CH4分子中任意两个C—H键的夹角均为109°28′
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 原子轨道形成杂化轨道前后,轨道数目不变化,用于形成杂化轨道的原子轨道的能量相近,并满足最大重叠程度,故选B。
题组二 杂化类型的判断
4.BF3是典型的平面三角形分子,它溶于氢氟酸或NaF溶液中都形成 ,则BF3和 中B原子的杂化轨道类型分别是
A.sp2、sp2 B.sp3、sp3
C.sp2、sp3 D.sp、sp2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
5.甲烷中的碳原子是sp3杂化,下列用*表示的碳原子的杂化和甲烷中的碳原子杂化类型一致的是
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 D项中用*表示的碳原子形成了四个σ键,与甲烷类似,其为sp3杂化。
6.下列分子或离子中,不存在sp3杂化的是
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
B项,NH3中N原子采取sp3杂化,错误;
C项,C2H6中C原子采取sp3杂化,错误;
D项,SO2中S原子采取sp2杂化,正确。
C.甲醛[ ] D.丙炔[ ]
7.下列分子所含原子中,既有sp3杂化,又有sp2杂化的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.乙醛[ ] B.丙烯腈[ ]
√
解析 乙醛中甲基的碳原子采取sp3杂化,醛基中碳原子采取sp2杂化;丙烯腈中碳碳双键的两个碳原子采取sp2杂化,另一个碳原子采取sp杂化;甲醛中碳原子采取sp2杂化;丙炔中甲基碳原子采取sp3杂化,碳碳三键中两个碳原子采取sp杂化。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
8.下列分子中的中心原子为sp杂化,分子的空间结构为直线形,且分子中没有形成π键的是
A.CH≡CH B.CO2 C.BeCl2 D.BBr3
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 CH≡CH和CO2中的C原子均采取sp杂化,且都含有π键;
BeCl2分子中Be采取sp杂化,没形成π键;
BBr3中B原子采取sp2杂化,且没有π键。
题组三 杂化轨道理论的应用
9.形成下列分子时,中心原子采用sp3杂化轨道和另一个原子的p轨道成键的是
①PF3 ②CF4 ③NH3 ④H2O
A.①② B.②③ C.③④ D.①④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 PF3、CF4、NH3、H2O分子中P原子、C原子、N原子、O原子都采取sp3杂化,NH3和H2O分子中H原子以1s轨道与N和O原子形成σ键,PF3和CF4分子中F原子以2p轨道分别与P和C原子形成σ键。
10.(2020·兰州高二月考)sp3杂化形成的AB4型分子的空间结构是
A.平面四边形 B.正四面体型
C.三角锥型 D.平面三角形
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.氮的最高价氧化物为无色晶体,它由 和 构成,已知其阴离子结构为平面三角形,阳离子中氮的杂化方式为sp,则其阳离子的结构和阴离子中氮的杂化方式为
A.直线形 sp2 B.V形 sp
C.平面三角形 sp2 D.平面三角形 sp3
√
综合强化练
解析 结构为平面三角形,其中氮原子的杂化方式为sp2;
中氮的杂化方式为sp,结构为直线形。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
12.化合物A是一种新型锅炉水除氧剂,其结构式如图所示:
,下列说法正确的是
A.碳、氮原子的杂化类型相同
B.氮原子与碳原子分别为sp3杂化与sp2杂化
C.1 mol A分子中所含σ键的数目为10NA
D.编号为a的氮原子和与其成键的另外三个原子在同一平面内
√
解析 A分子中碳、氮原子各形成了3个σ键,氮原子有一对孤电子对而碳原子没有,故氮原子是sp3杂化而碳原子是sp2杂化,A项错误、B项正确;
A分子中有一个碳氧双键,故有12对共用电子对、11个σ键,C项错误;
氮原子为sp3杂化,相应的四个原子形成的是三角锥型结构,不可能共平面,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.白磷是一种能自燃的单质,其分子的结构模型如图所示: ,下列叙述错误的是
A.每个磷原子形成3个σ键,磷原子为sp2杂化
B.磷原子均为sp3杂化
C.1 mol白磷中共含6 mol非极性键
D.白磷分子的空间结构为正四面体型
√
解析 由白磷分子的结构模型图可知,每个磷原子均形成了3个σ键,且每个磷原子还有一对孤电子对,故磷原子为sp3杂化,A项错误、B项正确;
由图可知C、D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
14.如图是甲醛分子的结构模型,根据该图和所学化学知识回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(1)甲醛分子中碳原子的杂化方式是____,作出该判断的主要理由是____
__________________________。
sp2
甲醛
分子的空间结构为平面三角形
解析 原子的杂化轨道类型不同,分子的空间结构也不同。由图可知,甲醛分子为平面三角形,所以甲醛分子中的碳原子采取sp2杂化。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是______(填序号)。
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
②⑤
解析 醛类分子中都含有C==O键,所以甲醛分子中的碳氧键是双键。一般来说,双键是σ键和π键的组合。
(3)甲醛分子中C—H键与C—H键之间的夹角___(填“=”“>”或“<”)
120°,出现该现象的主要原因是_________________________________
_____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 由于碳氧双键中存在π键,它对C—H键的排斥作用较强,所以甲醛分子中C—H键与C—H键间的夹角小于120°。
<
碳氧双键中存在π键,它对C—H键的
排斥作用较强
15.2001年是伟大的化学家、1954年诺贝尔化学奖得主、著名的化学结构大师、20世纪的科学怪杰鲍林(L.C.Pauling)教授的诞辰100周年。1994年这位老人谢世后,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中一个结构式如图所示。老人为什么画这个结构式?它能合成吗?
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
它有什么性质?不得而知。这是鲍林留给世人的一个谜,也许这是永远无法解开的谜,也许有朝一日你就能解开它。不管结果如何,让我们先对这个结构作一番了解。
(1)它的分子式是____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C6H2O2N10
解析 根据有机物分子结构简式的书写规则,不难确定,每个环上除3个氮原子外还有3个碳原子,由此可以确定其分子式。
(2)它是否带有电荷?____(填“是”或“否”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
否
解析 由电子数可以确定,该分子不带电荷。
(3)该分子中为sp杂化的氮原子有___个;sp2杂化的氮原子有___个;sp3杂化的氮原子有___个。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
解析 根据氮原子的成键特征和结构可以确定,采取sp2杂化方式的氮原子数为9个,采取sp杂化方式的氮原子数为1个,无sp3杂化方式。
9
0
(4)为什么人们推测它是炸药?_______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
它分解能产生大量很稳定的气体N2
16.“三鹿奶粉事件”在社会上引起了人们对食品质量的恐慌,三鹿奶粉中掺杂了被称为“蛋白精”的工业原料三聚氰胺。已知三聚氰胺的结构简式如图所示。三聚氰胺是氰胺(H2N—C≡N)的三聚体,请回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(1)写出基态碳原子的电子排布式:________。
1s22s22p2
(2)氰胺中—C≡N中的氮原子、三聚氰胺环状结构中的氮原子和氨基中的氮原子,这三种氮原子的杂化轨道类型分别是____、____、____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 氰胺中—C≡N中的N原子、三聚氰胺环上的N原子、—NH2中的N原子分别形成1、2、3个σ键且均有一对未成键电子对,所以分别采取sp、sp2、sp3杂化。
sp
sp2
sp3
(3)一个三聚氰胺分子中有____个σ键。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 除每个双键上有1个π键外,其余均为σ键,共15个。
15
(4)三聚氰胺与三聚氰酸( )分子相互之间通过氢键结合,在肾
脏内易形成结石。三聚氰酸分子中C原子采取____杂化。该分子的结构简式中,每个碳氧原子之间的共价键是___(填字母)。
A.2个σ键 B.2个π键 C.1个σ键、1个π键
sp2
C
解析 由于该分子中C与O形成双键,则应采取sp2方式成键,sp2杂化的C原子与氧原子间有1个σ键、1个π键。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
返回
本课结束
