高中化学苏教版(2021) 选择性必修2 专题4 第一单元 微专题5 分子(或离子)空间结构与杂化轨道理论(28张PPT)
文档属性
| 名称 | 高中化学苏教版(2021) 选择性必修2 专题4 第一单元 微专题5 分子(或离子)空间结构与杂化轨道理论(28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 741.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-19 23:56:03 | ||
图片预览








文档简介
(共28张PPT)
微专题5
分子(或离子)空间结构与杂化轨道理论
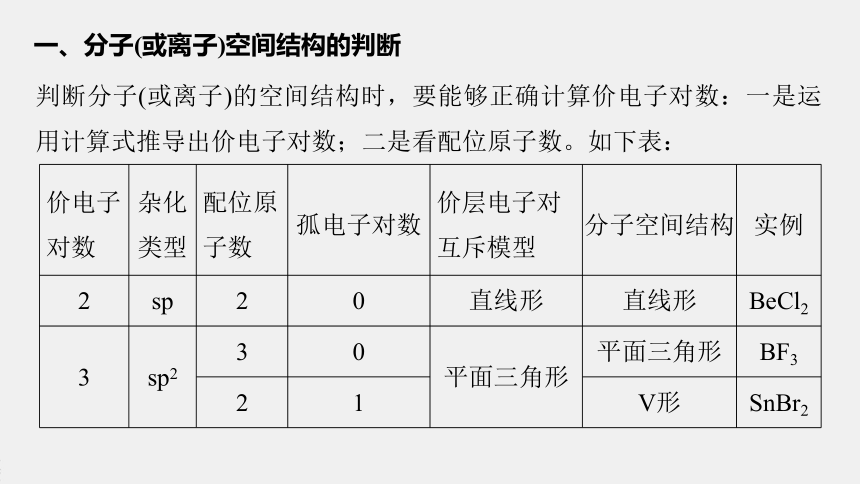
一、分子(或离子)空间结构的判断
判断分子(或离子)的空间结构时,要能够正确计算价电子对数:一是运用计算式推导出价电子对数;二是看配位原子数。如下表:
价电子对数 杂化类型 配位原子数 孤电子对数 价层电子对互斥模型 分子空间结构 实例
2 sp 2 0 直线形 直线形 BeCl2
3 sp2 3 0 平面三角形 平面三角形 BF3
2 1 V形 SnBr2
4 sp3 4 0 四面体型 正四面体型 CH4
3 1 三角锥型 NH3
2 2 V形 H2O
跟踪训练
1.下列分子或离子中,价层电子对互斥模型与粒子的空间结构一致的是
A.SO2 B.HCHO C.NCl3 D.H3O+
√
1
2
3
4
解析 当中心原子没有孤电子对时,价层电子对互斥模型与分子的空间结构就是一致的,SO2、NCl3、H3O+的中心原子均有孤电子对,A、C、D项错误。
2.下列说法正确的是
A.CH2Cl2分子的空间结构为正四面体型
B.H2O分子中氧原子的杂化轨道类型为sp2,分子的空间结构为V形
C.CO2分子中碳原子的杂化轨道类型为sp,分子的空间结构为直线形
D. 的空间结构为平面三角形
√
1
2
3
4
解析 CH4中4个共价键完全相同,为正四面体型,CH2Cl2分子的4个共价键不完全相同,所以分子的空间结构不是正四面体型,A错误;
H2O分子中O原子的价电子对数为 =4,为sp3杂化,含有2个孤电子对,分子的空间结构为V形,B错误;
CO2中C原子的价电子对数为 =2,为sp杂化,分子的空间结构为直线形,C正确;
中S原子的价电子对数为 =4,为sp3杂化,含1个孤电子对,分子的空间结构为三角锥型,D错误。
1
2
3
4
3.(2020·青岛检测)下列分子中,中心原子杂化类型相同,分子的空间结构也相同的是
A.BeCl2、CO2 B.H2O、SO2
C.SO2、CH4 D.NF3、CH2O
√
1
2
3
4
同样分析可知,BeCl2中Be原子采取sp杂化,BeCl2是直线形结构,CO2中C原子采取sp杂化,CO2是直线形结构,A项符合题意;
SO2中S原子采取sp2杂化,SO2是V形结构,CH4中C原子采取sp3杂化,CH4是正四面体型结构,C项不符合题意;
1
2
3
4
NF3中N原子采取sp3杂化,NF3是三角锥型结构,CH2O中C原子采取sp2杂化,CH2O是平面三角形结构,D项不符合题意。
1
2
3
4
4.硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据下列信息回答有关问题:
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的空
间结构模型如图所示,则在Xm-中,2号硼原子的杂化类型为____;m=___(填数字)。
sp2
2
解析 根据图示可知,2号B原子的价电子对数为3,且无孤电子对,故采取sp2杂化;根据图示可知,该阴离子的化学式为[H4B4O9]m-,其中H显+1价,B显+3价、O显-2价,所以m=2。
1
2
3
4
(2)BN中B的化合价为____,请解释原因:________________________。
1
2
3
4
+3
N的电负性大于B的电负性
解析 由于电负性:N>B,所以BN中B显+3价。
(3)BF3和过量NaF作用可生成NaBF4, 的空间结构为____________;
NaBF4的电子式为____________________。
正四面体型
1
2
3
4
二、键角的判断与比较
含有共价键的物质中相邻两键之间的夹角称为键角。键角是决定物质分子空间结构的主要因素之一。在高中阶段学习中,影响键角大小的因素主要有三:一是中心原子的杂化类型;二是中心原子的孤电子对数;三是中心原子的电负性大小等。
1.中心原子杂化类型不同的粒子,键角大小:sp杂化>sp2杂化>sp3杂化,如键角:CH≡CH>CH2==CH2>CH4。
2.中心原子杂化方式相同的粒子,由于斥力:孤电子对与孤电子对之间>孤电子对与成键电子对之间>成键电子对与成键电子对之间,孤电子对数越多,对成键电子对的斥力越大,键角越小。如键角:CH4>NH3>H2O。
3.中心原子杂化方式相同且孤电子对数也相同,利用中心原子的电负性大小,比较键角大小。如H2O、H2S中,中心原子均为sp3杂化,分子空间结构均为V形,由于电负性:O>S,吸引电子的能力:O>S,且键长:O—H键<S—H键,使得H2O、H2S中成键电子对的斥力逐渐减弱,键角减小,即键角:H2O(104°30′)>H2S(92°)。
4.同一粒子中不同共价键的键角,由于斥力:双键间>双键与单键间>单键间,则键角大小不同。如甲醛中: ,键角:α>β。
跟踪训练
5.在SO2分子中,分子的空间结构为V形,S原子采取sp2杂化,那么SO2的键角
A.等于120° B.大于120°
C.小于120° D.等于180°
√
5
6
7
8
解析 由于SO2分子的价层电子对互斥模型为平面三角形,从理论上讲其键角应为120°,但是由于SO2分子中的S原子有一对孤电子对,对其他的两个化学键存在排斥作用,因此分子中的键角要小于120°。
9
6.下列分子或离子中键角由大到小排列正确的是
①BCl3 ②NH3 ③H2O ④ ⑤BeCl2
A.⑤④①②③ B.④①②⑤③
C.⑤①④②③ D.③②④①⑤
√
5
6
7
8
9
解析
微粒 中心原子上孤电子对数 中心原子上价电子对数 价层电子对互斥模型名称 杂化轨道类型 空间 结构 键角
①BCl3 ×(3-3 ×1)=0 3 平面三角形 sp2 平面三角形 120°
②NH3 ×(5-3 ×1)=1 4 四面体型 sp3 三角 锥型 107°18′
5
6
7
8
9
③H2O ×(6-2 ×1)=2 4 四面体型 sp3 V形 104°30′
④ ×(5-1-4×1)=0 4 正四面体型 sp3 正四面体型 109°28′
⑤BeCl2 ×(2-2×1)=0 2 直线形 sp 直线形 180°
故键角由大到小的顺序为⑤①④②③。
5
6
7
8
9
7.下列物质的分子中,键角最小的是
A.H2O B.BF3 C.H2S D.CH4
√
5
6
7
8
9
解析 BF3分子中B原子采取sp2杂化,sp2杂化的理论键角为120°,B原子无孤电子对,所以BF3分子的键角为120°;CH4分子中C原子采取sp3杂化,sp3杂化的理论键角为109°28′,并且C原子无孤电子对,所以CH4的键角为109°28′;H2S和H2O分子中的S、O原子均采取sp3杂化,sp3杂化的理论键角为109°28′,由于两种分子中均存在两对孤电子对,孤电子对占据正四面体的两个顶角,且孤电子对斥力大于成键电子对的斥力,导致H2O分子的键角<109°28′,但O原子半径小,所以H2O分子中成键电子对间的斥力大于H2S分子中成键电子对间的斥力,即H2O分子键角大于H2S分子键角;综上,分子键角的大小顺序为BF3>CH4>H2O>H2S,所以键角最小的是H2S。
5
6
7
8
9
8.比较下列物质中键角的大小(填“>”“=”或“<”)。
(1)CH4______P4。
(2)NH3______PH3______AsH3。
(3)PF3______PCl3。
(4)光气(COCl2)中∠Cl—C==O______∠Cl—C—Cl。
5
6
7
8
>
>
>
<
>
9
9.(2020·武汉二中高二月考)按要求回答下列问题:
(1)CH3COOH中C原子的杂化轨道类型为________。
5
6
7
8
9
sp3、sp2
解析 CH3COOH分子中,—CH3和—COOH上的碳原子的杂化轨道类型分别是sp3和sp2。
(2)醛基中碳原子的杂化轨道类型是_____。
5
6
7
8
9
sp2
解析 上的碳原子形成3个σ键和1个π键,采取sp2杂化。
(3)化合物 中阳离子的空间结构为_________,
阴离子的中心原子轨道采取____杂化。
(4)X的单质与氢气可化合生成气体G,其水溶液pH>7。G分子中X原子的杂化轨道类型是____。
5
6
7
8
9
三角锥型
sp3
sp3
解析 G是NH3分子,N原子采取sp3杂化。
(5)S单质的常见形式为S8,其环状结构如图所示,S原子采取的轨道杂化方式是____。
5
6
7
8
9
sp3
解析 硫原子形成2个S—S键,还有2对孤电子对,杂化方式为sp3。
(6)H+可与H2O形成H3O+,H3O+中O原子采取_______杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为____________________
_____________________________________________________________________________________。
5
6
7
8
9
sp3
H3O+中O原子只有1对
孤电子对,H2O中O原子有2对孤电子对,前者成键电子对与孤电子对的排斥力较小,因而键角大
解析 H2O和H3O+中的氧原子均采取sp3杂化,其键角的差异是由成键电子对与孤电子对的斥力差异所造成的。
本课结束
微专题5
分子(或离子)空间结构与杂化轨道理论
一、分子(或离子)空间结构的判断
判断分子(或离子)的空间结构时,要能够正确计算价电子对数:一是运用计算式推导出价电子对数;二是看配位原子数。如下表:
价电子对数 杂化类型 配位原子数 孤电子对数 价层电子对互斥模型 分子空间结构 实例
2 sp 2 0 直线形 直线形 BeCl2
3 sp2 3 0 平面三角形 平面三角形 BF3
2 1 V形 SnBr2
4 sp3 4 0 四面体型 正四面体型 CH4
3 1 三角锥型 NH3
2 2 V形 H2O
跟踪训练
1.下列分子或离子中,价层电子对互斥模型与粒子的空间结构一致的是
A.SO2 B.HCHO C.NCl3 D.H3O+
√
1
2
3
4
解析 当中心原子没有孤电子对时,价层电子对互斥模型与分子的空间结构就是一致的,SO2、NCl3、H3O+的中心原子均有孤电子对,A、C、D项错误。
2.下列说法正确的是
A.CH2Cl2分子的空间结构为正四面体型
B.H2O分子中氧原子的杂化轨道类型为sp2,分子的空间结构为V形
C.CO2分子中碳原子的杂化轨道类型为sp,分子的空间结构为直线形
D. 的空间结构为平面三角形
√
1
2
3
4
解析 CH4中4个共价键完全相同,为正四面体型,CH2Cl2分子的4个共价键不完全相同,所以分子的空间结构不是正四面体型,A错误;
H2O分子中O原子的价电子对数为 =4,为sp3杂化,含有2个孤电子对,分子的空间结构为V形,B错误;
CO2中C原子的价电子对数为 =2,为sp杂化,分子的空间结构为直线形,C正确;
中S原子的价电子对数为 =4,为sp3杂化,含1个孤电子对,分子的空间结构为三角锥型,D错误。
1
2
3
4
3.(2020·青岛检测)下列分子中,中心原子杂化类型相同,分子的空间结构也相同的是
A.BeCl2、CO2 B.H2O、SO2
C.SO2、CH4 D.NF3、CH2O
√
1
2
3
4
同样分析可知,BeCl2中Be原子采取sp杂化,BeCl2是直线形结构,CO2中C原子采取sp杂化,CO2是直线形结构,A项符合题意;
SO2中S原子采取sp2杂化,SO2是V形结构,CH4中C原子采取sp3杂化,CH4是正四面体型结构,C项不符合题意;
1
2
3
4
NF3中N原子采取sp3杂化,NF3是三角锥型结构,CH2O中C原子采取sp2杂化,CH2O是平面三角形结构,D项不符合题意。
1
2
3
4
4.硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据下列信息回答有关问题:
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的空
间结构模型如图所示,则在Xm-中,2号硼原子的杂化类型为____;m=___(填数字)。
sp2
2
解析 根据图示可知,2号B原子的价电子对数为3,且无孤电子对,故采取sp2杂化;根据图示可知,该阴离子的化学式为[H4B4O9]m-,其中H显+1价,B显+3价、O显-2价,所以m=2。
1
2
3
4
(2)BN中B的化合价为____,请解释原因:________________________。
1
2
3
4
+3
N的电负性大于B的电负性
解析 由于电负性:N>B,所以BN中B显+3价。
(3)BF3和过量NaF作用可生成NaBF4, 的空间结构为____________;
NaBF4的电子式为____________________。
正四面体型
1
2
3
4
二、键角的判断与比较
含有共价键的物质中相邻两键之间的夹角称为键角。键角是决定物质分子空间结构的主要因素之一。在高中阶段学习中,影响键角大小的因素主要有三:一是中心原子的杂化类型;二是中心原子的孤电子对数;三是中心原子的电负性大小等。
1.中心原子杂化类型不同的粒子,键角大小:sp杂化>sp2杂化>sp3杂化,如键角:CH≡CH>CH2==CH2>CH4。
2.中心原子杂化方式相同的粒子,由于斥力:孤电子对与孤电子对之间>孤电子对与成键电子对之间>成键电子对与成键电子对之间,孤电子对数越多,对成键电子对的斥力越大,键角越小。如键角:CH4>NH3>H2O。
3.中心原子杂化方式相同且孤电子对数也相同,利用中心原子的电负性大小,比较键角大小。如H2O、H2S中,中心原子均为sp3杂化,分子空间结构均为V形,由于电负性:O>S,吸引电子的能力:O>S,且键长:O—H键<S—H键,使得H2O、H2S中成键电子对的斥力逐渐减弱,键角减小,即键角:H2O(104°30′)>H2S(92°)。
4.同一粒子中不同共价键的键角,由于斥力:双键间>双键与单键间>单键间,则键角大小不同。如甲醛中: ,键角:α>β。
跟踪训练
5.在SO2分子中,分子的空间结构为V形,S原子采取sp2杂化,那么SO2的键角
A.等于120° B.大于120°
C.小于120° D.等于180°
√
5
6
7
8
解析 由于SO2分子的价层电子对互斥模型为平面三角形,从理论上讲其键角应为120°,但是由于SO2分子中的S原子有一对孤电子对,对其他的两个化学键存在排斥作用,因此分子中的键角要小于120°。
9
6.下列分子或离子中键角由大到小排列正确的是
①BCl3 ②NH3 ③H2O ④ ⑤BeCl2
A.⑤④①②③ B.④①②⑤③
C.⑤①④②③ D.③②④①⑤
√
5
6
7
8
9
解析
微粒 中心原子上孤电子对数 中心原子上价电子对数 价层电子对互斥模型名称 杂化轨道类型 空间 结构 键角
①BCl3 ×(3-3 ×1)=0 3 平面三角形 sp2 平面三角形 120°
②NH3 ×(5-3 ×1)=1 4 四面体型 sp3 三角 锥型 107°18′
5
6
7
8
9
③H2O ×(6-2 ×1)=2 4 四面体型 sp3 V形 104°30′
④ ×(5-1-4×1)=0 4 正四面体型 sp3 正四面体型 109°28′
⑤BeCl2 ×(2-2×1)=0 2 直线形 sp 直线形 180°
故键角由大到小的顺序为⑤①④②③。
5
6
7
8
9
7.下列物质的分子中,键角最小的是
A.H2O B.BF3 C.H2S D.CH4
√
5
6
7
8
9
解析 BF3分子中B原子采取sp2杂化,sp2杂化的理论键角为120°,B原子无孤电子对,所以BF3分子的键角为120°;CH4分子中C原子采取sp3杂化,sp3杂化的理论键角为109°28′,并且C原子无孤电子对,所以CH4的键角为109°28′;H2S和H2O分子中的S、O原子均采取sp3杂化,sp3杂化的理论键角为109°28′,由于两种分子中均存在两对孤电子对,孤电子对占据正四面体的两个顶角,且孤电子对斥力大于成键电子对的斥力,导致H2O分子的键角<109°28′,但O原子半径小,所以H2O分子中成键电子对间的斥力大于H2S分子中成键电子对间的斥力,即H2O分子键角大于H2S分子键角;综上,分子键角的大小顺序为BF3>CH4>H2O>H2S,所以键角最小的是H2S。
5
6
7
8
9
8.比较下列物质中键角的大小(填“>”“=”或“<”)。
(1)CH4______P4。
(2)NH3______PH3______AsH3。
(3)PF3______PCl3。
(4)光气(COCl2)中∠Cl—C==O______∠Cl—C—Cl。
5
6
7
8
>
>
>
<
>
9
9.(2020·武汉二中高二月考)按要求回答下列问题:
(1)CH3COOH中C原子的杂化轨道类型为________。
5
6
7
8
9
sp3、sp2
解析 CH3COOH分子中,—CH3和—COOH上的碳原子的杂化轨道类型分别是sp3和sp2。
(2)醛基中碳原子的杂化轨道类型是_____。
5
6
7
8
9
sp2
解析 上的碳原子形成3个σ键和1个π键,采取sp2杂化。
(3)化合物 中阳离子的空间结构为_________,
阴离子的中心原子轨道采取____杂化。
(4)X的单质与氢气可化合生成气体G,其水溶液pH>7。G分子中X原子的杂化轨道类型是____。
5
6
7
8
9
三角锥型
sp3
sp3
解析 G是NH3分子,N原子采取sp3杂化。
(5)S单质的常见形式为S8,其环状结构如图所示,S原子采取的轨道杂化方式是____。
5
6
7
8
9
sp3
解析 硫原子形成2个S—S键,还有2对孤电子对,杂化方式为sp3。
(6)H+可与H2O形成H3O+,H3O+中O原子采取_______杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为____________________
_____________________________________________________________________________________。
5
6
7
8
9
sp3
H3O+中O原子只有1对
孤电子对,H2O中O原子有2对孤电子对,前者成键电子对与孤电子对的排斥力较小,因而键角大
解析 H2O和H3O+中的氧原子均采取sp3杂化,其键角的差异是由成键电子对与孤电子对的斥力差异所造成的。
本课结束
