高中化学苏教版(2021) 选择性必修2 专题4 专题知识体系构建与核心素养提升(23张PPT)
文档属性
| 名称 | 高中化学苏教版(2021) 选择性必修2 专题4 专题知识体系构建与核心素养提升(23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 759.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-19 23:57:03 | ||
图片预览








文档简介
(共23张PPT)
专题知识体系构建与核心素养提升
内容索引
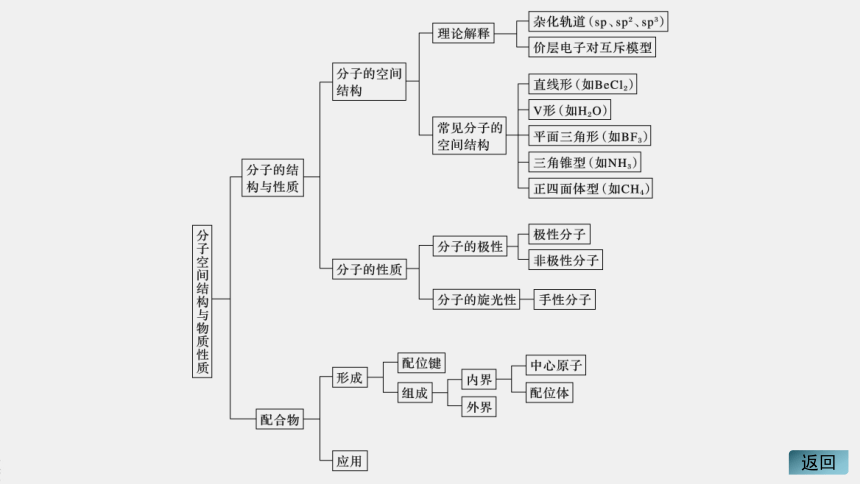
知识体系构建
核心素养提升
知识体系构建
返回
核心素养提升
在分子结构与性质中,涉及到的考点很多,如:共价键及键参数,价层电子对互斥模型,杂化轨道理论,键的极性与分子极性,配合物理论等,特别是以简答题的形式出现较多。下面从三个角度探讨分子结构与性质在高考中的考查。
角度一 “两大理论”与微粒空间结构
1.[2020·全国卷Ⅰ,35(3)]磷酸根离子的空间结构为___________,其中P的价层电子对数为___、杂化轨道类型为____。
1
2
3
4
5
6
7
8
9
10
正四面体型
4
sp3
2.[2019·全国卷Ⅰ,35(2)节选]乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是____、____。
1
2
3
4
5
6
7
8
9
10
sp3
sp3
解析 乙二胺分子中,1个N原子形成3个单键,还有一个孤电子对,故N原子的价电子对数为4,N原子采取sp3杂化;1个C原子形成4个单键,没有孤电子对,价电子对数为4,采取sp3杂化。
3.[2019·全国卷Ⅲ,35(4)]NH4H2PO4中,电负性最高的元素是____;P的____杂化轨道与O的2p轨道形成____键。
1
2
3
4
5
6
7
8
9
10
O
sp3
σ
解析 同周期从左到右,主族元素的电负性逐渐增强,故O的电负性大于N,同主族从上到下,元素的电负性逐渐减小,故电负性N大于P,又因H的电负性小于O,因此NH4H2PO4中电负性最高的元素是O。 中中心原子P的价层电子对数为4,故P为sp3杂化,P的sp3杂化轨道与O的2p轨道形成σ键。
1
2
3
4
5
6
7
8
9
10
4.[2018·全国卷Ⅰ,35(3)节选]LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间结构是___________,中心原子的杂化形式为___。
正四面体型
sp3
5.[2018·江苏,21A(1)] 中心原子轨道的杂化类型为____; 的空间结构为______________(用文字描述)。
1
2
3
4
5
6
7
8
9
10
sp3
平面(正)三角形
角度二 微粒作用与分子性质
6.(1)[2020·浙江7月选考,26(3)]常温下,在水中的溶解度乙醇大于氯乙烷,原因是_______________________________________________。
1
2
3
4
5
6
7
8
9
10
乙醇与水形成分子间氢键而氯乙烷不能与水形成氢键
解析 由于乙醇与水分子间存在氢键,而氯乙烷和水分子间不存在氢键,故乙醇在水中的溶解度大于氯乙烷的溶解度。
(2)[2020·浙江1月选考,26(3)]在常压下,甲醇的沸点(65 ℃)比甲醛的沸点(-19 ℃)高。主要原因是___________________。
1
2
3
4
5
6
7
8
9
10
甲醇分子间存在氢键
解析 甲醇分子中含有羟基,分子间可以形成氢键,而甲醛分子间只有范德华力,氢键强于范德华力,因此常压下,甲醇的沸点比甲醛的高。
(3)[2019·全国卷Ⅱ,35(1)]元素As与N同族。预测As的氢化物分子的空间结构为_________,其沸点比NH3的____(填“高”或“低”),其判断理由是___________________。
1
2
3
4
5
6
7
8
9
10
三角锥型
低
NH3分子间存在氢键
7.[2018·全国卷Ⅱ,35(3)]如图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________________________________
_____。
1
2
3
4
5
6
7
8
9
10
S8相对分子质量大,分子间范德华
力强
8.[2018·全国卷Ⅲ,35(3)]ZnF2具有较高的熔点(872 ℃),其化学键类型是_______;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是__________________________________________
___________________________。
1
2
3
4
5
6
7
8
9
10
离子键
ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2的化
学键以共价键为主,极性较小
①从结构角度分析,R中两种阳离子的相同之处为______,不同之处为____(填字母)。
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.空间结构 D.共价键类型
9.[2017·全国卷Ⅱ,35(3)]经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。
ABD
C
1
2
3
4
5
6
7
8
9
10
5
1
2
3
4
5
6
7
8
9
10
③图中虚线代表氢键,其表示式为( )N—H…Cl、_________________、__________________。
1
2
3
4
5
6
7
8
9
10
角度三 配合物理论
10.[2020·新高考全国卷Ⅰ(山东),17(1)(3)]CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间结构为____________,其固体的晶体类型为_________。
正四面体型
分子晶体
解析 Sn最外层有4个电子,与4个Cl形成4个σ键,因此SnCl4的空间结构为正四面体型;由题给信息知SnCl4常温常压下为液体,说明SnCl4的熔点较低,所以其固体的晶体类型为分子晶体。
1
2
3
4
5
6
7
8
9
10
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 mol该配合物中通过螯合作用形成的配位键有___ mol,该螯合物中N的杂化方式有___种。
1
2
3
4
5
6
7
8
9
10
6
1
解析 由题给图示可知,通过螯合作用形成了3个环,每个环中Cd2+均可与2个N原子或2个氧原子形成配位键,即1个Cd2+与4个N原子分别形成4个配位键,与2个O原子分别形成2个配位键,因此1 mol该配合物中通过螯合作用形成的配位键有6 mol;由题给图示可知,该配合物中有2种不同的N原子,每个N原子均形成3个σ键,因此所有N原子的杂化方式均为sp2杂化,即杂化方式只有1种。
1
2
3
4
5
6
7
8
9
10
返回
本课结束
专题知识体系构建与核心素养提升
内容索引
知识体系构建
核心素养提升
知识体系构建
返回
核心素养提升
在分子结构与性质中,涉及到的考点很多,如:共价键及键参数,价层电子对互斥模型,杂化轨道理论,键的极性与分子极性,配合物理论等,特别是以简答题的形式出现较多。下面从三个角度探讨分子结构与性质在高考中的考查。
角度一 “两大理论”与微粒空间结构
1.[2020·全国卷Ⅰ,35(3)]磷酸根离子的空间结构为___________,其中P的价层电子对数为___、杂化轨道类型为____。
1
2
3
4
5
6
7
8
9
10
正四面体型
4
sp3
2.[2019·全国卷Ⅰ,35(2)节选]乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是____、____。
1
2
3
4
5
6
7
8
9
10
sp3
sp3
解析 乙二胺分子中,1个N原子形成3个单键,还有一个孤电子对,故N原子的价电子对数为4,N原子采取sp3杂化;1个C原子形成4个单键,没有孤电子对,价电子对数为4,采取sp3杂化。
3.[2019·全国卷Ⅲ,35(4)]NH4H2PO4中,电负性最高的元素是____;P的____杂化轨道与O的2p轨道形成____键。
1
2
3
4
5
6
7
8
9
10
O
sp3
σ
解析 同周期从左到右,主族元素的电负性逐渐增强,故O的电负性大于N,同主族从上到下,元素的电负性逐渐减小,故电负性N大于P,又因H的电负性小于O,因此NH4H2PO4中电负性最高的元素是O。 中中心原子P的价层电子对数为4,故P为sp3杂化,P的sp3杂化轨道与O的2p轨道形成σ键。
1
2
3
4
5
6
7
8
9
10
4.[2018·全国卷Ⅰ,35(3)节选]LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间结构是___________,中心原子的杂化形式为___。
正四面体型
sp3
5.[2018·江苏,21A(1)] 中心原子轨道的杂化类型为____; 的空间结构为______________(用文字描述)。
1
2
3
4
5
6
7
8
9
10
sp3
平面(正)三角形
角度二 微粒作用与分子性质
6.(1)[2020·浙江7月选考,26(3)]常温下,在水中的溶解度乙醇大于氯乙烷,原因是_______________________________________________。
1
2
3
4
5
6
7
8
9
10
乙醇与水形成分子间氢键而氯乙烷不能与水形成氢键
解析 由于乙醇与水分子间存在氢键,而氯乙烷和水分子间不存在氢键,故乙醇在水中的溶解度大于氯乙烷的溶解度。
(2)[2020·浙江1月选考,26(3)]在常压下,甲醇的沸点(65 ℃)比甲醛的沸点(-19 ℃)高。主要原因是___________________。
1
2
3
4
5
6
7
8
9
10
甲醇分子间存在氢键
解析 甲醇分子中含有羟基,分子间可以形成氢键,而甲醛分子间只有范德华力,氢键强于范德华力,因此常压下,甲醇的沸点比甲醛的高。
(3)[2019·全国卷Ⅱ,35(1)]元素As与N同族。预测As的氢化物分子的空间结构为_________,其沸点比NH3的____(填“高”或“低”),其判断理由是___________________。
1
2
3
4
5
6
7
8
9
10
三角锥型
低
NH3分子间存在氢键
7.[2018·全国卷Ⅱ,35(3)]如图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________________________________
_____。
1
2
3
4
5
6
7
8
9
10
S8相对分子质量大,分子间范德华
力强
8.[2018·全国卷Ⅲ,35(3)]ZnF2具有较高的熔点(872 ℃),其化学键类型是_______;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是__________________________________________
___________________________。
1
2
3
4
5
6
7
8
9
10
离子键
ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2的化
学键以共价键为主,极性较小
①从结构角度分析,R中两种阳离子的相同之处为______,不同之处为____(填字母)。
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.空间结构 D.共价键类型
9.[2017·全国卷Ⅱ,35(3)]经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。
ABD
C
1
2
3
4
5
6
7
8
9
10
5
1
2
3
4
5
6
7
8
9
10
③图中虚线代表氢键,其表示式为( )N—H…Cl、_________________、__________________。
1
2
3
4
5
6
7
8
9
10
角度三 配合物理论
10.[2020·新高考全国卷Ⅰ(山东),17(1)(3)]CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间结构为____________,其固体的晶体类型为_________。
正四面体型
分子晶体
解析 Sn最外层有4个电子,与4个Cl形成4个σ键,因此SnCl4的空间结构为正四面体型;由题给信息知SnCl4常温常压下为液体,说明SnCl4的熔点较低,所以其固体的晶体类型为分子晶体。
1
2
3
4
5
6
7
8
9
10
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 mol该配合物中通过螯合作用形成的配位键有___ mol,该螯合物中N的杂化方式有___种。
1
2
3
4
5
6
7
8
9
10
6
1
解析 由题给图示可知,通过螯合作用形成了3个环,每个环中Cd2+均可与2个N原子或2个氧原子形成配位键,即1个Cd2+与4个N原子分别形成4个配位键,与2个O原子分别形成2个配位键,因此1 mol该配合物中通过螯合作用形成的配位键有6 mol;由题给图示可知,该配合物中有2种不同的N原子,每个N原子均形成3个σ键,因此所有N原子的杂化方式均为sp2杂化,即杂化方式只有1种。
1
2
3
4
5
6
7
8
9
10
返回
本课结束
