富集在海水中的元素——氯
文档属性
| 名称 | 富集在海水中的元素——氯 |  | |
| 格式 | zip | ||
| 文件大小 | 833.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-29 08:13:17 | ||
图片预览






文档简介
(共24张PPT)
富集在海水中的元素——氯
浩瀚的海洋 资源的宝库
海水中含盐3%,主要为氯化钠;
还含有氯化镁、硫酸镁等。
氯在自然界中以化合态存在(主要是NaCl)。
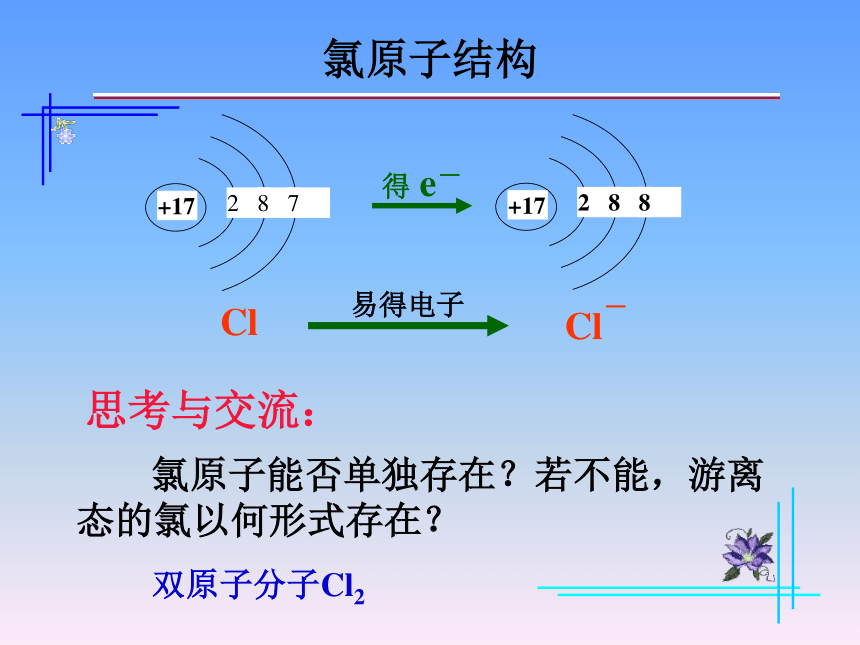
氯原子结构
Cl
Cl-
得 e-
+17
2
8
7
+17
2
8
8
易得电子
思考与交流:
氯原子能否单独存在?若不能,游离态的氯以何形式存在?
双原子分子Cl2
京沪高速公路淮安路段液氯的泄漏
新华网报道:2005年3月29日,京沪高速公路淮安路段一辆满载液氯的液罐车和对面来车相撞 ,大量液氯外泄。据目击者描述 : “一股黄绿色的气体就像探照灯光一样,‘唰’地射向空中,并有刺鼻的味道,眼睛也熏得睁不开 。”
事发后消防队员不断地用水枪喷射,但还是造成350 人中毒进医院救治, 28人中毒死亡,附近居民采取应急措施,疏散到高坡上。
颜色
气味
溶解性
密度
毒性
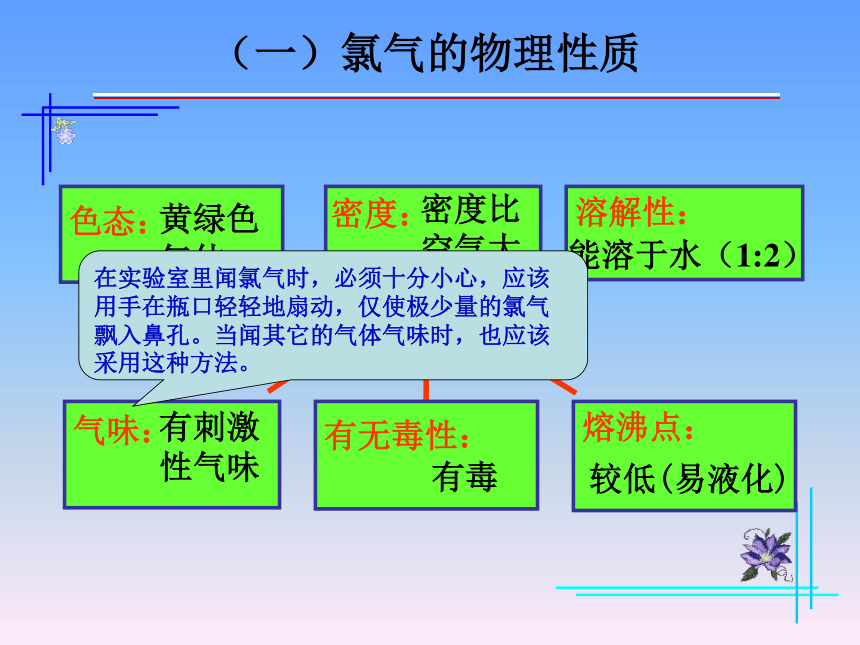
(一)氯气的物理性质
物理性质
色态:
黄绿色
气体
密度:
密度比
空气大
溶解性:
能溶于水(1:2)
气味:
有刺激
性气味
有无毒性:
有毒
熔沸点:
较低(易液化)
在实验室里闻氯气时,必须十分小心,应该用手在瓶口轻轻地扇动,仅使极少量的氯气飘入鼻孔。当闻其它的气体气味时,也应该采用这种方法。
(1)氯气是黄绿色
(2)有刺激性气味,有毒的气体
(3)易液化
(4)密度比空气大
(5)能溶于水(1体积水可溶解2体积氯气)
——向上排空气法收集
不能用排水法收集,可用排饱和食盐水法收集
加压液化,贮存在钢瓶中
(一)氯气的物理性质
(二) 化学性质
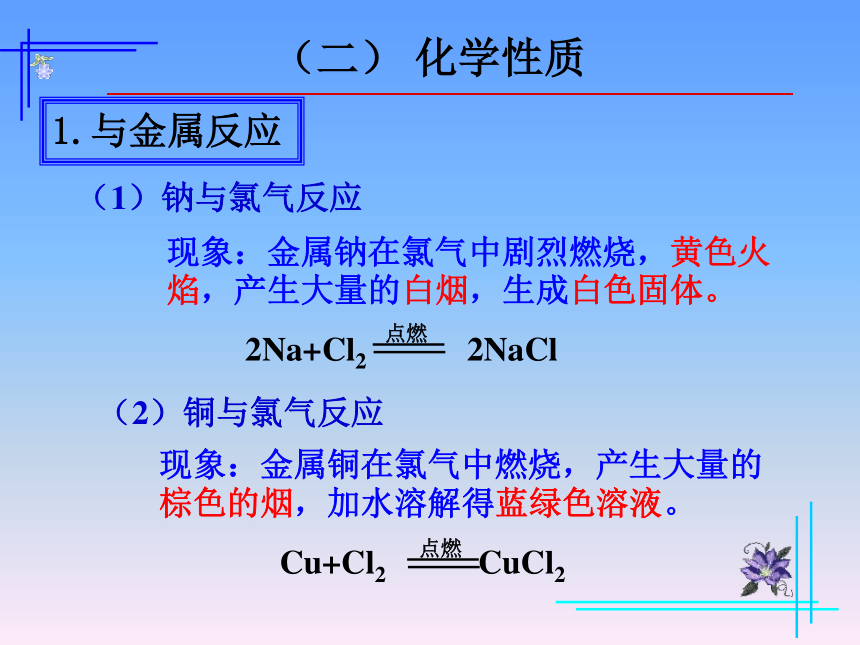
1.与金属反应
(1)钠与氯气反应
现象:金属钠在氯气中剧烈燃烧,黄色火焰,产生大量的白烟,生成白色固体。
点燃
2Na+Cl2 2NaCl
(2)铜与氯气反应
现象:金属铜在氯气中燃烧,产生大量的棕色的烟,加水溶解得蓝绿色溶液。
点燃
Cu+Cl2 CuCl2
(二) 化学性质
常温下,氯气不与铁反应,所以可用钢瓶盛装和运输液氯。
现象:红热的铁丝在氯气中剧烈燃烧,产生
棕黄色的烟;溶于水后溶液呈黄色。
(3)铁与氯气反应
点燃
2Fe+3Cl2 2FeCl3
现象:氢 气在氯气中安静燃烧,发出苍白色火焰,瓶口呈白雾状。
H2+Cl2 2HCl
点燃
2.与非金属反应
(二) 化学性质
(1)与氢 气的反应
在点燃(或光照)下氯气均能与氢气反应
H2+Cl2 2HCl (爆炸 )
光照
(2)实验证明,在一定条件下,Cl2还能与P等非金属直接化合。
2P+3Cl2 2PCl3
点燃
2P+5Cl2 2PCl5
点燃
(二) 化学性质
思考与交流
通过各物质在氯气中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?
①燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。
②燃烧的本质是氧化还原反应,所有发光发热的剧烈的化学反应都称为燃烧。
定义:任何发光发热的剧烈的化学反应叫燃烧。
(二) 化学性质
3.与水的反应
次氯酸的性质:
3、强氧化性
1、弱酸性
Cl2+H2O HCl+HClO
2、不稳定易分解
光照
2HClO 2HCl+O2↑
酸性:H2CO3 >HClO
实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中
—— 能使红布条、品红等有色物质褪色,氯气可用作自来水消毒剂
(二) 化学性质
思考:液氯与氯水相同吗?新制氯水与久置的氯水相
比成分相同吗?
液氯 氯水
分类
微粒
性质
纯净物
混合物
分子:
离子:
Cl2 ,HClO,H2O
H+,Cl-,ClO-,
OH-
分子:H2O
离子:H+,
Cl- ,OH-
新制
有氧化性,无酸性和漂白性
有酸性,强氧化性,能漂白,消毒,光照时HClO分解
久置
只有Cl2
分子
只有酸性
如图所示,A处通入湿润的Cl2,关闭B阀时,C处的红布看不到明显现象,当打开B阀后,C处红布条逐渐褪色,则D中装的是
A.浓H2SO4
B.NaOH溶液
C.H2O
D.饱和NaCl溶液
A
B
C
D
A B
4.与碱的反应
(二) 化学性质
推测氯气与NaOH溶液反应的产物是什么
2NaOH+Cl2=NaClO+NaCl+H2O
有效成分:NaClO
2 Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
漂白粉、漂粉精
漂白液
有效成分:Ca(ClO)2
氯气跟碱反应的化学方程式有规律吗?
氯气+碱 氯化物+次氯酸盐+水
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
漂白原理:
(反应原理:强酸制取弱酸)
氯水、漂白液、漂白粉、漂粉精的漂白作用都是因反应生成的HClO。
(二) 化学性质
1、实验室制法原理
舍勒 【瑞典】 公元1742一1786
MnO2+4HCl(浓)=MnCl2+2H2O+Cl2↑
△
(三) 氯气的制备
2、实验装置
3、收集氯气:
向上排空气法、排饱和食盐水法
4、验证氯气:
使湿润的KI淀粉试纸变蓝或使湿润的蓝色石蕊试纸先变红后褪色。
Ag+ + Cl– = AgCl
2Ag+ + CO32- = Ag2CO3
Ag2CO3 + 2H+ =2Ag+ + CO2 + H2O
在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。
(2)方法和结论:
(1)试剂:AgNO3溶液、稀硝酸
或在被检验的溶液中滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。
(四)Cl-的检验
小结:
氟 F 9
+9
2 7
氯 Cl 17
+17
2 8 7
溴 Br 35
碘 I 53
砹 At 85
+35
2 8 18 7
+53
2 8 18 18 7
+85
2 8 18 32 18 7
卤素的原子结构
卤素原子结构有何相似点和不同点?由此推测它们化学性质有何相似性和递变性?
成盐元素—卤素
最外层7个电子
易得一个电子,
核电荷数递增
电子层数递增
原子半径依次增大
得电子能力逐渐减弱
原子结构
性质
决定
具氧化性
氧化性逐渐减弱
①对比Cl2,写出Br2与 Na 、Fe 反应的化学方程式。
1.与金属反应:F2 Cl2 Br2 的氧化性强,能把可变化合价
的金属氧化成高价的金属卤化物,I2 的氧化能力最弱,
跟铁反应只夺取铁的2个电子,生成FeI2。
②对比Cl2,写出F2 、Br2、I2与 H2 反应的化学方程式。 它们发生反应的条件相同吗?
③对比Cl2,写出Br2与 H2O 反应的化学方程式。
I2 +Fe=FeI2
Br2+2Na=2NaBr
3Br2+2Fe=2FeBr3
卤素单质的化学性质
名称 反应条件 方程式 氢化物稳定性
F2 冷暗处爆炸 H2+F2=2HF HF很稳定
Cl2 光照或点燃 H2+Cl2=2HCl HCl稳定
Br2 高温 H2+Br2=2HBr HBr较不稳定
I2 高温、持续加热 H2+I2=2HI HI很不稳定
缓慢进行
2. 卤素与氢气的反应
结论: F Cl Br I 随着核电荷数的增多,原子半径的增大,
(1)卤素单质与H2化合的难易关系:F2 >Cl2> Br2> I 2
(2)卤化氢的稳定性关系:HF > HCl > HBr > HI
Br2+ H2O=HBr+HBrO
反应越来越难以发生
2F2+2H2O=4HF+O2 (特例)
Cl2 +H2O=HCl+HClO
3.卤素与水反应
通式:X2 + H2O=====HX+HXO(X:Cl、Br、I)
I2 +H2O=HI+HIO
4.卤素间的相互置换
思考:根据上述实验,排出Cl2、Br2、I2的氧化性强弱顺序及Cl-、Br-、I-的还原性强弱顺序
结论:氧化性:Cl2>Br2>I2
还原性:I->Br->Cl-
Cl2+ 2Br- = 2Cl-+Br2
Cl2+ 2I- = 2Cl-+I2
Br2+ 2I-= 2Br-+I2
富集在海水中的元素——氯
浩瀚的海洋 资源的宝库
海水中含盐3%,主要为氯化钠;
还含有氯化镁、硫酸镁等。
氯在自然界中以化合态存在(主要是NaCl)。
氯原子结构
Cl
Cl-
得 e-
+17
2
8
7
+17
2
8
8
易得电子
思考与交流:
氯原子能否单独存在?若不能,游离态的氯以何形式存在?
双原子分子Cl2
京沪高速公路淮安路段液氯的泄漏
新华网报道:2005年3月29日,京沪高速公路淮安路段一辆满载液氯的液罐车和对面来车相撞 ,大量液氯外泄。据目击者描述 : “一股黄绿色的气体就像探照灯光一样,‘唰’地射向空中,并有刺鼻的味道,眼睛也熏得睁不开 。”
事发后消防队员不断地用水枪喷射,但还是造成350 人中毒进医院救治, 28人中毒死亡,附近居民采取应急措施,疏散到高坡上。
颜色
气味
溶解性
密度
毒性
(一)氯气的物理性质
物理性质
色态:
黄绿色
气体
密度:
密度比
空气大
溶解性:
能溶于水(1:2)
气味:
有刺激
性气味
有无毒性:
有毒
熔沸点:
较低(易液化)
在实验室里闻氯气时,必须十分小心,应该用手在瓶口轻轻地扇动,仅使极少量的氯气飘入鼻孔。当闻其它的气体气味时,也应该采用这种方法。
(1)氯气是黄绿色
(2)有刺激性气味,有毒的气体
(3)易液化
(4)密度比空气大
(5)能溶于水(1体积水可溶解2体积氯气)
——向上排空气法收集
不能用排水法收集,可用排饱和食盐水法收集
加压液化,贮存在钢瓶中
(一)氯气的物理性质
(二) 化学性质
1.与金属反应
(1)钠与氯气反应
现象:金属钠在氯气中剧烈燃烧,黄色火焰,产生大量的白烟,生成白色固体。
点燃
2Na+Cl2 2NaCl
(2)铜与氯气反应
现象:金属铜在氯气中燃烧,产生大量的棕色的烟,加水溶解得蓝绿色溶液。
点燃
Cu+Cl2 CuCl2
(二) 化学性质
常温下,氯气不与铁反应,所以可用钢瓶盛装和运输液氯。
现象:红热的铁丝在氯气中剧烈燃烧,产生
棕黄色的烟;溶于水后溶液呈黄色。
(3)铁与氯气反应
点燃
2Fe+3Cl2 2FeCl3
现象:氢 气在氯气中安静燃烧,发出苍白色火焰,瓶口呈白雾状。
H2+Cl2 2HCl
点燃
2.与非金属反应
(二) 化学性质
(1)与氢 气的反应
在点燃(或光照)下氯气均能与氢气反应
H2+Cl2 2HCl (爆炸 )
光照
(2)实验证明,在一定条件下,Cl2还能与P等非金属直接化合。
2P+3Cl2 2PCl3
点燃
2P+5Cl2 2PCl5
点燃
(二) 化学性质
思考与交流
通过各物质在氯气中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?
①燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。
②燃烧的本质是氧化还原反应,所有发光发热的剧烈的化学反应都称为燃烧。
定义:任何发光发热的剧烈的化学反应叫燃烧。
(二) 化学性质
3.与水的反应
次氯酸的性质:
3、强氧化性
1、弱酸性
Cl2+H2O HCl+HClO
2、不稳定易分解
光照
2HClO 2HCl+O2↑
酸性:H2CO3 >HClO
实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中
—— 能使红布条、品红等有色物质褪色,氯气可用作自来水消毒剂
(二) 化学性质
思考:液氯与氯水相同吗?新制氯水与久置的氯水相
比成分相同吗?
液氯 氯水
分类
微粒
性质
纯净物
混合物
分子:
离子:
Cl2 ,HClO,H2O
H+,Cl-,ClO-,
OH-
分子:H2O
离子:H+,
Cl- ,OH-
新制
有氧化性,无酸性和漂白性
有酸性,强氧化性,能漂白,消毒,光照时HClO分解
久置
只有Cl2
分子
只有酸性
如图所示,A处通入湿润的Cl2,关闭B阀时,C处的红布看不到明显现象,当打开B阀后,C处红布条逐渐褪色,则D中装的是
A.浓H2SO4
B.NaOH溶液
C.H2O
D.饱和NaCl溶液
A
B
C
D
A B
4.与碱的反应
(二) 化学性质
推测氯气与NaOH溶液反应的产物是什么
2NaOH+Cl2=NaClO+NaCl+H2O
有效成分:NaClO
2 Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
漂白粉、漂粉精
漂白液
有效成分:Ca(ClO)2
氯气跟碱反应的化学方程式有规律吗?
氯气+碱 氯化物+次氯酸盐+水
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
漂白原理:
(反应原理:强酸制取弱酸)
氯水、漂白液、漂白粉、漂粉精的漂白作用都是因反应生成的HClO。
(二) 化学性质
1、实验室制法原理
舍勒 【瑞典】 公元1742一1786
MnO2+4HCl(浓)=MnCl2+2H2O+Cl2↑
△
(三) 氯气的制备
2、实验装置
3、收集氯气:
向上排空气法、排饱和食盐水法
4、验证氯气:
使湿润的KI淀粉试纸变蓝或使湿润的蓝色石蕊试纸先变红后褪色。
Ag+ + Cl– = AgCl
2Ag+ + CO32- = Ag2CO3
Ag2CO3 + 2H+ =2Ag+ + CO2 + H2O
在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。
(2)方法和结论:
(1)试剂:AgNO3溶液、稀硝酸
或在被检验的溶液中滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。
(四)Cl-的检验
小结:
氟 F 9
+9
2 7
氯 Cl 17
+17
2 8 7
溴 Br 35
碘 I 53
砹 At 85
+35
2 8 18 7
+53
2 8 18 18 7
+85
2 8 18 32 18 7
卤素的原子结构
卤素原子结构有何相似点和不同点?由此推测它们化学性质有何相似性和递变性?
成盐元素—卤素
最外层7个电子
易得一个电子,
核电荷数递增
电子层数递增
原子半径依次增大
得电子能力逐渐减弱
原子结构
性质
决定
具氧化性
氧化性逐渐减弱
①对比Cl2,写出Br2与 Na 、Fe 反应的化学方程式。
1.与金属反应:F2 Cl2 Br2 的氧化性强,能把可变化合价
的金属氧化成高价的金属卤化物,I2 的氧化能力最弱,
跟铁反应只夺取铁的2个电子,生成FeI2。
②对比Cl2,写出F2 、Br2、I2与 H2 反应的化学方程式。 它们发生反应的条件相同吗?
③对比Cl2,写出Br2与 H2O 反应的化学方程式。
I2 +Fe=FeI2
Br2+2Na=2NaBr
3Br2+2Fe=2FeBr3
卤素单质的化学性质
名称 反应条件 方程式 氢化物稳定性
F2 冷暗处爆炸 H2+F2=2HF HF很稳定
Cl2 光照或点燃 H2+Cl2=2HCl HCl稳定
Br2 高温 H2+Br2=2HBr HBr较不稳定
I2 高温、持续加热 H2+I2=2HI HI很不稳定
缓慢进行
2. 卤素与氢气的反应
结论: F Cl Br I 随着核电荷数的增多,原子半径的增大,
(1)卤素单质与H2化合的难易关系:F2 >Cl2> Br2> I 2
(2)卤化氢的稳定性关系:HF > HCl > HBr > HI
Br2+ H2O=HBr+HBrO
反应越来越难以发生
2F2+2H2O=4HF+O2 (特例)
Cl2 +H2O=HCl+HClO
3.卤素与水反应
通式:X2 + H2O=====HX+HXO(X:Cl、Br、I)
I2 +H2O=HI+HIO
4.卤素间的相互置换
思考:根据上述实验,排出Cl2、Br2、I2的氧化性强弱顺序及Cl-、Br-、I-的还原性强弱顺序
结论:氧化性:Cl2>Br2>I2
还原性:I->Br->Cl-
Cl2+ 2Br- = 2Cl-+Br2
Cl2+ 2I- = 2Cl-+I2
Br2+ 2I-= 2Br-+I2
