新人教版第三单元课题2原子的结构ppt
文档属性
| 名称 | 新人教版第三单元课题2原子的结构ppt |  | |
| 格式 | zip | ||
| 文件大小 | 11.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-19 10:36:02 | ||
图片预览





文档简介
(共37张PPT)
知识回顾
1.原子是构成物质的一种粒子,
可构成分子,也可直接构成物质;
2.原子质量和体积都很小,
在不断运动,原子之间有间隔;
3.原子是化学变化中的最小粒子,
在化学变化中不可再分。
原子在化学变化中不可再分,
原子是否可以再分呢?
科学实验证明:
原子有复杂的结构,可以再分。
原子结构
示意图
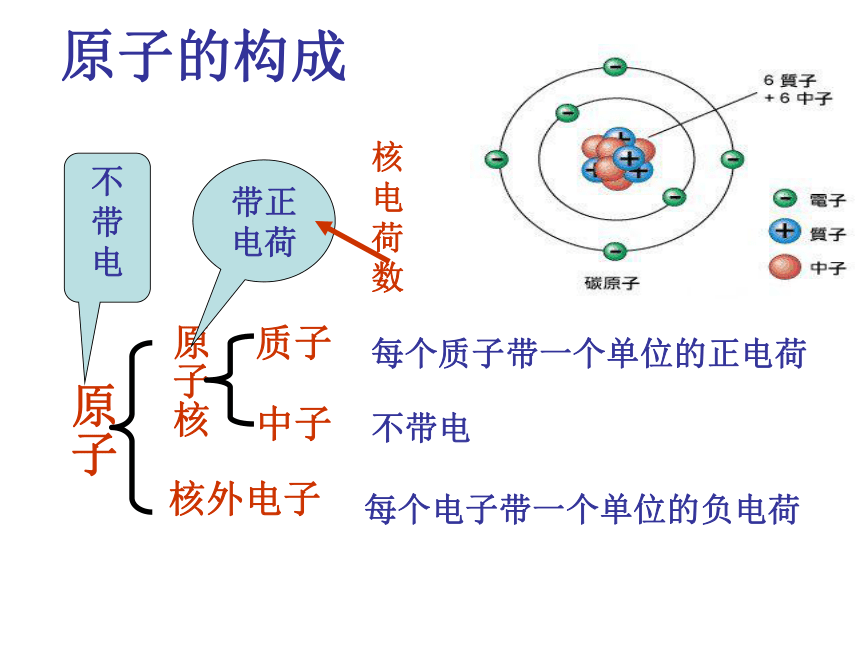
原子
原子核
质子
中子
核外电子
每个质子带一个单位的正电荷
不带电
每个电子带一个单位的负电荷
原子的构成
带正
电荷
不
带
电
核
电
荷
数
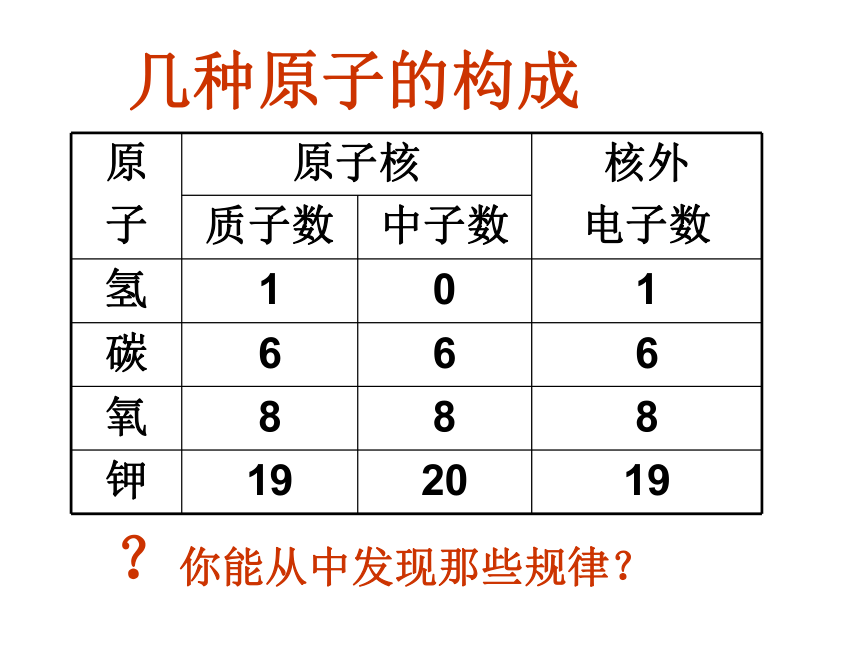
几种原子的构成
原
子 原子核 核外
电子数
质子数 中子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钾 19 20 19
?你能从中发现那些规律?
原子结构中的规律
1.构成原子的粒子有:
质子、中子、电子。
2.在原子中:
核电荷数=质子数=核外电子数
3.质子数不一定等于中子数
4.不是所有的原子都含有中子
5.质子数不同,原子种类不同
核外电子
8
原子核
中子
8
质子
8
以氧气为例描述物质的构成
氧 气
氧分子
氧原子
核外电子的分层排布
一 二 三 四 五 六 七
电子层
离核远近
能量高低
近
远
低
高
核外电子的分层排布
电子经常
活动的区域
电子层
原子核
1. 核外电子总是优先排布在能量最低
的电子层上,能量低的电子层排满后才
能排布在能量较高的电子层上;
2. 每个电子层上最多容纳2n2个电子
(n电子层数)
3. 最外层电子部不超过8个,第一层不
超过2个。次外层不超过18个。
各层电子排布规律
原子核
电子层
层内电子数
2
2
8
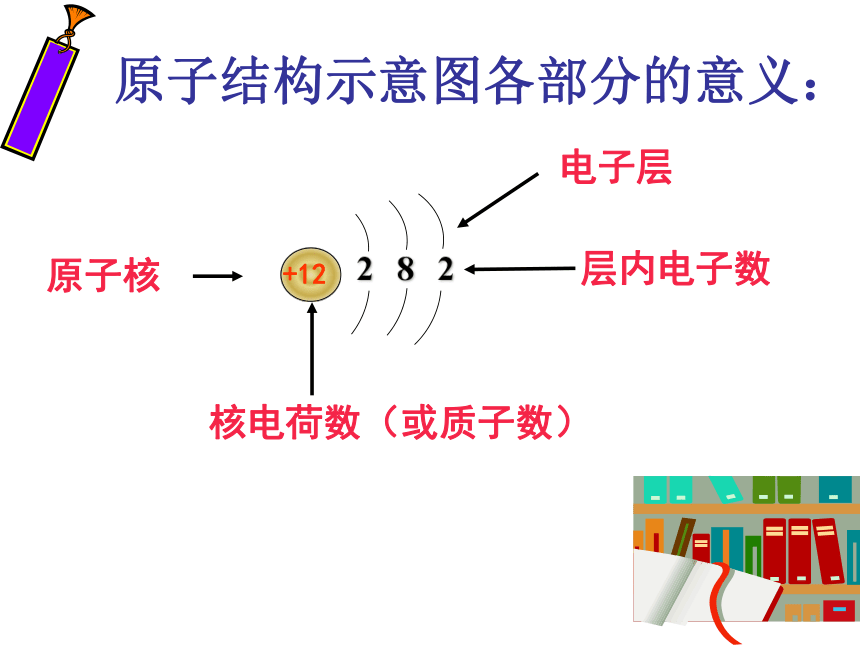
核电荷数(或质子数)
+12
原子结构示意图各部分的意义:
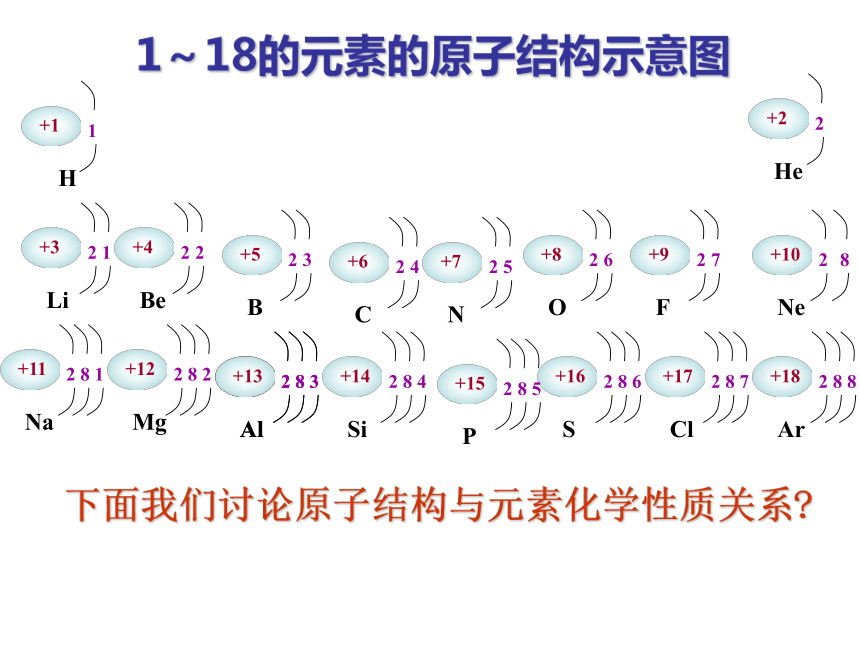
1~18的元素的原子结构示意图
2
+2
He
1
+1
H
2
+8
O
6
2
+7
N
5
2
+3
Li
1
2
+6
C
4
2
+5
B
3
2
+4
Be
2
2
+12
Mg
8
2
2
+13
Al
3
8
1
2
+11
Na
8
2
+9
F
7
2
+10
Ne
8
2
+16
S
6
8
2
+15
P
8
5
2
+14
Si
8
4
2
+17
Cl
8
7
2
+18
Ar
8
8
2
+13
Al
3
8
下面我们讨论原子结构与元素化学性质关系
2
+2
He
2
+10
Ne
8
2
+18
Ar
8
8
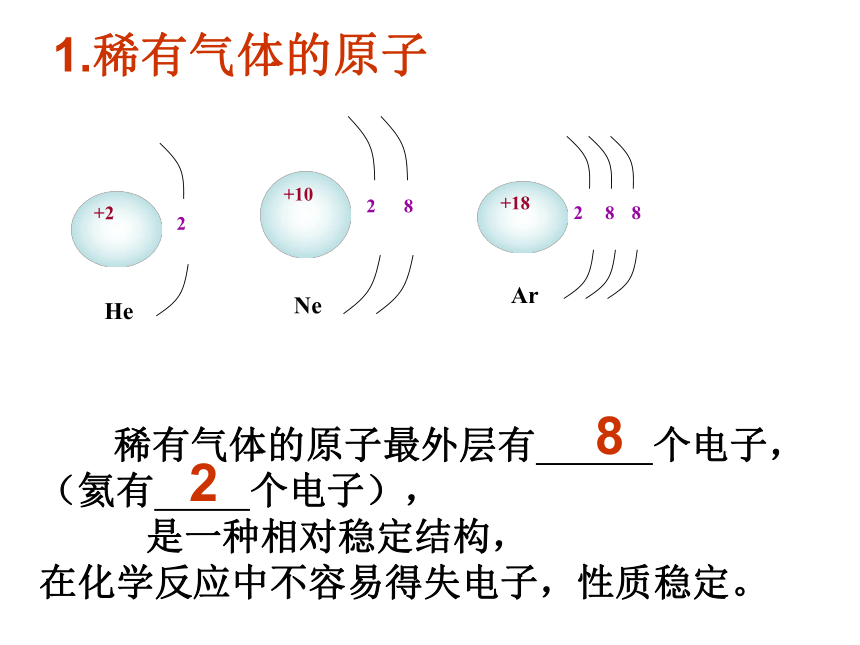
1.稀有气体的原子
稀有气体的原子最外层有 个电子,
(氦有 个电子),
是一种相对稳定结构,
在化学反应中不容易得失电子,性质稳定。
8
2
2.金属元素的原子
2
+3
Li
1
2
+4
Be
2
2
+12
Mg
8
2
1
2
+11
Na
8
2
+13
Al
3
8
金属元素的原子最外层电子数
一般 4个,
在化学反应中一般容易 电子,
性质不稳定。
少于
失
3.非金属元素的原子
非金属的原子最外层电子数一般
都 4个,
在化学反应中,容易 电子,
性质不稳定。
1
+1
H
2
+8
O
6
2
+7
N
5
2
+6
C
4
2
+5
B
3
2
+9
F
7
2
+16
S
6
8
2
+15
P
8
5
2
+14
Si
8
4
2
+17
Cl
8
7
多于
得
原子结构与元素化学性质的关系
原子
分类 最外层
电子数 结 构
稳定性 化 学
性 质
稀有
气体
金属
原子
非金属
原子
8个
(He为2个)
相对稳定
结构
不易得失电子
性质稳定
一般
少于4个
不稳定
结构
易失电子
性质活泼
一般大于或
等于4个
不稳定
结构
易得电子
性质活泼
元素的
化学性
质决于
原子的
最外层
电子数
通过本节课的学习,
谈谈你有什么收获
1.原子的构成
2.原子核外电子的排布
3.原子结构与化学性质的关系
原子
原子核
质子
中子
核外电子
规律
电子由内往外依次填充
各层最多容纳2n2个
第一层≦2个,最外层≦8个
2).金属原子最外层小于4个,易失电子;
3).非金属原子最外层一般大于4个,易得电子。
1).稀有气体最外层都有8个电子,(He2个)
性质稳定;
1.下列说法中错误的是 ( )
A 原子呈电中性,由原子核和核外电子构成
B原子核都是由质子和中子构成
C 核外电子是由内往外分层排布的
D原子中核电荷数=质子数=核外电子数
B
2. 下图所示某原子的核电荷数为 ,
核外有 个电子层,第二层上
有 个电子,最外层上有 个
电子,在化学反应中改原子容易 电子。
2
+13
Al
3
8
继续闯关
13
3
8
3
失
3.溴的原子结构示意图如下,试回答:
1)X的值为 ,
2)溴元素的化学性质与下列哪种元素
的化学性质最相似 ( )
Br
2
+12
Mg
8
2
A
2
+7
N
5
B
2
+17
Cl
8
7
C
2
+16
S
6
8
D
35
C
2).金属原子最外层小于4个,易失电子;
3).非金属原子最外层一般大于4个,易得电子。
1).稀有气体最外层都有8个电子,(He2个)
性质稳定;
元素的化学性质有原子的最外层电子数决定
金属原子失电子后
质子数 核外电子数,
带 电荷;
非金属原子得电子后
质子数 核外电子数,
带 电荷。
大于
正
小于
负
离子
概念
种
类
带电的原子(原子团)叫离子
离子
阴离子
阳离子
带正电荷的原子(原子团)
如:K+ NH4+ 等
带负电荷的原子(原子团)
如:Cl- OH- 等
离子的形成
原子
离子
得、失电子
失、得电子
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
+17
8
8
2
Na+
Cl-
Na原子核Cl原子
如何形成NaCl
失1e
Na
Cl
Na+
Cl-
失去电子(e-)
得到电子(e-)
静电作用
NaCl
在化学反应中,金属元素的原子
失去最外层电子,质子数大于核外电
子数,使参加反应的原子带上正电荷
形成阳离子,电子层减少一层;
非金属元素的原子得到电子,质子
数小于核外电子数,使参加反应的原
子带上负电荷形成阴离子,电子层数
不变。
离子符号
先写符号,后在符号
右上角标电量和电性
表示方法
离子符号的含义
如: Na+ 、 Cl-、
Rn+或Rn-
2 Mg2+
每个镁离子带两个单位的正电荷
两个镁离子
镁离子
原
子
阴、阳
离子
分子
物
质
构成
构成
构成
直接构成
得失电子
相对原子质量
原子
的真实
质量
原子质量 质 量(Kg)
氢 1.67×10-27
氧 2.657×10-26
铁 9.288×10-26
原子质量太小,书写和使用极不方便。
国际上采用相对质量
以一种碳原子质量的1/12
为标准,其他原子的质量跟
他相比较所得的比,作为这
种原子的相对原子质量。
概念
计算公式
相对原子质量
=
一种碳原子质量的1/12
一个R原子的真实质量
如:
一个氧原子的相对质量 =
2.657×10-26 Kg
1.993×10-26 Kg×1/12
= 16
单位和符号
单位
相对原子质量是一 个比值,其国际
单位为“1”,一般省略不写。
符号: Ar
相对原子质量的近似计算
相对原子质量 ≈ 质子数 + 中子数
你应该知道
一、离子
二、相对原子质量
以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,就是这种原子的相对原子质量。
1)相对原子质量 =
某种原子的质量
一种碳原子质量×1/12
2) 相对原子质量 ≈ 质子数 + 中子数
概念
离子符号及含义
离子的形成
离子的种类
2.计算公式
1.概念
1.下图是几种粒子的结构示意图,有关
它们的说法正确的是 ( )
A 它们的最外层电子数相同
B 它们核外都有两个电子层
C 它们都属于同种粒子
D 它们都是原子
2
+10
8
2
+17
8
8
2
+8
8
2
+13
8
A
继续闯关
2.对某种离子变成原子
的下列分析判断中,
正确的是 ( )
A 一定失去电子
B 一定得到电子
C得、失电子都有可能
D既不得电子,也不失电子
C
3.已知质子数和中子数都是6的
碳原子的质量为aKg,m个A原
子的质量为bKg,则该原子的
相对原子质量为 ( )
A 12b/a B 12a/b
C b/a D 12b/ma
D
4.一个碳12原子的质量为1.993×10-26 Kg,
钙的相对原子质量为40,则一个钙原子的实
际质量是多少?
相对原子质量 =
某种原子的质量
一种碳原子质量×1/12
一个钙原子的实际质量 =
钙的相对原子质量 ×
一种碳原子质量×1/12
分析
一个钙原子的实际质量= 40× 1.993×10-26 Kg ≈ 6.64×10-26 Kg
知识回顾
1.原子是构成物质的一种粒子,
可构成分子,也可直接构成物质;
2.原子质量和体积都很小,
在不断运动,原子之间有间隔;
3.原子是化学变化中的最小粒子,
在化学变化中不可再分。
原子在化学变化中不可再分,
原子是否可以再分呢?
科学实验证明:
原子有复杂的结构,可以再分。
原子结构
示意图
原子
原子核
质子
中子
核外电子
每个质子带一个单位的正电荷
不带电
每个电子带一个单位的负电荷
原子的构成
带正
电荷
不
带
电
核
电
荷
数
几种原子的构成
原
子 原子核 核外
电子数
质子数 中子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钾 19 20 19
?你能从中发现那些规律?
原子结构中的规律
1.构成原子的粒子有:
质子、中子、电子。
2.在原子中:
核电荷数=质子数=核外电子数
3.质子数不一定等于中子数
4.不是所有的原子都含有中子
5.质子数不同,原子种类不同
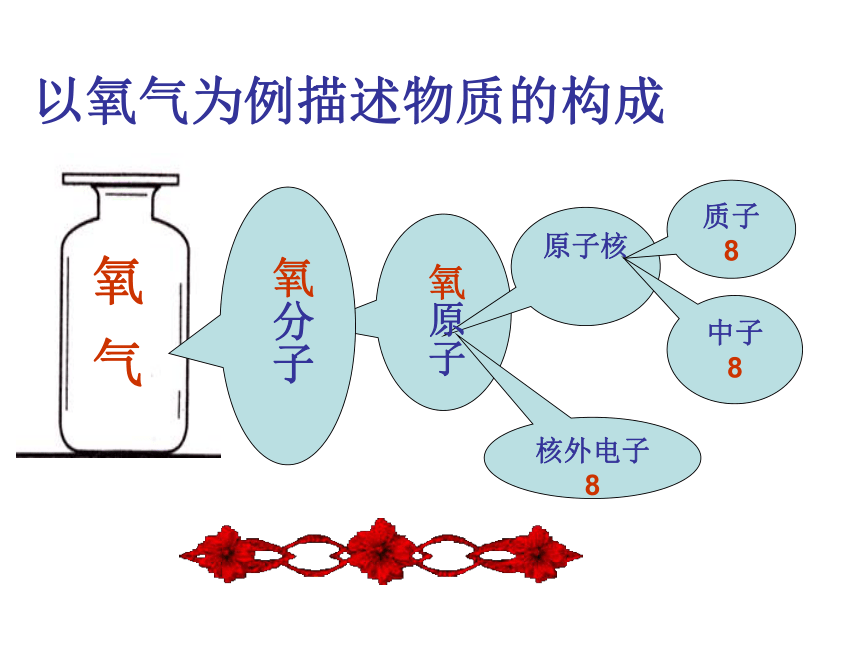
核外电子
8
原子核
中子
8
质子
8
以氧气为例描述物质的构成
氧 气
氧分子
氧原子
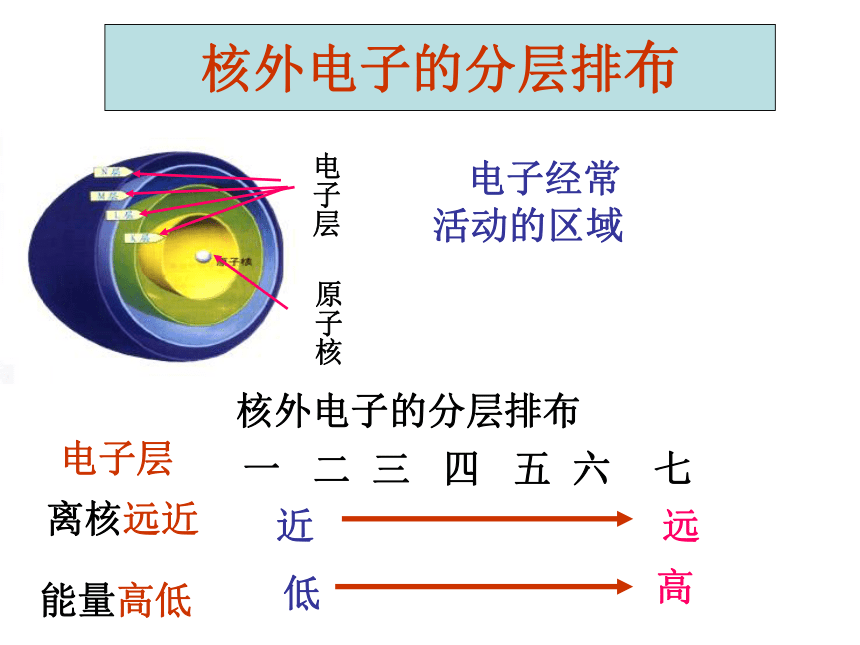
核外电子的分层排布
一 二 三 四 五 六 七
电子层
离核远近
能量高低
近
远
低
高
核外电子的分层排布
电子经常
活动的区域
电子层
原子核
1. 核外电子总是优先排布在能量最低
的电子层上,能量低的电子层排满后才
能排布在能量较高的电子层上;
2. 每个电子层上最多容纳2n2个电子
(n电子层数)
3. 最外层电子部不超过8个,第一层不
超过2个。次外层不超过18个。
各层电子排布规律
原子核
电子层
层内电子数
2
2
8
核电荷数(或质子数)
+12
原子结构示意图各部分的意义:
1~18的元素的原子结构示意图
2
+2
He
1
+1
H
2
+8
O
6
2
+7
N
5
2
+3
Li
1
2
+6
C
4
2
+5
B
3
2
+4
Be
2
2
+12
Mg
8
2
2
+13
Al
3
8
1
2
+11
Na
8
2
+9
F
7
2
+10
Ne
8
2
+16
S
6
8
2
+15
P
8
5
2
+14
Si
8
4
2
+17
Cl
8
7
2
+18
Ar
8
8
2
+13
Al
3
8
下面我们讨论原子结构与元素化学性质关系
2
+2
He
2
+10
Ne
8
2
+18
Ar
8
8
1.稀有气体的原子
稀有气体的原子最外层有 个电子,
(氦有 个电子),
是一种相对稳定结构,
在化学反应中不容易得失电子,性质稳定。
8
2
2.金属元素的原子
2
+3
Li
1
2
+4
Be
2
2
+12
Mg
8
2
1
2
+11
Na
8
2
+13
Al
3
8
金属元素的原子最外层电子数
一般 4个,
在化学反应中一般容易 电子,
性质不稳定。
少于
失
3.非金属元素的原子
非金属的原子最外层电子数一般
都 4个,
在化学反应中,容易 电子,
性质不稳定。
1
+1
H
2
+8
O
6
2
+7
N
5
2
+6
C
4
2
+5
B
3
2
+9
F
7
2
+16
S
6
8
2
+15
P
8
5
2
+14
Si
8
4
2
+17
Cl
8
7
多于
得
原子结构与元素化学性质的关系
原子
分类 最外层
电子数 结 构
稳定性 化 学
性 质
稀有
气体
金属
原子
非金属
原子
8个
(He为2个)
相对稳定
结构
不易得失电子
性质稳定
一般
少于4个
不稳定
结构
易失电子
性质活泼
一般大于或
等于4个
不稳定
结构
易得电子
性质活泼
元素的
化学性
质决于
原子的
最外层
电子数
通过本节课的学习,
谈谈你有什么收获
1.原子的构成
2.原子核外电子的排布
3.原子结构与化学性质的关系
原子
原子核
质子
中子
核外电子
规律
电子由内往外依次填充
各层最多容纳2n2个
第一层≦2个,最外层≦8个
2).金属原子最外层小于4个,易失电子;
3).非金属原子最外层一般大于4个,易得电子。
1).稀有气体最外层都有8个电子,(He2个)
性质稳定;
1.下列说法中错误的是 ( )
A 原子呈电中性,由原子核和核外电子构成
B原子核都是由质子和中子构成
C 核外电子是由内往外分层排布的
D原子中核电荷数=质子数=核外电子数
B
2. 下图所示某原子的核电荷数为 ,
核外有 个电子层,第二层上
有 个电子,最外层上有 个
电子,在化学反应中改原子容易 电子。
2
+13
Al
3
8
继续闯关
13
3
8
3
失
3.溴的原子结构示意图如下,试回答:
1)X的值为 ,
2)溴元素的化学性质与下列哪种元素
的化学性质最相似 ( )
Br
2
+12
Mg
8
2
A
2
+7
N
5
B
2
+17
Cl
8
7
C
2
+16
S
6
8
D
35
C
2).金属原子最外层小于4个,易失电子;
3).非金属原子最外层一般大于4个,易得电子。
1).稀有气体最外层都有8个电子,(He2个)
性质稳定;
元素的化学性质有原子的最外层电子数决定
金属原子失电子后
质子数 核外电子数,
带 电荷;
非金属原子得电子后
质子数 核外电子数,
带 电荷。
大于
正
小于
负
离子
概念
种
类
带电的原子(原子团)叫离子
离子
阴离子
阳离子
带正电荷的原子(原子团)
如:K+ NH4+ 等
带负电荷的原子(原子团)
如:Cl- OH- 等
离子的形成
原子
离子
得、失电子
失、得电子
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
+17
8
8
2
Na+
Cl-
Na原子核Cl原子
如何形成NaCl
失1e
Na
Cl
Na+
Cl-
失去电子(e-)
得到电子(e-)
静电作用
NaCl
在化学反应中,金属元素的原子
失去最外层电子,质子数大于核外电
子数,使参加反应的原子带上正电荷
形成阳离子,电子层减少一层;
非金属元素的原子得到电子,质子
数小于核外电子数,使参加反应的原
子带上负电荷形成阴离子,电子层数
不变。
离子符号
先写符号,后在符号
右上角标电量和电性
表示方法
离子符号的含义
如: Na+ 、 Cl-、
Rn+或Rn-
2 Mg2+
每个镁离子带两个单位的正电荷
两个镁离子
镁离子
原
子
阴、阳
离子
分子
物
质
构成
构成
构成
直接构成
得失电子
相对原子质量
原子
的真实
质量
原子质量 质 量(Kg)
氢 1.67×10-27
氧 2.657×10-26
铁 9.288×10-26
原子质量太小,书写和使用极不方便。
国际上采用相对质量
以一种碳原子质量的1/12
为标准,其他原子的质量跟
他相比较所得的比,作为这
种原子的相对原子质量。
概念
计算公式
相对原子质量
=
一种碳原子质量的1/12
一个R原子的真实质量
如:
一个氧原子的相对质量 =
2.657×10-26 Kg
1.993×10-26 Kg×1/12
= 16
单位和符号
单位
相对原子质量是一 个比值,其国际
单位为“1”,一般省略不写。
符号: Ar
相对原子质量的近似计算
相对原子质量 ≈ 质子数 + 中子数
你应该知道
一、离子
二、相对原子质量
以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,就是这种原子的相对原子质量。
1)相对原子质量 =
某种原子的质量
一种碳原子质量×1/12
2) 相对原子质量 ≈ 质子数 + 中子数
概念
离子符号及含义
离子的形成
离子的种类
2.计算公式
1.概念
1.下图是几种粒子的结构示意图,有关
它们的说法正确的是 ( )
A 它们的最外层电子数相同
B 它们核外都有两个电子层
C 它们都属于同种粒子
D 它们都是原子
2
+10
8
2
+17
8
8
2
+8
8
2
+13
8
A
继续闯关
2.对某种离子变成原子
的下列分析判断中,
正确的是 ( )
A 一定失去电子
B 一定得到电子
C得、失电子都有可能
D既不得电子,也不失电子
C
3.已知质子数和中子数都是6的
碳原子的质量为aKg,m个A原
子的质量为bKg,则该原子的
相对原子质量为 ( )
A 12b/a B 12a/b
C b/a D 12b/ma
D
4.一个碳12原子的质量为1.993×10-26 Kg,
钙的相对原子质量为40,则一个钙原子的实
际质量是多少?
相对原子质量 =
某种原子的质量
一种碳原子质量×1/12
一个钙原子的实际质量 =
钙的相对原子质量 ×
一种碳原子质量×1/12
分析
一个钙原子的实际质量= 40× 1.993×10-26 Kg ≈ 6.64×10-26 Kg
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
