8.2.2 金属的活动性顺序(课件25页)
文档属性
| 名称 | 8.2.2 金属的活动性顺序(课件25页) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-21 17:06:40 | ||
图片预览







文档简介
(共25张PPT)
第八单元 课题2 金属的化学性质
课时2金属的活动性顺序
前面我们在第五单元课题1学习到将铁钉投入到硫酸铜溶液中发生了什么现象?
现象:铁钉表面有红色固体,溶液由蓝色变成浅绿色。
该反应的化学方程式:
Fe + CuSO4==== Cu + FeSO4
活动性强的金属可以把活动性弱的金属从它的化合物溶液中置换出来。
问题导入
1.探究铝和铜、银和铜的金属活动性强弱;
2.知道金属活动性顺序,会应用金属活动性顺序。
学习目标
一、金属活动性顺序
观察与思考:
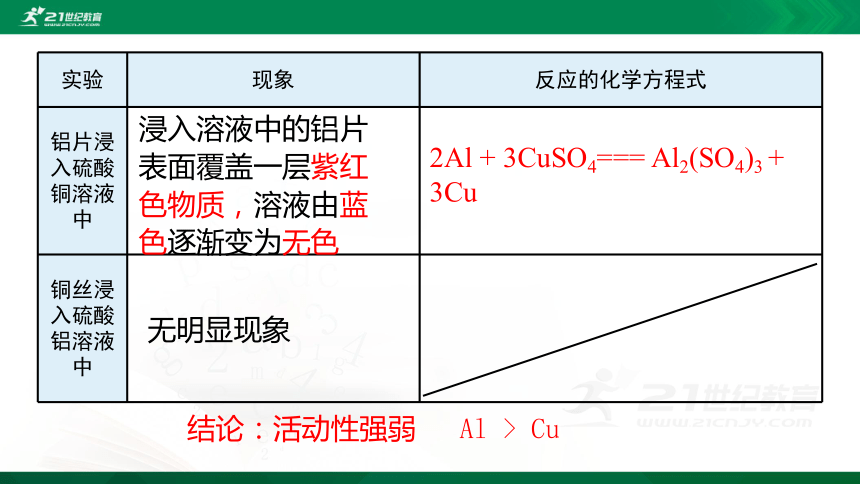
1.设计实验判断Al和Cu的活动性强弱
实验药品:
铝片、铜丝、硫酸铝溶液、硫酸铜溶液
( Al 、 Cu 、 Al2(SO4)3 、 CuSO4 )
探究新知
实验 现象 反应的化学方程式
铝片浸入硫酸铜溶液中
铜丝浸入硫酸铝溶液中
浸入溶液中的铝片
表面覆盖一层紫红
色物质,溶液由蓝
色逐渐变为无色
无明显现象
2Al + 3CuSO4=== Al2(SO4)3 + 3Cu
结论:活动性强弱 Al > Cu
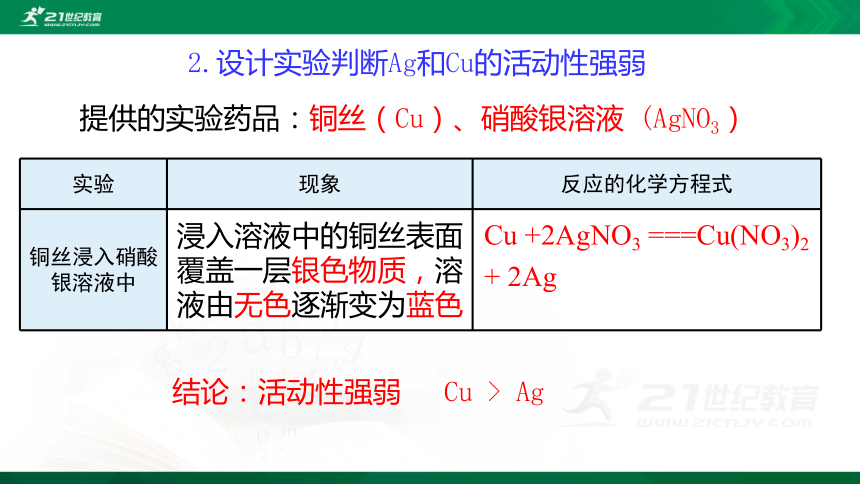
2.设计实验判断Ag和Cu的活动性强弱
提供的实验药品:铜丝(Cu)、硝酸银溶液 (AgNO3)
实验 现象 反应的化学方程式
铜丝浸入硝酸银溶液中
浸入溶液中的铜丝表面覆盖一层银色物质,溶液由无色逐渐变为蓝色
Cu +2AgNO3 ===Cu(NO3)2
+ 2Ag
结论:活动性强弱 Cu > Ag
交流与讨论:
通过上述探究,你能得出铁、铜、银的金属活动性顺序吗?
Fe Cu Ag
金属活动性:强 弱
三种金属活动性大小比较实验方案设计
方法一:“两金夹一盐”。即选用三种金属中活动性最强和最弱的两种金属的单质及活动性介于两种金属之间的金属盐溶液作为试剂,根据两种金属单质分别与盐溶液反应的情况进行判断。
方法二:“两盐夹一金”。即选用三种金属中活动性排在中间的金属单质及其他两种金属的盐溶液作为试剂,根据金属单质分别与两种盐溶液反应的情况进行判断。
下列可用于验证Fe、Cu、Ag三种金属的活动性顺序的一组药品是( )
A. Fe、Cu、H2SO4溶液 B. Cu、Ag、FeSO4溶液
C. Fe、Ag、CuSO4溶液 D. Ag、FeSO4溶液、CuSO4溶液
C
归纳与讨论:
金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
注意:钾钙钠,要除外。
学以致用
1.可否用铁桶盛放硫酸铜溶液?或者说:能否用铁桶配制农药波尔多液?(配制波尔多液时用到硫酸铜溶液)
Fe +CuSO4====Cu+FeSO4
2.判断下列各组物质能否发生反应?
(1)铁和硫酸锌溶液
(2)锌和硫酸铜溶液
(3)银和硫酸铜溶液
(4)铁和氯化银
不反应
反应
不反应
不反应
难溶物
3.有X、 Y 、Z三种金属,如果把X和Y分别放入稀盐酸中,Y溶解并产生氢气,X不反应;如果把X和Z分别放入硝酸铜溶液中,过一会儿,在X的表面有银析出,而Z无变化。根据以上事实,判断X Y Z的金属活动顺序。
答案: 金属活动性顺序 Y>X>Z
金属与酸反应的计算及图表题分析
(1)酸不足,产生氢气的质量由酸的质量决定。
即Mg、Al、Zn三种金属与等质量、等溶质质量分数的稀盐酸充分反应后,金属均有剩余时,产生氢气的质量一定相等。如图1所示。
(2)酸足量,产生氢气的质量由金属的质量决定,根据反应的化学方程式可知:金属与酸反应生成氢气质量
的计算公式为生成氢气质量 = ×金属质量
a.等质量的不同种金属与足量酸反应时, 的值越大,产生H2的质量越大。如图2所示。
b. 若用Mg、Al、Zn和足量的酸反应产生等质量的H2,消耗金属的质量为Zn>Mg>Al。
(3)极值法计算金属混合物与酸反应生成氢气质量
先假设一定质量的金属为某一金属,然后推断其生成H2的质量的可能范围,再与题目所给氢气质量相比较进行分析判断即可。
1.金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
2.判断金属活动性的方法
(1)金属与酸反应的剧烈程度
(2)金属能否与其他金属化合物的溶液反应
课堂小结
金属的化学性质:
1.与氧气反应
2.与稀盐酸(稀硫酸)反应
(金属越活泼,反应越容易,越剧烈)
◆ 置换反应
A+BC===B+AC
◆ 金属活动性
Mg > Zn > Fe > (H)> Cu
课堂小结
1.分别向放有铁丝和铜丝的两支试管中加入下列溶液,不能证明铁和铜金属活动性强弱的是( )
A.稀硫酸 B.FeSO4溶液
C.CuSO4溶液 D.AgNO3溶液
2.“以曾青CuSO4涂铁,铁赤色如铜”出自西晋葛洪编写的炼丹术《抱朴子》。下列有关说法不正确的是( )
A.曾青的主要成分属于化合物 B.该反应能证明铁比铜活泼
C.硫酸铁不是该反应的生成物 D.反应后溶液的质量增重
D
D
课堂练习
3.已知锰的金属活动性位于铝和锌之间。下列化学反应不能发生的是( )
A.Fe+MnSO4=== FeSO4+Mn
B.Mg+MnSO4=== MgSO4+Mn
C.Mn+2HCl=== MnCl2+H2↑
D.Mn+CuSO4=== MnSO4+Cu
4.向含有AgNO3、Zn(NO3)2的混合溶液中加入一定量的铜粉,充分反应后,过滤,向滤液中滴入NaCl溶液,有白色沉淀产生。则下列对滤渣和滤液成分的判断中,正确的是( )
A.滤渣中只有Cu和Ag B.滤渣中只有单质Ag
C.滤液中只有Cu2+和Zn2+ D.滤液中只有Ag+和Zn2+
A
B
5.小丽为确认所回收易拉罐的主要成分是铝还是铁,剪取金属片打磨后,设计了如两种不同方法进行检验,这样设计的理由是( )
A.铁、铝有不同的物理性质
B.活泼金属易与氧气反应
C.排在前面的金属可以把酸中的氢置换出来
D.活动性较强的金属可把活动性较弱的金属从它的化合物溶液中置换出来
D
6.将金属锰(Mn)投入稀盐酸中,有气泡产生。将镁条插入硫酸锰溶液中,如果有锰析出,则Mn、Mg、Cu的金属活泼性由强到弱的顺序是( )
A.Mg、Mn、Cu B.Mn、Mg、Cu
C.Cu、Mg、Mn D.Cu、Mn、Mg
7.某同学探究 X、Y、Z三种金属的活动性顺序,做了以下实验: (1)取样,分别加入到 CuSO4 溶液中,发现 X、Z表面出现红色物质而 Y 却没有;(2)取 X、Z大小相等的颗粒,分别加入到溶质质量分数相等的稀 H2SO4 中,发现 X表面产生气泡的速度明显比Z快。则 X、Y、Z的金属活动性由强到弱依次是( )
A.X>Z>Y B.Z>Y>X C.X>Y>Z D.Z>X>Y
A
A
8.回收含铜废料(主要成分为Cu)中的铜,部分实验流程如下:
注:灼烧后得到黑色固体和残留物,残留物不溶于水和稀硫酸。
下列关于该流程的说法,错误的是( )
A.“灼烧”的主要目的是将Cu转变为CuO
B.滤液X中的溶质为FeSO4
C.“酸溶”和“还原”过程中发生的反应均为置换反应
D.将Cu、Fe混合物加入足量稀硫酸中,充分反应后过滤得Cu
C
9.为验证铁、铜、银的金属活动性顺序,某同学设计了以下四组实验。下列说法错误的是( )
A.通过实验①、②,能验证金属活动性:Fe>Cu
B.通过实验①、②、③,能验证金属活动性:Fe>Cu>Ag
C.实验④中X为Cu,Y为FeSO4溶液,能验证金属活动性:Fe>Cu
D.实验④中X为Cu,Y为AgNO3溶液,能验证金属活动性:Cu>Ag
B
B
10.将一定量的铝粉投入到含溶质为Mg(NO3)2、Cu(NO3)2、AgNO3的溶液中,充分反应后过滤,滤液无色;向滤渣中滴加稀盐酸,无明显现象。下列说法错误的是( )
A.滤渣中一定有Ag、Cu
B.滤渣中一定有Ag,可能有Cu,没有Mg
C.滤液中一定没有Cu(NO3)2、AgNO3
D.滤液中一定有Al(NO3)3、Mg(NO3)2
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第八单元 课题2 金属的化学性质
课时2金属的活动性顺序
前面我们在第五单元课题1学习到将铁钉投入到硫酸铜溶液中发生了什么现象?
现象:铁钉表面有红色固体,溶液由蓝色变成浅绿色。
该反应的化学方程式:
Fe + CuSO4==== Cu + FeSO4
活动性强的金属可以把活动性弱的金属从它的化合物溶液中置换出来。
问题导入
1.探究铝和铜、银和铜的金属活动性强弱;
2.知道金属活动性顺序,会应用金属活动性顺序。
学习目标
一、金属活动性顺序
观察与思考:
1.设计实验判断Al和Cu的活动性强弱
实验药品:
铝片、铜丝、硫酸铝溶液、硫酸铜溶液
( Al 、 Cu 、 Al2(SO4)3 、 CuSO4 )
探究新知
实验 现象 反应的化学方程式
铝片浸入硫酸铜溶液中
铜丝浸入硫酸铝溶液中
浸入溶液中的铝片
表面覆盖一层紫红
色物质,溶液由蓝
色逐渐变为无色
无明显现象
2Al + 3CuSO4=== Al2(SO4)3 + 3Cu
结论:活动性强弱 Al > Cu
2.设计实验判断Ag和Cu的活动性强弱
提供的实验药品:铜丝(Cu)、硝酸银溶液 (AgNO3)
实验 现象 反应的化学方程式
铜丝浸入硝酸银溶液中
浸入溶液中的铜丝表面覆盖一层银色物质,溶液由无色逐渐变为蓝色
Cu +2AgNO3 ===Cu(NO3)2
+ 2Ag
结论:活动性强弱 Cu > Ag
交流与讨论:
通过上述探究,你能得出铁、铜、银的金属活动性顺序吗?
Fe Cu Ag
金属活动性:强 弱
三种金属活动性大小比较实验方案设计
方法一:“两金夹一盐”。即选用三种金属中活动性最强和最弱的两种金属的单质及活动性介于两种金属之间的金属盐溶液作为试剂,根据两种金属单质分别与盐溶液反应的情况进行判断。
方法二:“两盐夹一金”。即选用三种金属中活动性排在中间的金属单质及其他两种金属的盐溶液作为试剂,根据金属单质分别与两种盐溶液反应的情况进行判断。
下列可用于验证Fe、Cu、Ag三种金属的活动性顺序的一组药品是( )
A. Fe、Cu、H2SO4溶液 B. Cu、Ag、FeSO4溶液
C. Fe、Ag、CuSO4溶液 D. Ag、FeSO4溶液、CuSO4溶液
C
归纳与讨论:
金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
注意:钾钙钠,要除外。
学以致用
1.可否用铁桶盛放硫酸铜溶液?或者说:能否用铁桶配制农药波尔多液?(配制波尔多液时用到硫酸铜溶液)
Fe +CuSO4====Cu+FeSO4
2.判断下列各组物质能否发生反应?
(1)铁和硫酸锌溶液
(2)锌和硫酸铜溶液
(3)银和硫酸铜溶液
(4)铁和氯化银
不反应
反应
不反应
不反应
难溶物
3.有X、 Y 、Z三种金属,如果把X和Y分别放入稀盐酸中,Y溶解并产生氢气,X不反应;如果把X和Z分别放入硝酸铜溶液中,过一会儿,在X的表面有银析出,而Z无变化。根据以上事实,判断X Y Z的金属活动顺序。
答案: 金属活动性顺序 Y>X>Z
金属与酸反应的计算及图表题分析
(1)酸不足,产生氢气的质量由酸的质量决定。
即Mg、Al、Zn三种金属与等质量、等溶质质量分数的稀盐酸充分反应后,金属均有剩余时,产生氢气的质量一定相等。如图1所示。
(2)酸足量,产生氢气的质量由金属的质量决定,根据反应的化学方程式可知:金属与酸反应生成氢气质量
的计算公式为生成氢气质量 = ×金属质量
a.等质量的不同种金属与足量酸反应时, 的值越大,产生H2的质量越大。如图2所示。
b. 若用Mg、Al、Zn和足量的酸反应产生等质量的H2,消耗金属的质量为Zn>Mg>Al。
(3)极值法计算金属混合物与酸反应生成氢气质量
先假设一定质量的金属为某一金属,然后推断其生成H2的质量的可能范围,再与题目所给氢气质量相比较进行分析判断即可。
1.金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
2.判断金属活动性的方法
(1)金属与酸反应的剧烈程度
(2)金属能否与其他金属化合物的溶液反应
课堂小结
金属的化学性质:
1.与氧气反应
2.与稀盐酸(稀硫酸)反应
(金属越活泼,反应越容易,越剧烈)
◆ 置换反应
A+BC===B+AC
◆ 金属活动性
Mg > Zn > Fe > (H)> Cu
课堂小结
1.分别向放有铁丝和铜丝的两支试管中加入下列溶液,不能证明铁和铜金属活动性强弱的是( )
A.稀硫酸 B.FeSO4溶液
C.CuSO4溶液 D.AgNO3溶液
2.“以曾青CuSO4涂铁,铁赤色如铜”出自西晋葛洪编写的炼丹术《抱朴子》。下列有关说法不正确的是( )
A.曾青的主要成分属于化合物 B.该反应能证明铁比铜活泼
C.硫酸铁不是该反应的生成物 D.反应后溶液的质量增重
D
D
课堂练习
3.已知锰的金属活动性位于铝和锌之间。下列化学反应不能发生的是( )
A.Fe+MnSO4=== FeSO4+Mn
B.Mg+MnSO4=== MgSO4+Mn
C.Mn+2HCl=== MnCl2+H2↑
D.Mn+CuSO4=== MnSO4+Cu
4.向含有AgNO3、Zn(NO3)2的混合溶液中加入一定量的铜粉,充分反应后,过滤,向滤液中滴入NaCl溶液,有白色沉淀产生。则下列对滤渣和滤液成分的判断中,正确的是( )
A.滤渣中只有Cu和Ag B.滤渣中只有单质Ag
C.滤液中只有Cu2+和Zn2+ D.滤液中只有Ag+和Zn2+
A
B
5.小丽为确认所回收易拉罐的主要成分是铝还是铁,剪取金属片打磨后,设计了如两种不同方法进行检验,这样设计的理由是( )
A.铁、铝有不同的物理性质
B.活泼金属易与氧气反应
C.排在前面的金属可以把酸中的氢置换出来
D.活动性较强的金属可把活动性较弱的金属从它的化合物溶液中置换出来
D
6.将金属锰(Mn)投入稀盐酸中,有气泡产生。将镁条插入硫酸锰溶液中,如果有锰析出,则Mn、Mg、Cu的金属活泼性由强到弱的顺序是( )
A.Mg、Mn、Cu B.Mn、Mg、Cu
C.Cu、Mg、Mn D.Cu、Mn、Mg
7.某同学探究 X、Y、Z三种金属的活动性顺序,做了以下实验: (1)取样,分别加入到 CuSO4 溶液中,发现 X、Z表面出现红色物质而 Y 却没有;(2)取 X、Z大小相等的颗粒,分别加入到溶质质量分数相等的稀 H2SO4 中,发现 X表面产生气泡的速度明显比Z快。则 X、Y、Z的金属活动性由强到弱依次是( )
A.X>Z>Y B.Z>Y>X C.X>Y>Z D.Z>X>Y
A
A
8.回收含铜废料(主要成分为Cu)中的铜,部分实验流程如下:
注:灼烧后得到黑色固体和残留物,残留物不溶于水和稀硫酸。
下列关于该流程的说法,错误的是( )
A.“灼烧”的主要目的是将Cu转变为CuO
B.滤液X中的溶质为FeSO4
C.“酸溶”和“还原”过程中发生的反应均为置换反应
D.将Cu、Fe混合物加入足量稀硫酸中,充分反应后过滤得Cu
C
9.为验证铁、铜、银的金属活动性顺序,某同学设计了以下四组实验。下列说法错误的是( )
A.通过实验①、②,能验证金属活动性:Fe>Cu
B.通过实验①、②、③,能验证金属活动性:Fe>Cu>Ag
C.实验④中X为Cu,Y为FeSO4溶液,能验证金属活动性:Fe>Cu
D.实验④中X为Cu,Y为AgNO3溶液,能验证金属活动性:Cu>Ag
B
B
10.将一定量的铝粉投入到含溶质为Mg(NO3)2、Cu(NO3)2、AgNO3的溶液中,充分反应后过滤,滤液无色;向滤渣中滴加稀盐酸,无明显现象。下列说法错误的是( )
A.滤渣中一定有Ag、Cu
B.滤渣中一定有Ag,可能有Cu,没有Mg
C.滤液中一定没有Cu(NO3)2、AgNO3
D.滤液中一定有Al(NO3)3、Mg(NO3)2
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
同课章节目录
