醇的性质与应用__上课用
图片预览






文档简介
(共40张PPT)
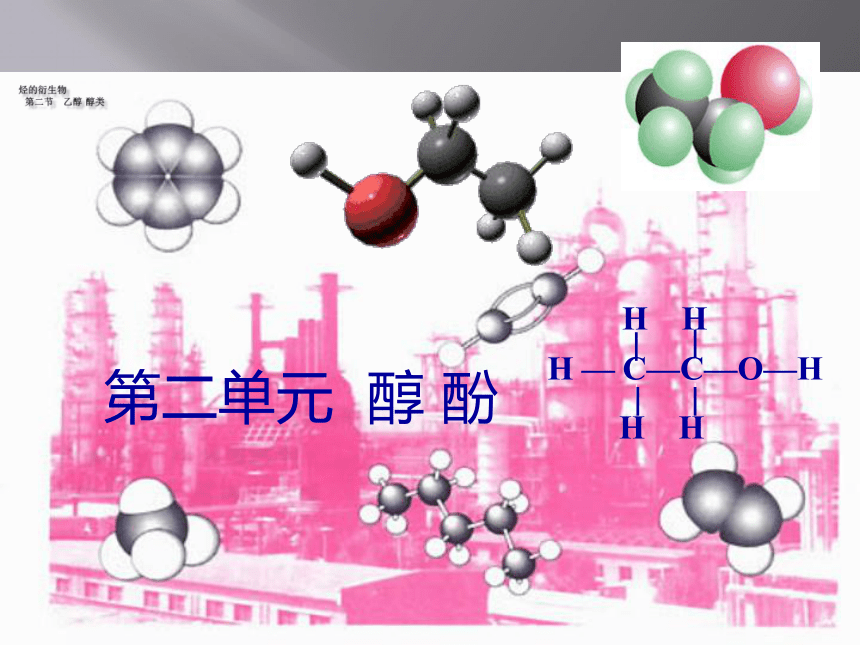
第二单元 醇 酚
H — C—C—O—H
H H
H H
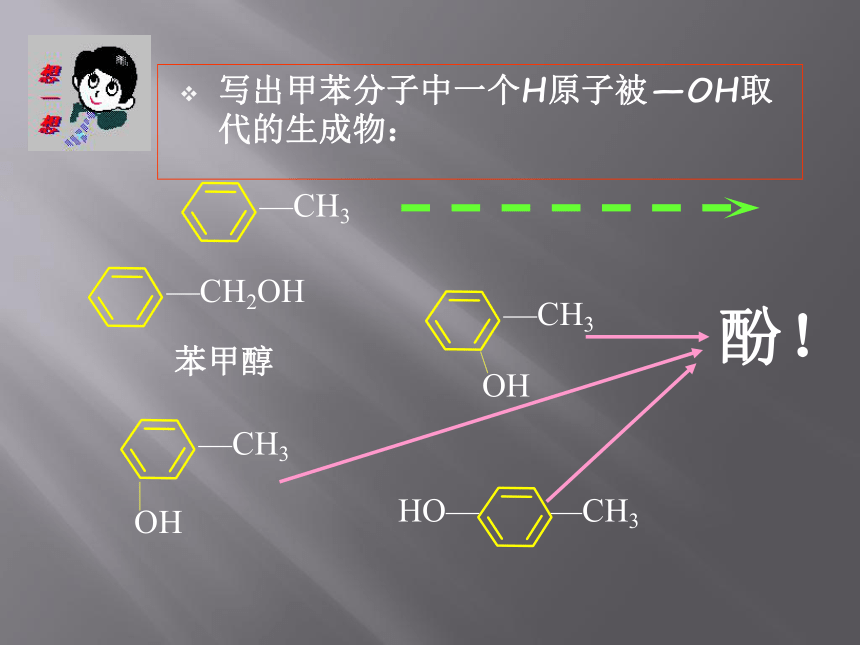
写出甲苯分子中一个H原子被—OH取代的生成物:
苯甲醇
—CH3
—CH2OH
—CH3
OH
OH
—CH3
—CH3
HO—
酚!
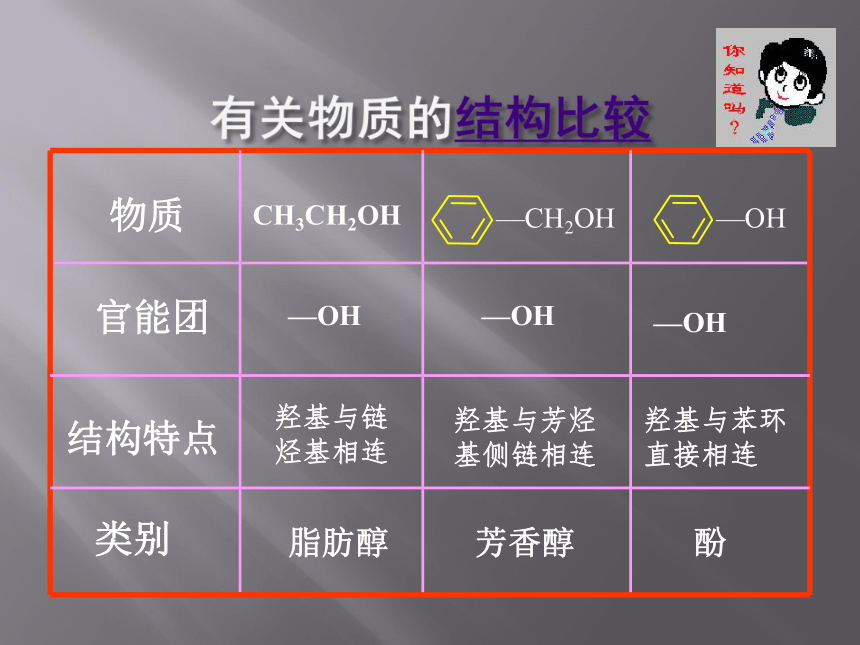
物质
官能团
结构特点
类别
脂肪醇
芳香醇
酚
CH3CH2OH
—OH
—OH
羟基与链烃基相连
羟基与芳烃
基侧链相连
羟基与苯环
直接相连
—OH
—CH2OH
—OH
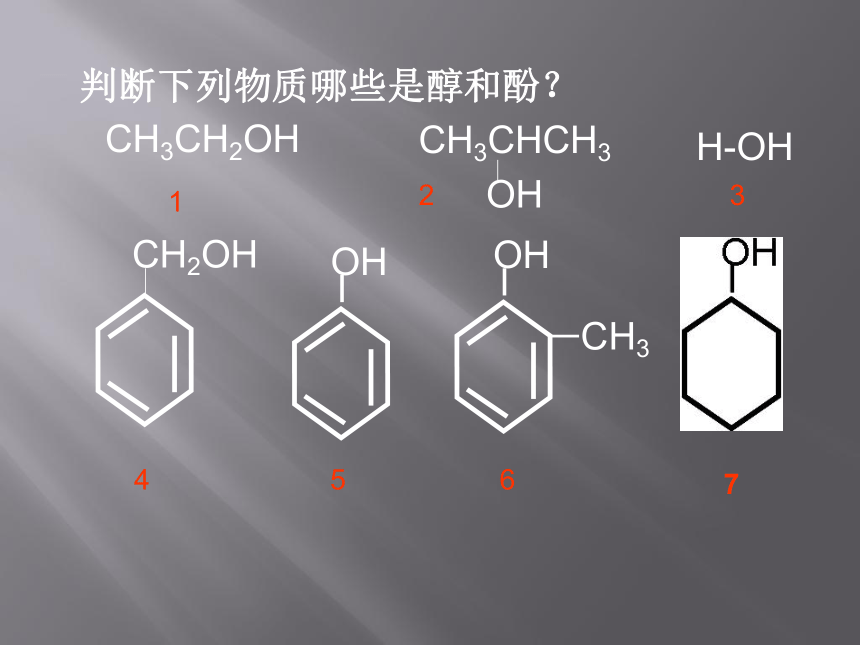
判断下列物质哪些是醇和酚?
CH3CH2OH
CH3CHCH3
OH
CH2OH
OH
OH
CH3
H-OH
1
2
3
4
5
6
7
醇的性质和应用
乙醇俗称酒精,是人类最早制备的有
机物 之一,也是大家相当熟悉的一种醇
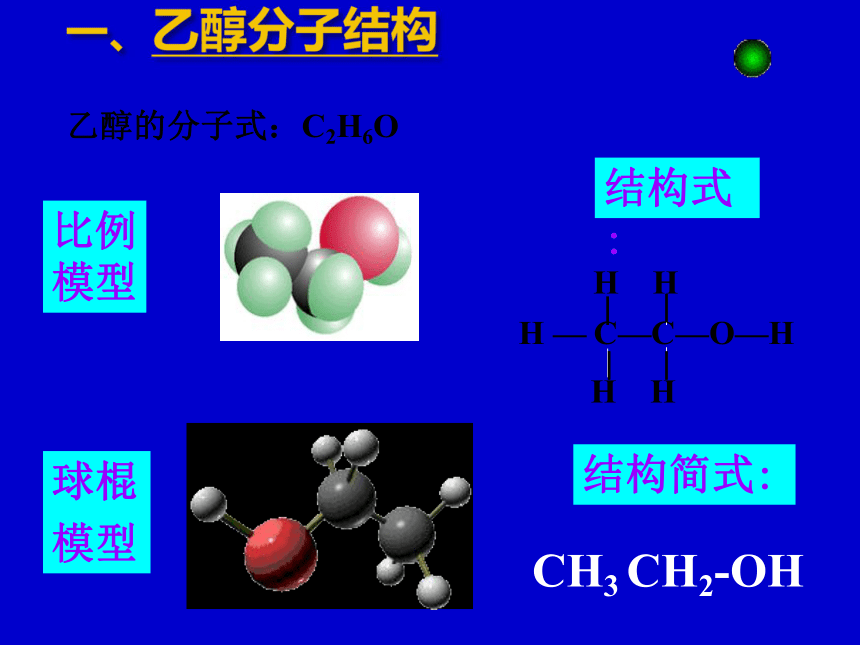
结构式:
比例
模型
乙醇的分子式:C2H6O
H — C—C—O—H
H H
H H
球棍
模型
结构简式:
CH3 CH2-OH
⑴ 乙醇是一种无色液体,具有特殊香味的液体,
⑵ 比水轻,沸点78℃,易挥发,
⑶ 是一种良好的有机溶剂, 能与水以任意比互溶
工业酒精 约含乙醇96%以上(质量分数)
无水酒精 99.5%以上(质量分数)
医用酒精 75%(体积分数)
饮用酒 视度数而定体积分数。
用工业酒精与新制生石灰
混合蒸馏,可得无水酒精
取少量酒精,加入无水硫酸铜,
若出现蓝色,则证明酒精含水.
⑵ 如何检验酒精是否含水?
?? ? ?
H H
O O
H H H
O
C2H5
乙醇与水分子间作用力
-----氢键示意图
思考:如何除去乙醇中混有的溴乙烷?
答: ⑴加水、分液、加生石灰蒸馏;
⑵或直接分馏。
H—C—C—O—H
H
H
H
H
①
②
③
④
⑤
哪些键表现出来的性质相似?
钠与水
钠与乙醇
钠是否浮在液面上
浮在水面
先沉后浮
钠的形状是否变化
熔成小球
没有变化
有无声音
发出嘶嘶响声
没有声音
有无气泡
放出气泡
放出气泡
剧烈程度
剧烈
缓慢
化学方程式
2Na+2H2O=
2 NaOH +H2↑
1、与活泼金属反应(如Na、K、Mg、Al等)
演示: 钠与无水酒精的反应:
乙醇钠
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
乙醇镁
H—C—C—O—H ,
H H
H H
①处O-H
键断开
①
(1)该反应属于 反应,
(2)为什么反应速率比水慢呢?
置换
乙醇钠的水溶液因水解而呈碱性:
CH3CH2O- + H2O CH3CH2OH + OH-
(3)乙醇是非电解质,乙醇钠是离子化合物,
[结论] 1、羟基决定乙醇能和钠反应生成氢气
2、羟基中的H原子的活泼性:醇<水
A、B、C三种醇与足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3:6:2,则A、B、C三种醇分子里羟基数之比为多少?
一元醇
二元醇
三元醇
1/2 H2
1 H2
3/2 H2
一元醇
二元醇
三元醇
H2
H2
H2
2
1
2/3
⑴燃烧 CH3CH2OH +3O2 2CO2 + 3H2O
烃的衍生物燃烧通式:
CxHyOz+ (x+y/4-z/2)O2 xCO2 + y/2H2O
点燃
点燃
(能使酸性高锰酸钾溶液褪色)
现象:产生淡蓝色火焰,同时放出大量热。
①用小试管取3~4mL无水乙醇,浸
入热水中。
②加热一端绕成螺旋状的铜丝至红热
③将铜丝趁热插到盛有乙醇的试管底部
④反复操作几次,观察铜丝颜色和液体气味的变化。
a.铜丝红色→黑色→红色反复变化
[思考] 铜丝在此实验中起什么作用?
[实验现象]
b.在试管口可以闻到刺激性气味
可见实际起氧化作用的是CuO ,Cu是催化剂
总式 2CH3CH2OH + O2 2CH3CHO+2H2O
Cu
△
黑色又变为红色,液体产生特殊气味(乙醛的气味)
CH3CH2OH+CuO CH3CHO+Cu+H2O
△
乙 醛
乙 醇
2Cu + O2 2CuO 红色变为黑色
△
练习:写出下列有机物氧化的反应方程式:
⑴. CH3CH2CH2OH
⑵. CH3CH(OH)CH2CH3
⑶. 2-甲基-2-丙醇
①-③位断键
①
③
R2—C—O—H
R1
H
+ O—O
2
生成醛或酮
+ 2H2O
—C=O
R1
R2
2
Cu
△
叔醇(连接-OH的叔碳上没有H)不能去氢氧化.
C OH,
R2
R1
R3
(3).
(2). 2 CH—OH + O2
R2
R1
Cu
△
(1). 2R—CH2—OH + O2
Cu
△
连接-OH的碳原子上必须有H,
才发生去氢氧化(催化氧化)
伯醇(-OH在伯碳-首位碳上),去氢氧化为醛
O
=
2R—C—H + 2H2O
仲醇(-OH在仲碳原子上),去氢氧化为酮
O
=
2R1—C—R2 + 2H2O
(3)酯化反应
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
实质:酸脱羟基、醇脱羟基上的氢原子。
注意:可逆反应
C2H5O—NO2 + H2O
CH3COOCH3 + H2O
CH3COOH + HOCH3
浓H2SO4
C2H5OH + HO—NO2
浓H2SO4
硝酸乙酯
乙酸甲酯
如:
醇还可以与一些无机含氧酸(如 H2SO4、HNO3等)发生酯化反应。
(取代反应)
H—C—C—H
H H
H OH
(1)分子内脱水
CH2=CH2↑+ H2O
浓H2SO4
170℃
②
④
②处C-O 键,④处C-H 键断开后形成C=C 键
-消去反应
(2)分子间脱水—取代反应
CH3CH2-OH + H-OCH2CH3
CH3CH2-O-CH2CH3 + H2O
浓H2SO4
140℃
CH3—C—CH—CH3
CH3
CH3
OH
思
考
⑴能否发生消去反应?产物名称是什么?
⑵能否被催化氧化 若能被催化氧化,请
写出反应方程式.
实验制取乙烯
练习: 写出下列有机物在浓硫酸的催化
(170℃)下脱水的反应方程式:
⑴ 1—丙醇
⑵ 2—丁醇
⑶ 2,3—二甲基—2—丁醇
⑷ 2,2—二甲基—1—丙醇
1、将分子式为C2H6O、C3H8O的两种醇的混合物与
浓硫酸混合共热,可生成哪些有机物?请写出它们
的结构简式及名称。
☆CH3CH2OH、CH3CH2CH2OH、CH3CH(OH)CH3
☆CH2=CH2
CH3-CH2=CH2
☆CH3CH2-O-CH2CH3
CH3CH2CH2-O-CH2CH2CH3
(CH3)2CH-O-CH(CH3)2
CH3CH2-O-CH2CH2CH3
CH3CH2CH2-O-CH(CH3)2
CH3CH2-O-CH(CH3)2
CH2=CH-OH(CH3CHO)
CH≡CH
HO-CH2-CH2-O-CH2-CH2-OH
O
CH2-CH2
CH2-CH2
O
—CH2-CH2-O—
n
2、乙二醇与浓硫酸共热呢?
用1∶1中等浓度的硫酸、NaBr、CH3CH2OH
共热, 生成溴乙烷:
NaBr + H2SO4 NaHSO4 + HBr
CH3CH2—OH +H—Br CH3CH2Br + H2O
△
△
H—C—C—O—H ,
H H
H H
②
②处C-O键断开
该取代反应能在碱性条件下进行吗?
问题:
R—OH + H—X R—X + H2O
△
浓硫酸有强氧化性和脱水性,
不仅能使Br- 离子氧化为红棕
色的Br2 ,而且还能使乙醇脱水
取代反应通式:
如何证明生成的是卤代烃?
置换反应→CH3CH2ONa
取代反应→CH3CH2Br
A. ①处断键 :
B. ②处断键 :
C. ③ , ①处断键 :
D. ④ , ②处断键:
消去反应→ CH2=CH2
④
①
③
H—C—C—O—H
H H
H H
②
氧化反应→ CH3CH2OH
醛或酮
C=O
R1
R2
CH OH
R1
R2
①与活泼金属反应
②与氢卤酸反应
③氧化反应--燃烧
--催化氧化
④分子内脱水
⑤分子间脱水
分子结构:
物理性质:
化学性质:
C—C—O—H
H
H
H
H
H
①
②
④
③
①
②
④
③
①
②
①
②
全部
小 结
乙醇
官能团-OH
用作燃料,如酒精灯、汽车等
制造饮料和香精外,食品加工业
一种重要的有机化工原料,如制造乙酸、乙醚等。
乙醇又是一种有机溶剂,用于溶解树 脂,制造涂料。
医疗上常用75%(体积分数)的酒精作消毒剂。
CaO, △
蒸溜
2. 乙烯水化法:
酒精溶液 无水酒精
发酵法: 含糖类丰富的各种农产品经发酵,发
酵液含乙醇6%~10%,分馏可得到95%的乙醇
H2SO4
△、P
CH2=CH2 + H—OH CH3CH2OH
氧化
氧化
CH3CH2OH
CH3CHO
CH3COOH
检验乙醇
2CrO3 + 3C2H5OH + 3H2SO4 → Cr2(SO4)3
+ 3CH3CHO + 6H2O
现象:(红色)→(绿色)
醇是分子里含有跟(链)烃基或芳香烃的侧链
相连的羟基的化合物。
一元醇
二元醇
多元醇
⑴.按羟基
数分
脂肪醇
脂环醇(环戊醇)
芳香醇(苯甲醇)
饱和一元醇
不饱和一元醇
⑵.按烃基
分
乙二醇无色、粘稠、有甜味液体
60%水溶液凝固点-49℃。故乙
二醇常用作内燃机抗冻剂.
丙三醇俗称甘油。无色、粘稠、有甜味液体。 用于加工皮革、防冻剂、润滑剂,制硝化甘油。 66.7%水溶液凝固点-46.5℃
2. 分 类:
1. 概念:
名称 相对分子质量 沸点/℃
甲醇 32 64.7
乙烷 30 -88.6
乙醇 46 78.5
丙烷 44 -42.1
丙醇 60 97.2
丁烷 58 -0.5
醇的重要物理性质
名称 羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-丙二醇 2 188
丙三醇 3 259
表1 相对分子质量相近的醇与烷烃的沸点比较
表2 含相同碳原子数、不同羟基数的醇的沸点比较
结论:
①相对分子质量相近的醇和烷烃,醇的沸点远远高于烷烃。
②碳原子数相同的醇,羟基越多,沸点越高。
注意:碳原子数相同的醇和醚互为同分异构体
4. 醇类的通性:
*5. 醇类的命名:
a.最长主链必须含—OH,
b.编号从离—OH最近端开始。
CnH2n+1—OH
例1. 在中学范畴内,写出分子式为C5H12O
的同分异构体的结构筒式。
⑴官能团异构(类别异构)
⑵碳链异构
⑶位置异构
–CH3,两个–CH2– ,一个 –CH–和一个 –OH ,
则它可能的结构有几种?
–
4种
异构体,其中主链上碳原子数为 3 的同分异
构体数目为m, 主链上碳原子数为 4 的同分
异构体数目为n,则m、n是(一个C上不能连
两个-OH) ( )
A. 1、6 B. 2、7 C. 2、6 D. 1、7
C
第二单元 醇 酚
H — C—C—O—H
H H
H H
写出甲苯分子中一个H原子被—OH取代的生成物:
苯甲醇
—CH3
—CH2OH
—CH3
OH
OH
—CH3
—CH3
HO—
酚!
物质
官能团
结构特点
类别
脂肪醇
芳香醇
酚
CH3CH2OH
—OH
—OH
羟基与链烃基相连
羟基与芳烃
基侧链相连
羟基与苯环
直接相连
—OH
—CH2OH
—OH
判断下列物质哪些是醇和酚?
CH3CH2OH
CH3CHCH3
OH
CH2OH
OH
OH
CH3
H-OH
1
2
3
4
5
6
7
醇的性质和应用
乙醇俗称酒精,是人类最早制备的有
机物 之一,也是大家相当熟悉的一种醇
结构式:
比例
模型
乙醇的分子式:C2H6O
H — C—C—O—H
H H
H H
球棍
模型
结构简式:
CH3 CH2-OH
⑴ 乙醇是一种无色液体,具有特殊香味的液体,
⑵ 比水轻,沸点78℃,易挥发,
⑶ 是一种良好的有机溶剂, 能与水以任意比互溶
工业酒精 约含乙醇96%以上(质量分数)
无水酒精 99.5%以上(质量分数)
医用酒精 75%(体积分数)
饮用酒 视度数而定体积分数。
用工业酒精与新制生石灰
混合蒸馏,可得无水酒精
取少量酒精,加入无水硫酸铜,
若出现蓝色,则证明酒精含水.
⑵ 如何检验酒精是否含水?
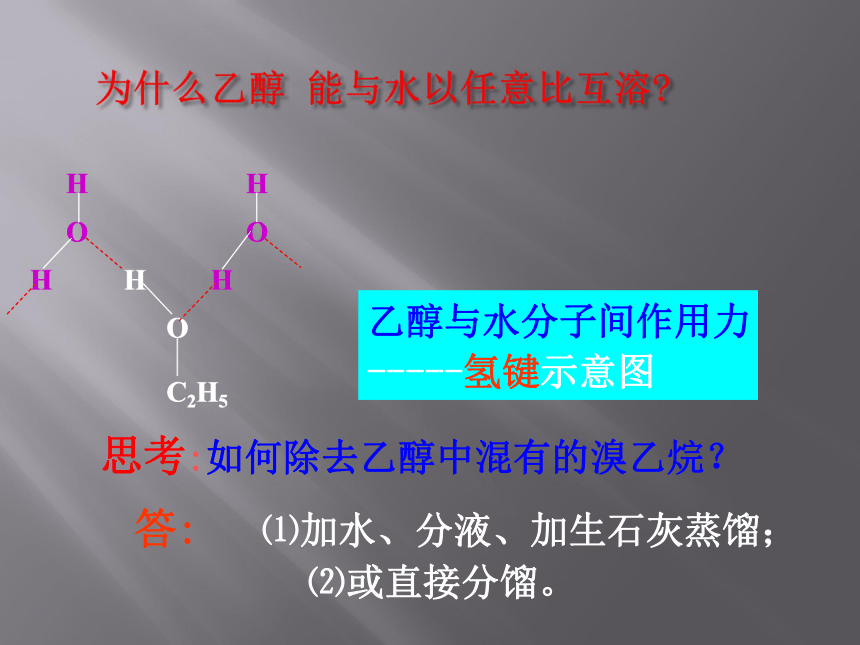
?? ? ?
H H
O O
H H H
O
C2H5
乙醇与水分子间作用力
-----氢键示意图
思考:如何除去乙醇中混有的溴乙烷?
答: ⑴加水、分液、加生石灰蒸馏;
⑵或直接分馏。
H—C—C—O—H
H
H
H
H
①
②
③
④
⑤
哪些键表现出来的性质相似?
钠与水
钠与乙醇
钠是否浮在液面上
浮在水面
先沉后浮
钠的形状是否变化
熔成小球
没有变化
有无声音
发出嘶嘶响声
没有声音
有无气泡
放出气泡
放出气泡
剧烈程度
剧烈
缓慢
化学方程式
2Na+2H2O=
2 NaOH +H2↑
1、与活泼金属反应(如Na、K、Mg、Al等)
演示: 钠与无水酒精的反应:
乙醇钠
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
乙醇镁
H—C—C—O—H ,
H H
H H
①处O-H
键断开
①
(1)该反应属于 反应,
(2)为什么反应速率比水慢呢?
置换
乙醇钠的水溶液因水解而呈碱性:
CH3CH2O- + H2O CH3CH2OH + OH-
(3)乙醇是非电解质,乙醇钠是离子化合物,
[结论] 1、羟基决定乙醇能和钠反应生成氢气
2、羟基中的H原子的活泼性:醇<水
A、B、C三种醇与足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3:6:2,则A、B、C三种醇分子里羟基数之比为多少?
一元醇
二元醇
三元醇
1/2 H2
1 H2
3/2 H2
一元醇
二元醇
三元醇
H2
H2
H2
2
1
2/3
⑴燃烧 CH3CH2OH +3O2 2CO2 + 3H2O
烃的衍生物燃烧通式:
CxHyOz+ (x+y/4-z/2)O2 xCO2 + y/2H2O
点燃
点燃
(能使酸性高锰酸钾溶液褪色)
现象:产生淡蓝色火焰,同时放出大量热。
①用小试管取3~4mL无水乙醇,浸
入热水中。
②加热一端绕成螺旋状的铜丝至红热
③将铜丝趁热插到盛有乙醇的试管底部
④反复操作几次,观察铜丝颜色和液体气味的变化。
a.铜丝红色→黑色→红色反复变化
[思考] 铜丝在此实验中起什么作用?
[实验现象]
b.在试管口可以闻到刺激性气味
可见实际起氧化作用的是CuO ,Cu是催化剂
总式 2CH3CH2OH + O2 2CH3CHO+2H2O
Cu
△
黑色又变为红色,液体产生特殊气味(乙醛的气味)
CH3CH2OH+CuO CH3CHO+Cu+H2O
△
乙 醛
乙 醇
2Cu + O2 2CuO 红色变为黑色
△
练习:写出下列有机物氧化的反应方程式:
⑴. CH3CH2CH2OH
⑵. CH3CH(OH)CH2CH3
⑶. 2-甲基-2-丙醇
①-③位断键
①
③
R2—C—O—H
R1
H
+ O—O
2
生成醛或酮
+ 2H2O
—C=O
R1
R2
2
Cu
△
叔醇(连接-OH的叔碳上没有H)不能去氢氧化.
C OH,
R2
R1
R3
(3).
(2). 2 CH—OH + O2
R2
R1
Cu
△
(1). 2R—CH2—OH + O2
Cu
△
连接-OH的碳原子上必须有H,
才发生去氢氧化(催化氧化)
伯醇(-OH在伯碳-首位碳上),去氢氧化为醛
O
=
2R—C—H + 2H2O
仲醇(-OH在仲碳原子上),去氢氧化为酮
O
=
2R1—C—R2 + 2H2O
(3)酯化反应
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
实质:酸脱羟基、醇脱羟基上的氢原子。
注意:可逆反应
C2H5O—NO2 + H2O
CH3COOCH3 + H2O
CH3COOH + HOCH3
浓H2SO4
C2H5OH + HO—NO2
浓H2SO4
硝酸乙酯
乙酸甲酯
如:
醇还可以与一些无机含氧酸(如 H2SO4、HNO3等)发生酯化反应。
(取代反应)
H—C—C—H
H H
H OH
(1)分子内脱水
CH2=CH2↑+ H2O
浓H2SO4
170℃
②
④
②处C-O 键,④处C-H 键断开后形成C=C 键
-消去反应
(2)分子间脱水—取代反应
CH3CH2-OH + H-OCH2CH3
CH3CH2-O-CH2CH3 + H2O
浓H2SO4
140℃
CH3—C—CH—CH3
CH3
CH3
OH
思
考
⑴能否发生消去反应?产物名称是什么?
⑵能否被催化氧化 若能被催化氧化,请
写出反应方程式.
实验制取乙烯
练习: 写出下列有机物在浓硫酸的催化
(170℃)下脱水的反应方程式:
⑴ 1—丙醇
⑵ 2—丁醇
⑶ 2,3—二甲基—2—丁醇
⑷ 2,2—二甲基—1—丙醇
1、将分子式为C2H6O、C3H8O的两种醇的混合物与
浓硫酸混合共热,可生成哪些有机物?请写出它们
的结构简式及名称。
☆CH3CH2OH、CH3CH2CH2OH、CH3CH(OH)CH3
☆CH2=CH2
CH3-CH2=CH2
☆CH3CH2-O-CH2CH3
CH3CH2CH2-O-CH2CH2CH3
(CH3)2CH-O-CH(CH3)2
CH3CH2-O-CH2CH2CH3
CH3CH2CH2-O-CH(CH3)2
CH3CH2-O-CH(CH3)2
CH2=CH-OH(CH3CHO)
CH≡CH
HO-CH2-CH2-O-CH2-CH2-OH
O
CH2-CH2
CH2-CH2
O
—CH2-CH2-O—
n
2、乙二醇与浓硫酸共热呢?
用1∶1中等浓度的硫酸、NaBr、CH3CH2OH
共热, 生成溴乙烷:
NaBr + H2SO4 NaHSO4 + HBr
CH3CH2—OH +H—Br CH3CH2Br + H2O
△
△
H—C—C—O—H ,
H H
H H
②
②处C-O键断开
该取代反应能在碱性条件下进行吗?
问题:
R—OH + H—X R—X + H2O
△
浓硫酸有强氧化性和脱水性,
不仅能使Br- 离子氧化为红棕
色的Br2 ,而且还能使乙醇脱水
取代反应通式:
如何证明生成的是卤代烃?
置换反应→CH3CH2ONa
取代反应→CH3CH2Br
A. ①处断键 :
B. ②处断键 :
C. ③ , ①处断键 :
D. ④ , ②处断键:
消去反应→ CH2=CH2
④
①
③
H—C—C—O—H
H H
H H
②
氧化反应→ CH3CH2OH
醛或酮
C=O
R1
R2
CH OH
R1
R2
①与活泼金属反应
②与氢卤酸反应
③氧化反应--燃烧
--催化氧化
④分子内脱水
⑤分子间脱水
分子结构:
物理性质:
化学性质:
C—C—O—H
H
H
H
H
H
①
②
④
③
①
②
④
③
①
②
①
②
全部
小 结
乙醇
官能团-OH
用作燃料,如酒精灯、汽车等
制造饮料和香精外,食品加工业
一种重要的有机化工原料,如制造乙酸、乙醚等。
乙醇又是一种有机溶剂,用于溶解树 脂,制造涂料。
医疗上常用75%(体积分数)的酒精作消毒剂。
CaO, △
蒸溜
2. 乙烯水化法:
酒精溶液 无水酒精
发酵法: 含糖类丰富的各种农产品经发酵,发
酵液含乙醇6%~10%,分馏可得到95%的乙醇
H2SO4
△、P
CH2=CH2 + H—OH CH3CH2OH
氧化
氧化
CH3CH2OH
CH3CHO
CH3COOH
检验乙醇
2CrO3 + 3C2H5OH + 3H2SO4 → Cr2(SO4)3
+ 3CH3CHO + 6H2O
现象:(红色)→(绿色)
醇是分子里含有跟(链)烃基或芳香烃的侧链
相连的羟基的化合物。
一元醇
二元醇
多元醇
⑴.按羟基
数分
脂肪醇
脂环醇(环戊醇)
芳香醇(苯甲醇)
饱和一元醇
不饱和一元醇
⑵.按烃基
分
乙二醇无色、粘稠、有甜味液体
60%水溶液凝固点-49℃。故乙
二醇常用作内燃机抗冻剂.
丙三醇俗称甘油。无色、粘稠、有甜味液体。 用于加工皮革、防冻剂、润滑剂,制硝化甘油。 66.7%水溶液凝固点-46.5℃
2. 分 类:
1. 概念:
名称 相对分子质量 沸点/℃
甲醇 32 64.7
乙烷 30 -88.6
乙醇 46 78.5
丙烷 44 -42.1
丙醇 60 97.2
丁烷 58 -0.5
醇的重要物理性质
名称 羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-丙二醇 2 188
丙三醇 3 259
表1 相对分子质量相近的醇与烷烃的沸点比较
表2 含相同碳原子数、不同羟基数的醇的沸点比较
结论:
①相对分子质量相近的醇和烷烃,醇的沸点远远高于烷烃。
②碳原子数相同的醇,羟基越多,沸点越高。
注意:碳原子数相同的醇和醚互为同分异构体
4. 醇类的通性:
*5. 醇类的命名:
a.最长主链必须含—OH,
b.编号从离—OH最近端开始。
CnH2n+1—OH
例1. 在中学范畴内,写出分子式为C5H12O
的同分异构体的结构筒式。
⑴官能团异构(类别异构)
⑵碳链异构
⑶位置异构
–CH3,两个–CH2– ,一个 –CH–和一个 –OH ,
则它可能的结构有几种?
–
4种
异构体,其中主链上碳原子数为 3 的同分异
构体数目为m, 主链上碳原子数为 4 的同分
异构体数目为n,则m、n是(一个C上不能连
两个-OH) ( )
A. 1、6 B. 2、7 C. 2、6 D. 1、7
C
