第一单元_丰富多彩的化学物质
图片预览









文档简介
(共48张PPT)
专题1 化学家眼中的物质世界
第一单元 丰富多彩的化学物质
第一课时
一、物质的分类及转化
分类的依据有多方面:如按物质的组成、聚集状态、性质(物理、化学性质)等。
具体如:导电性、溶解性、密度、可燃性、来源、用途
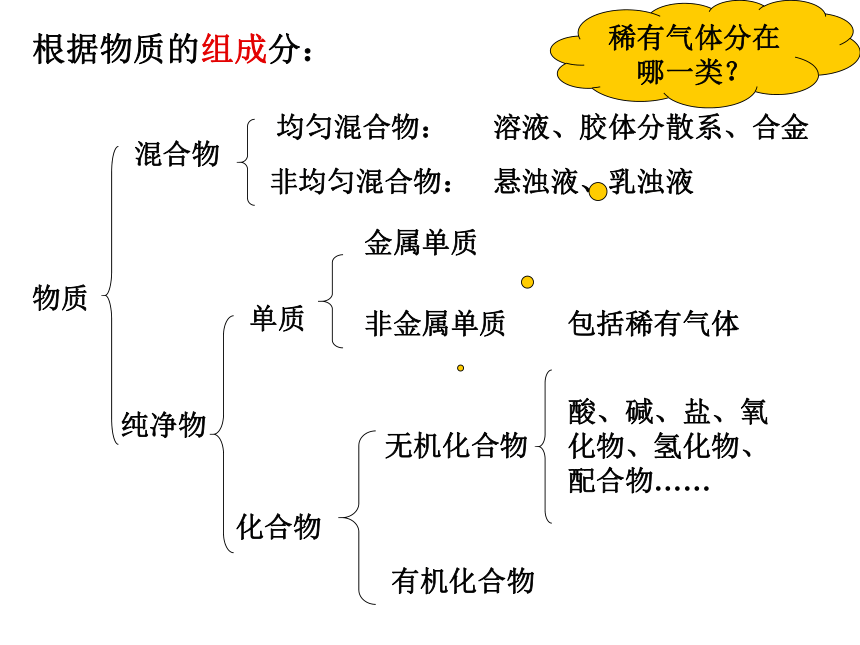
根据物质的组成分:
一)物质的分类
[交流与讨论]:用尽可能多的方法对教材P3交流与讨论中的物质进行分类,并说明分类的依据。
物质
纯净物
混合物
均匀混合物:
非均匀混合物:
单质
化合物
金属单质
非金属单质
有机化合物
无机化合物
酸、碱、盐、氧化物、氢化物、配合物……
根据物质的组成分:
悬浊液、乳浊液
溶液、胶体分散系、合金
稀有气体分在哪一类?
包括稀有气体
问题解决:完成教材P3问题解决
物质
纯净物
混合物
均匀混合物:
非均匀混合物:
单质
化合物
金属单质
非金属单质
有机化合物
无机化合物
酸
碱
盐
氧化物
氯化铁溶液
氯气(Cl2)
钠(Na)
硫酸
氢氧化钠
碳酸钙
氧化钙
现在你能对P3交流与讨论中的物质分类了吗?
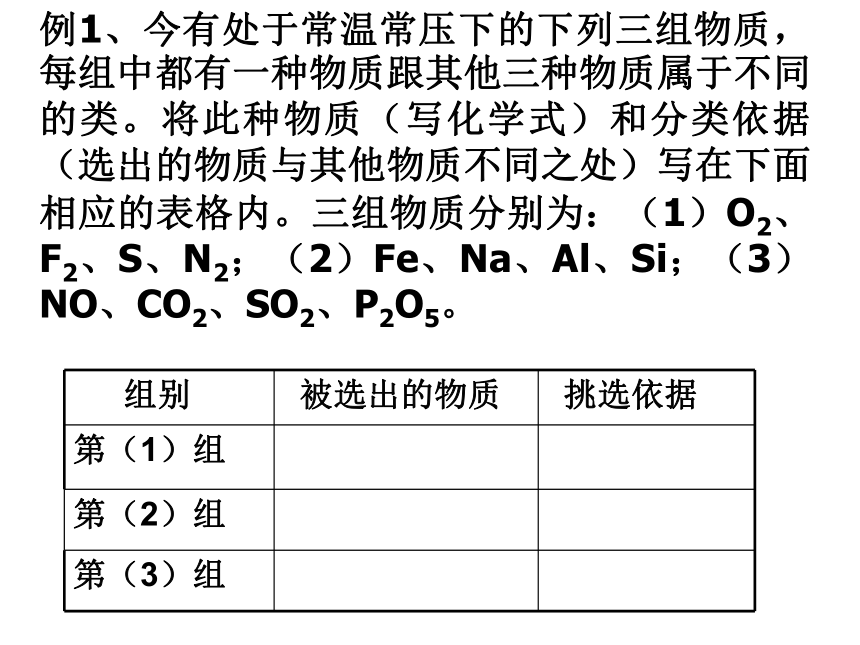
例1、今有处于常温常压下的下列三组物质,每组中都有一种物质跟其他三种物质属于不同的类。将此种物质(写化学式)和分类依据(选出的物质与其他物质不同之处)写在下面相应的表格内。三组物质分别为:(1)O2、F2、S、N2;(2)Fe、Na、Al、Si;(3)NO、CO2、SO2、P2O5。
组别 被选出的物质 挑选依据
第(1)组
第(2)组
第(3)组
例2、下列物质属于纯净物的是( )
A、洁净的空气 B、食盐水
C、浮有冰块的水 D、纯净的盐酸
E、含氮35%的硝酸铵化肥 F、生石灰
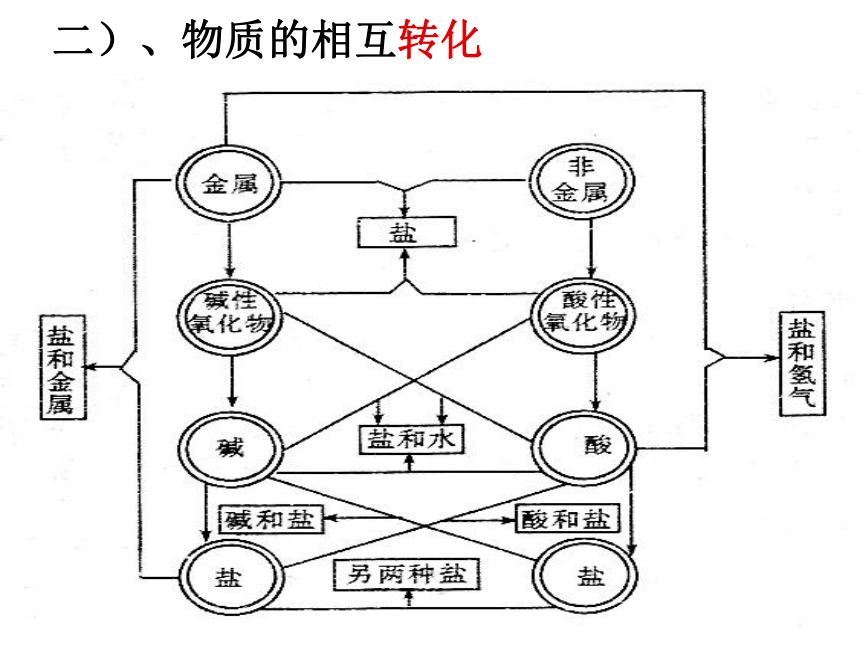
C F
不同类物质之间可相互转化吗?
1、P4“问题解决”说明了什么问题? 2、这是什么类型物质之间的转化? 3、试试看,你能举出多少不同类物质之间转化的类型? 4、在交流讨论的基础上填写表1-1,举例。
1、单质 化合物
2、金属氧化物 氢氧化物( 碱)
3、非金属氧化物 酸
4、酸 盐
5、碱 盐
6、化合物 单质
7、盐 盐
8、盐 氧化物
交流与讨论
二)、物质的相互转化
完成P4“交流与讨论”2,写出相应的化学方程式,标出有元素化合价变化的元素原子
CaO
Ca
CaCl2
CaCO3
Ca(OH)2
例3、同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1) 生石灰属于哪种类别的物质?
(2) 生石灰可做干燥剂的理由是什么?(用化学方程式表示)
(3) 生石灰还可以跟哪些类别的物质发生化学反应?列举两例,并写出化学方程式。
(4) 小纸袋中的物质能否长期持续地做干燥剂?为什么?
在你所认识的化学物质中,还有哪些可以用作干燥剂?列举一例。
第一单元 丰富多彩的化学物质
一、物质的分类与转化 第二课时
三)、化学反应分类
1、初中化学对化学反应是如何进行分类的?
2、各化学反应类型有何特征?
3、各举两例说明。
4、填写书P5页表1-2
5、你还知道其他分类方法吗?
整理与归纳:
化学反应的四种基本类型:根据反应物和生成物的类别以及反应前后物质类的多少分。
反应类型 特征 化合反应: A+B=AB 分解反应: AB=A+B 置换反应: AB+C=A+CB 或:AB+C=AC+B 复分解反应: AB+CD=AD+CB
化合反应:
单质与单质化合: 单质与化合物化合: 化合物与化合物化合:
分解反应
产物是两种的分解反应
产物是三种的分解反应
置换反应
金属置换金属
金属置换非金属
非金属置换金属
非金属置换非金属
复分解反应
酸与碱反应
酸与盐反应
碱与盐反应
盐与盐反应
总结金属与盐发生置换反应的条件?
复分解反应的条件
复分解反应的条件是什么?
写出下列反应的方程式,不能反应的说明原因
氯化钠与硝酸钾反应
氯化钠与硝酸银
氢氧化钡与硫酸钠
氢氧化钡与氯化钠
硫酸与氢氧化钠
硫酸与硝酸镁
碳酸钙与盐酸
2、根据反应中是否有化合价变化划分:氧化还原反应和非氧化还原反应
(1)氧化反应:化合价升高的反应
(2)还原反应:化合价降低的反应
思考:四种基本反应类型中有哪些是氧化还原反应?
思考:四种基本反应类型有哪些是氧化还原反应?
(3)氧化还原反应与四种基本反应类型的关系:
化合反应 氧化还原反应
分解反应 氧化还原反应
置换反应 氧化还原反应
复分解反应 氧化还原反应
不全是
不全是
全部是
不是
思考:有单质参加和生成的反应肯定是氧化还原反应吗
?
3、根据是否有离子参加反应划分:
离子反应和非离子反应
4、根据反应进行的程度划分:
可逆反应和不可逆反应
5、根据反应中的能量变化划分:
放热反应和吸热反应
作业:
1、预习物质的量部分内容。
2、完成学习与评价课课练课时1、2,周一交
3、写出以碳元素为主线的下列物质间转化的化学方程式,标出有化合价变化的元素原子的化合价。
C6H12O6
C CO CO2 CaCO3
第一单元 丰富多彩的化学物质
(第三课时)
二、物质的量 第一课时
二、物质的量
1、意义:表示一定数目微粒的集合体的物理量
符号:n
如 :硫酸 的 物质的量 不能简化为 硫酸的量
也不能写成 硫酸的质量或 硫酸的数量
注意: 物质的量是一个专有名词,由四个字组成 ,是一个 整体,不能分割,也不可加字、减字。
2、物质的量 的单位:
基本单位:摩尔简称摩,符号 mol
1mol的定义:规定:0.0 12kg C-12 (12C)中所含的碳原子数为阿伏加德罗常数,用NA 表示。含阿伏加德罗常数个微粒的集合体为1 mol。
关于阿伏加德罗常数的说明:
注意
1、经实验测定:阿伏加德罗常数的近似值 为 6.02×1023mol-1
不能认为 6.02×1023就是阿伏加德罗常数
判断: 下面叙述是否正确
(A)每摩尔物质含有 6.02×1023个微粒
(B)摩尔是国际单位制中七个基本物理量之一。
(C)摩尔是物质的质量单位。
(D)摩尔是物质的数量单位。
(E) 1摩尔大米约含有6.02×1023 个米粒
物质的量只适用于微观粒子,不能用来描述宏观物质。
使用摩尔的注意事项:
【课堂练习】 1、判断下列写法是否正确,并说明理由。 A、1mol氢 B、1mol氧元素 C、0.5molCO2 D、1mol乒乓球 2、填空: 1molH2所含氢气分子的个数 。2mol氢分子含 个氢分子,含 个氢原子。0.5molClO3-含 个氯酸根离子。
1、不能用来表示宏观物质。
例如:1mol大米…(Ⅹ) 1molH……(√)
2、一般,应用化学式指明粒子的种类
填空
(1)1 mol 碳原子约含有 个碳原子
6.02×1023
(2)0.3 mol 硫酸分子约含有 个硫酸分子
0.3×6.02×1023
(3)10 mol 钠离子约含有 个钠离子
10×6.02×1023
物质的量是微粒的集体,可以用分数或小数表示。
(4)6 mol 电子约含有 个电子
6×6.02×1023
(5)0.5 mol 中子约含有 个中子
0.5×6.02×1023
物质的量 (n)
=
物质所含微粒数目 (N)
阿伏加德罗常数 (NA)
思考:物质的量 (n)、微粒数 (N)、阿伏加德罗常数 (NA)关系
讨论
1 摩尔水分子中有多少摩尔氢原子,多少摩尔氧原子?
H2O
1
1 mol
NA
2H
O
2
1
2NA
NA
1 mol
2 mol
结论:
微粒之间的个数之比也就是物质的量之比
微粒个数
微粒集团
物质的量
填空
(6)1 mol Na2SO4含有 mol Na+
2
mol SO42-
1
个氧原子
0.5 mol Na2SO4含有 mol Na+
1
mol SO42-
0.5
物质的量 (n)
=
物质所含微粒数目 (N)
阿伏加德罗常数 (NA)
个氧原子
2×6.02×1023
4×6.02×1023
填空
(7)1 mol OH-含有 mol 质子
有 个 质子
含有 5.418×1023 个质子的 OH-离子的物质的量为
摩尔
9
9×6.02×1023
5.418×1023/(9×6.02×1023) = 0.1
选择
0.1 mol KClO3 和 0.1 mol KClO 中所含微粒数相
等的是 ( )
(A) 钾离子 (B)氯离子
(C) 氯原子 (D)氧原子
A C
KClO3 = K+ + ClO3-
KClO = K+ + ClO-
小 结
(1) 物质的量是表示物质所含微粒多少的物理量,
摩尔是它的单位,
每摩尔物质含有阿伏加德罗常数个微粒,
约为 6.02×1023
(2) 应具体说明是哪一种微观粒子
(3) 以阿伏加德罗常数为桥梁进行物质的量和微粒数之间的
换算:
物质的量
微粒数
×NA
.
.
NA
第一单元 丰富多彩的化学物质
(第四课时)
第二课时
二、物质的量
思考:
1mol任何粒子所含的粒子数是相同的,那么,1mol不同微粒的质量是否相同呢?
1 mol 任何物质都含有阿伏加德罗常数个微粒,请计算 1 mol下列物质的质量。
由以上计算结果可得出什么规律?
微粒符号
物质式量
每个微粒质量
1摩尔物质质量
C
12
1.993×10-23 g
H2O
Na+
18
23
23 g
2.990×10-23 g
3.821×10-23 g
12 g
18 g
结论:
1 摩尔任何物质的质量,以克为单位,
数值上等于该物质的式量。
1摩尔物质的质量
填空
(1)1 mol 铜原子的质量是 克
63.5
(2)1 mol 硫酸分子的质量是 克
98
(3)1 mol 氧分子的质量是 克
32
(4)1 mol OH-离子的质量是 克
17
(5)1 mol Na+ 离子的质量是 克
23
2、摩尔质量
1)定义:
2)单位:
单位物质的量的物质所具有的质量。
用 M 表示
克/摩或克·摩-1
符号:g/mol 或 g .mol-1
3)数值:
等于该物质的式量。(注意单位)
物质的量 (mol)
物质的质量 (g)
摩尔质量 (g/mol)
n = m / M
=
思考:为什么摩尔质量以g .mol-1为单位时,数值上等于其相对式量?
回顾
初中学习的相对分子质量、相对原子质量的标准是什么?
你能结合通过初中相对原子质量的定义
式推导某元素X的摩尔质量么?
填空
(1)氯分子的摩尔质量是 克/摩
71
(2) 氢氧化钠的摩尔质量是 克/摩
40
(3) 镁原子的摩尔质量是 克/摩
24
(4)Cl-离子的摩尔质量是 克/摩
35.5
(5)K+ 离子的摩尔质量是 克/摩
39
4)关于物质摩尔质量的计算
看教材P7页例1
看书P8页例题 。
[例 1] 90克水相当于多少摩水
解: 水的式量是18,
水的摩尔质量是 18g/mol 。
n (H2O) =
90g
18g/mol
= 5 mol
答:90克水相当于5mol水。
[例 2] 2. 5 mol 铜原子的质量是多少克
解: 铜的原子量是 63. 5 ,
铜的摩尔质量是 63.5 g/mol 。
m (Cu) =
2.5 mol
63.5g/mol ×
= 158.8g
答:2.5mol 铜原子的质量等于 158.8g 。
[例 3] 4. 9 克硫酸里含有多少个硫酸分子
解: 硫酸的式量是98,
硫酸的摩尔质量是 98g/mol 。
n (H2SO4) =
4. 9 g
98g/mol
= 0.05 mol
答:4.9克硫酸里含有 3.01×1022个硫酸分子。
N (H2SO4) =
0.05 mol × 6.02 × 1023mol-1
=3.01×1022
[练习] 20. 2 克硝酸钾中,氧元素的质量是多少克
解: 硝酸钾的式量是101,
硝酸钾的摩尔质量是 101g/mol 。
n (KNO3) =
20.2 g
101g/mol
= 0.2 mol
答:20.2克硝酸钾中,氧元素的质量是 9. 6 g 。
n (O) =
0.2 mol×3 = 0.6 mol
m (O) =0. 6 mol×16g/mol = 9.6 g
小 结
通过物质的量把可称量的宏观物质与难以称量的
微观粒子有机地联系起来。
物质的量
微粒数
NA
÷NA
.
.
×M
M
质量
NA- 阿伏加德罗常数 约6.02 × 1023mol-1
M- 摩尔质量 (克/摩)
作业:
1 .课课练课时3
2.预习
同学们再见
专题1 化学家眼中的物质世界
第一单元 丰富多彩的化学物质
第一课时
一、物质的分类及转化
分类的依据有多方面:如按物质的组成、聚集状态、性质(物理、化学性质)等。
具体如:导电性、溶解性、密度、可燃性、来源、用途
根据物质的组成分:
一)物质的分类
[交流与讨论]:用尽可能多的方法对教材P3交流与讨论中的物质进行分类,并说明分类的依据。
物质
纯净物
混合物
均匀混合物:
非均匀混合物:
单质
化合物
金属单质
非金属单质
有机化合物
无机化合物
酸、碱、盐、氧化物、氢化物、配合物……
根据物质的组成分:
悬浊液、乳浊液
溶液、胶体分散系、合金
稀有气体分在哪一类?
包括稀有气体
问题解决:完成教材P3问题解决
物质
纯净物
混合物
均匀混合物:
非均匀混合物:
单质
化合物
金属单质
非金属单质
有机化合物
无机化合物
酸
碱
盐
氧化物
氯化铁溶液
氯气(Cl2)
钠(Na)
硫酸
氢氧化钠
碳酸钙
氧化钙
现在你能对P3交流与讨论中的物质分类了吗?
例1、今有处于常温常压下的下列三组物质,每组中都有一种物质跟其他三种物质属于不同的类。将此种物质(写化学式)和分类依据(选出的物质与其他物质不同之处)写在下面相应的表格内。三组物质分别为:(1)O2、F2、S、N2;(2)Fe、Na、Al、Si;(3)NO、CO2、SO2、P2O5。
组别 被选出的物质 挑选依据
第(1)组
第(2)组
第(3)组
例2、下列物质属于纯净物的是( )
A、洁净的空气 B、食盐水
C、浮有冰块的水 D、纯净的盐酸
E、含氮35%的硝酸铵化肥 F、生石灰
C F
不同类物质之间可相互转化吗?
1、P4“问题解决”说明了什么问题? 2、这是什么类型物质之间的转化? 3、试试看,你能举出多少不同类物质之间转化的类型? 4、在交流讨论的基础上填写表1-1,举例。
1、单质 化合物
2、金属氧化物 氢氧化物( 碱)
3、非金属氧化物 酸
4、酸 盐
5、碱 盐
6、化合物 单质
7、盐 盐
8、盐 氧化物
交流与讨论
二)、物质的相互转化
完成P4“交流与讨论”2,写出相应的化学方程式,标出有元素化合价变化的元素原子
CaO
Ca
CaCl2
CaCO3
Ca(OH)2
例3、同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1) 生石灰属于哪种类别的物质?
(2) 生石灰可做干燥剂的理由是什么?(用化学方程式表示)
(3) 生石灰还可以跟哪些类别的物质发生化学反应?列举两例,并写出化学方程式。
(4) 小纸袋中的物质能否长期持续地做干燥剂?为什么?
在你所认识的化学物质中,还有哪些可以用作干燥剂?列举一例。
第一单元 丰富多彩的化学物质
一、物质的分类与转化 第二课时
三)、化学反应分类
1、初中化学对化学反应是如何进行分类的?
2、各化学反应类型有何特征?
3、各举两例说明。
4、填写书P5页表1-2
5、你还知道其他分类方法吗?
整理与归纳:
化学反应的四种基本类型:根据反应物和生成物的类别以及反应前后物质类的多少分。
反应类型 特征 化合反应: A+B=AB 分解反应: AB=A+B 置换反应: AB+C=A+CB 或:AB+C=AC+B 复分解反应: AB+CD=AD+CB
化合反应:
单质与单质化合: 单质与化合物化合: 化合物与化合物化合:
分解反应
产物是两种的分解反应
产物是三种的分解反应
置换反应
金属置换金属
金属置换非金属
非金属置换金属
非金属置换非金属
复分解反应
酸与碱反应
酸与盐反应
碱与盐反应
盐与盐反应
总结金属与盐发生置换反应的条件?
复分解反应的条件
复分解反应的条件是什么?
写出下列反应的方程式,不能反应的说明原因
氯化钠与硝酸钾反应
氯化钠与硝酸银
氢氧化钡与硫酸钠
氢氧化钡与氯化钠
硫酸与氢氧化钠
硫酸与硝酸镁
碳酸钙与盐酸
2、根据反应中是否有化合价变化划分:氧化还原反应和非氧化还原反应
(1)氧化反应:化合价升高的反应
(2)还原反应:化合价降低的反应
思考:四种基本反应类型中有哪些是氧化还原反应?
思考:四种基本反应类型有哪些是氧化还原反应?
(3)氧化还原反应与四种基本反应类型的关系:
化合反应 氧化还原反应
分解反应 氧化还原反应
置换反应 氧化还原反应
复分解反应 氧化还原反应
不全是
不全是
全部是
不是
思考:有单质参加和生成的反应肯定是氧化还原反应吗
?
3、根据是否有离子参加反应划分:
离子反应和非离子反应
4、根据反应进行的程度划分:
可逆反应和不可逆反应
5、根据反应中的能量变化划分:
放热反应和吸热反应
作业:
1、预习物质的量部分内容。
2、完成学习与评价课课练课时1、2,周一交
3、写出以碳元素为主线的下列物质间转化的化学方程式,标出有化合价变化的元素原子的化合价。
C6H12O6
C CO CO2 CaCO3
第一单元 丰富多彩的化学物质
(第三课时)
二、物质的量 第一课时
二、物质的量
1、意义:表示一定数目微粒的集合体的物理量
符号:n
如 :硫酸 的 物质的量 不能简化为 硫酸的量
也不能写成 硫酸的质量或 硫酸的数量
注意: 物质的量是一个专有名词,由四个字组成 ,是一个 整体,不能分割,也不可加字、减字。
2、物质的量 的单位:
基本单位:摩尔简称摩,符号 mol
1mol的定义:规定:0.0 12kg C-12 (12C)中所含的碳原子数为阿伏加德罗常数,用NA 表示。含阿伏加德罗常数个微粒的集合体为1 mol。
关于阿伏加德罗常数的说明:
注意
1、经实验测定:阿伏加德罗常数的近似值 为 6.02×1023mol-1
不能认为 6.02×1023就是阿伏加德罗常数
判断: 下面叙述是否正确
(A)每摩尔物质含有 6.02×1023个微粒
(B)摩尔是国际单位制中七个基本物理量之一。
(C)摩尔是物质的质量单位。
(D)摩尔是物质的数量单位。
(E) 1摩尔大米约含有6.02×1023 个米粒
物质的量只适用于微观粒子,不能用来描述宏观物质。
使用摩尔的注意事项:
【课堂练习】 1、判断下列写法是否正确,并说明理由。 A、1mol氢 B、1mol氧元素 C、0.5molCO2 D、1mol乒乓球 2、填空: 1molH2所含氢气分子的个数 。2mol氢分子含 个氢分子,含 个氢原子。0.5molClO3-含 个氯酸根离子。
1、不能用来表示宏观物质。
例如:1mol大米…(Ⅹ) 1molH……(√)
2、一般,应用化学式指明粒子的种类
填空
(1)1 mol 碳原子约含有 个碳原子
6.02×1023
(2)0.3 mol 硫酸分子约含有 个硫酸分子
0.3×6.02×1023
(3)10 mol 钠离子约含有 个钠离子
10×6.02×1023
物质的量是微粒的集体,可以用分数或小数表示。
(4)6 mol 电子约含有 个电子
6×6.02×1023
(5)0.5 mol 中子约含有 个中子
0.5×6.02×1023
物质的量 (n)
=
物质所含微粒数目 (N)
阿伏加德罗常数 (NA)
思考:物质的量 (n)、微粒数 (N)、阿伏加德罗常数 (NA)关系
讨论
1 摩尔水分子中有多少摩尔氢原子,多少摩尔氧原子?
H2O
1
1 mol
NA
2H
O
2
1
2NA
NA
1 mol
2 mol
结论:
微粒之间的个数之比也就是物质的量之比
微粒个数
微粒集团
物质的量
填空
(6)1 mol Na2SO4含有 mol Na+
2
mol SO42-
1
个氧原子
0.5 mol Na2SO4含有 mol Na+
1
mol SO42-
0.5
物质的量 (n)
=
物质所含微粒数目 (N)
阿伏加德罗常数 (NA)
个氧原子
2×6.02×1023
4×6.02×1023
填空
(7)1 mol OH-含有 mol 质子
有 个 质子
含有 5.418×1023 个质子的 OH-离子的物质的量为
摩尔
9
9×6.02×1023
5.418×1023/(9×6.02×1023) = 0.1
选择
0.1 mol KClO3 和 0.1 mol KClO 中所含微粒数相
等的是 ( )
(A) 钾离子 (B)氯离子
(C) 氯原子 (D)氧原子
A C
KClO3 = K+ + ClO3-
KClO = K+ + ClO-
小 结
(1) 物质的量是表示物质所含微粒多少的物理量,
摩尔是它的单位,
每摩尔物质含有阿伏加德罗常数个微粒,
约为 6.02×1023
(2) 应具体说明是哪一种微观粒子
(3) 以阿伏加德罗常数为桥梁进行物质的量和微粒数之间的
换算:
物质的量
微粒数
×NA
.
.
NA
第一单元 丰富多彩的化学物质
(第四课时)
第二课时
二、物质的量
思考:
1mol任何粒子所含的粒子数是相同的,那么,1mol不同微粒的质量是否相同呢?
1 mol 任何物质都含有阿伏加德罗常数个微粒,请计算 1 mol下列物质的质量。
由以上计算结果可得出什么规律?
微粒符号
物质式量
每个微粒质量
1摩尔物质质量
C
12
1.993×10-23 g
H2O
Na+
18
23
23 g
2.990×10-23 g
3.821×10-23 g
12 g
18 g
结论:
1 摩尔任何物质的质量,以克为单位,
数值上等于该物质的式量。
1摩尔物质的质量
填空
(1)1 mol 铜原子的质量是 克
63.5
(2)1 mol 硫酸分子的质量是 克
98
(3)1 mol 氧分子的质量是 克
32
(4)1 mol OH-离子的质量是 克
17
(5)1 mol Na+ 离子的质量是 克
23
2、摩尔质量
1)定义:
2)单位:
单位物质的量的物质所具有的质量。
用 M 表示
克/摩或克·摩-1
符号:g/mol 或 g .mol-1
3)数值:
等于该物质的式量。(注意单位)
物质的量 (mol)
物质的质量 (g)
摩尔质量 (g/mol)
n = m / M
=
思考:为什么摩尔质量以g .mol-1为单位时,数值上等于其相对式量?
回顾
初中学习的相对分子质量、相对原子质量的标准是什么?
你能结合通过初中相对原子质量的定义
式推导某元素X的摩尔质量么?
填空
(1)氯分子的摩尔质量是 克/摩
71
(2) 氢氧化钠的摩尔质量是 克/摩
40
(3) 镁原子的摩尔质量是 克/摩
24
(4)Cl-离子的摩尔质量是 克/摩
35.5
(5)K+ 离子的摩尔质量是 克/摩
39
4)关于物质摩尔质量的计算
看教材P7页例1
看书P8页例题 。
[例 1] 90克水相当于多少摩水
解: 水的式量是18,
水的摩尔质量是 18g/mol 。
n (H2O) =
90g
18g/mol
= 5 mol
答:90克水相当于5mol水。
[例 2] 2. 5 mol 铜原子的质量是多少克
解: 铜的原子量是 63. 5 ,
铜的摩尔质量是 63.5 g/mol 。
m (Cu) =
2.5 mol
63.5g/mol ×
= 158.8g
答:2.5mol 铜原子的质量等于 158.8g 。
[例 3] 4. 9 克硫酸里含有多少个硫酸分子
解: 硫酸的式量是98,
硫酸的摩尔质量是 98g/mol 。
n (H2SO4) =
4. 9 g
98g/mol
= 0.05 mol
答:4.9克硫酸里含有 3.01×1022个硫酸分子。
N (H2SO4) =
0.05 mol × 6.02 × 1023mol-1
=3.01×1022
[练习] 20. 2 克硝酸钾中,氧元素的质量是多少克
解: 硝酸钾的式量是101,
硝酸钾的摩尔质量是 101g/mol 。
n (KNO3) =
20.2 g
101g/mol
= 0.2 mol
答:20.2克硝酸钾中,氧元素的质量是 9. 6 g 。
n (O) =
0.2 mol×3 = 0.6 mol
m (O) =0. 6 mol×16g/mol = 9.6 g
小 结
通过物质的量把可称量的宏观物质与难以称量的
微观粒子有机地联系起来。
物质的量
微粒数
NA
÷NA
.
.
×M
M
质量
NA- 阿伏加德罗常数 约6.02 × 1023mol-1
M- 摩尔质量 (克/摩)
作业:
1 .课课练课时3
2.预习
同学们再见
