江苏省徐州市沛县2021-2022学年高一上学期第一次学情调研(11月)化学试题(Word版含答案)
文档属性
| 名称 | 江苏省徐州市沛县2021-2022学年高一上学期第一次学情调研(11月)化学试题(Word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 312.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-22 00:00:00 | ||
图片预览


文档简介
沛县2021-2022学年高一上学期第一次学情调研
化学学科试题
注意事项:
1.本试卷分为选择题和非选择题两部分,总分:100分。考试时间:75分钟。
2.请把答案写在答题卡的指定栏目内。
可能用到的相对原子质量:H1 C12 O16 Na23 S32 Ba137
一、单项选择题:本题包括20小题,每小题3分,共计60分。每小题只有一个选项符合题意。
1.运输浓硫酸的槽罐车应悬挂的危险化学品标志是
A. B. C. D.
2.许多化学物质在日常生活中有俗名。下列物质的俗名与化学式对应正确的是
A.双氧水—Na2O2 B.小苏打—NaOH
C.胆矾—Cu(OH)2 D.干冰—CO2
3.K2FeO4是一种高效水处理剂。它属于
A.酸 B.碱 C.盐 D.单质
4.下列电离方程式,书写正确的是
A. B.
C. D.
5.胶体和溶液的本质区别在于
A.分散系是否有颜色 B.分散系是否均匀
C.分散质粒子的直径 D.是否发生丁达尔效应
6.下列物质属于电解质的是
A. NaOH溶液 B.乙醇 C.熔融KNO3 D. NH3
7.下列混合物,可依次用溶解、过滤、蒸发操作进行分离的是
A.混有泥沙的食盐 B.混有水的酒精
C.白糖与食盐的混合物 D.铁粉与泥沙的混合物
8.能够用于鉴别氯化钡、氯化钠、碳酸钠三种物质的试剂是
A.硝酸银溶液 B.稀硫酸
C.氢氧化钾溶液 D.氢氧化钠溶液
9.标准状况下,下列物质所占体积最大的是
A. 360gH2O B. 32gO2
C. 1.5molH2 D.约3.01×1024个氮分子
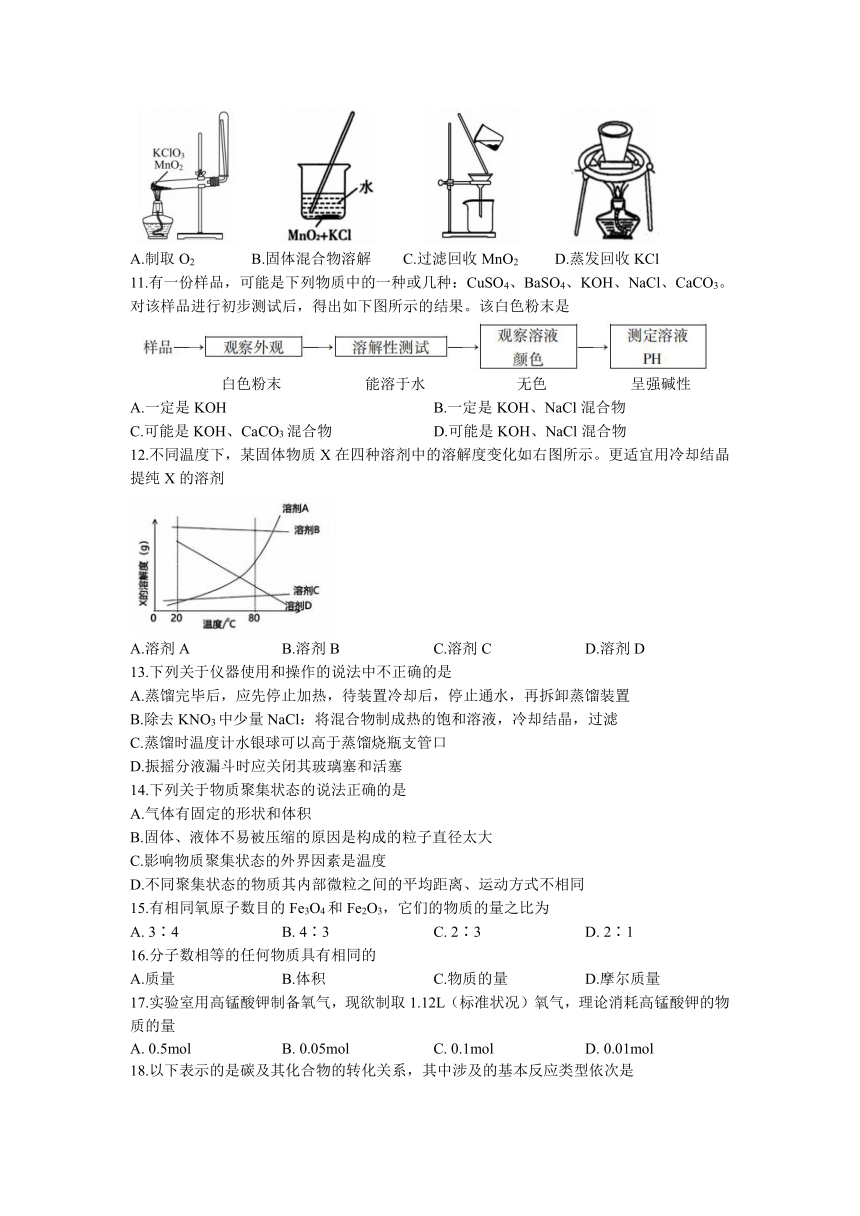
10. KClO3和MnO2反应制取O2的化学方程式为:。下列制取O2并回收MnO2和KCl的装置和原理正确,且能达到实验目的的是
A.制取O2 B.固体混合物溶解 C.过滤回收MnO2 D.蒸发回收KCl
11.有一份样品,可能是下列物质中的一种或几种:CuSO4、BaSO4、KOH、NaCl、CaCO3。对该样品进行初步测试后,得出如下图所示的结果。该白色粉末是
白色粉末 能溶于水 无色 呈强碱性
A.一定是KOH B.一定是KOH、NaCl混合物
C.可能是KOH、CaCO3混合物 D.可能是KOH、NaCl混合物
12.不同温度下,某固体物质X在四种溶剂中的溶解度变化如右图所示。更适宜用冷却结晶提纯X的溶剂
A.溶剂A B.溶剂B C.溶剂C D.溶剂D
13.下列关于仪器使用和操作的说法中不正确的是
A.蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
B.除去KNO3中少量NaCl:将混合物制成热的饱和溶液,冷却结晶,过滤
C.蒸馏时温度计水银球可以高于蒸馏烧瓶支管口
D.振摇分液漏斗时应关闭其玻璃塞和活塞
14.下列关于物质聚集状态的说法正确的是
A.气体有固定的形状和体积
B.固体、液体不易被压缩的原因是构成的粒子直径太大
C.影响物质聚集状态的外界因素是温度
D.不同聚集状态的物质其内部微粒之间的平均距离、运动方式不相同
15.有相同氧原子数目的Fe3O4和Fe2O3,它们的物质的量之比为
A. 3∶4 B. 4∶3 C. 2∶3 D. 2∶1
16.分子数相等的任何物质具有相同的
A.质量 B.体积 C.物质的量 D.摩尔质量
17.实验室用高锰酸钾制备氧气,现欲制取1.12L(标准状况)氧气,理论消耗高锰酸钾的物质的量
A. 0.5mol B. 0.05mol C. 0.1mol D. 0.01mol
18.以下表示的是碳及其化合物的转化关系,其中涉及的基本反应类型依次是
A.化合、置换、分解、复分解
B.置换、复分解、化合、分解
C.置换、化合、分解、复分解
D.置换、化合、复分解、分解
19.某一由硫酸钾、硫酸铝和硫酸组成的混合溶液中:,,,则为
A. 0.15mol B. 0.2mol C. 0.3mol D. 0.4mol
20.铅笔芯的主要成分石墨和粘土,假设铅笔芯质量的一半是石墨(其余的组成物质中不含碳),用铅笔写一个汉字消耗的质量约为1mg,那么这个汉字中含有的碳原子数约为
A. 2.5×1019 B. 2.5×1022 C. 5×1019 D. 5×1022
二、非选择题:本部分5题,共40分。
21.(10分)根据信息书写反应的化学方程式或物质的化学式:
(1)NO是制备硝酸的中间产物,生成NO的化学方程式为:,则X的化学式为: ▲ 。
(2)三氧化二铬(Cr2O3,碱性氧化物)溶于硫酸的化学方程式: ▲ 。
(3)我国科学家侯德榜先生发明了“联合制碱法”,其原理是向饱和食盐水中通入足量的NH3再通入足量CO2会有固体NaHCO3析出,写出该反应的化学方程式: ▲ 。
(4)用氨水吸收工厂烟气中的SO2(酸性氧化物),能有效减少SO2对空气的污染,写出用足量的氨水吸收SO2的化学方程式: ▲ 。
(5)写出一例铵盐与强碱在加热条件下反应的化学方程式: ▲ 。
22.(6分)铁黑[Fe3O4]是常见的含铁颜料。工业上可利用钛白工业的副产品硫酸亚铁,以及氨水,空气等,经过如下图所示的一系列生产步骤来制取铁黑。
从合成到干燥阶段发生反应的化学方程式如下:
①
②
③
(1)上述三个反应属于氧化还原反应的是 ▲ (写编号)。
(2)加入氨水调至碱性时主要发生的化学方程式: ▲ 。
(3)合成步骤中通入空气的目的: ▲ 。
23.(8分)海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤③的实验操作名称是 ▲ ;步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是 ▲ ;
(2)步骤⑤中,某学生选择用苯来提取碘的理由是 ▲ ,还可选用 ▲ (写试剂的化学式),该步骤所用主要玻璃仪器的名称是 ▲ 。
(3)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法是: ▲ 。
24.(8分)某兴趣小组测定Na2SO4·xH2O晶体中x的值的过程如下:
①称取32.2gNa2SO4·xH2O晶体溶于适量的水中。
②向上述溶液中边搅拌边加入BaCl2溶液至沉淀不再产生。
③经过滤、洗涤、干燥、称量得到23.3g白色沉淀。
(1)步骤③中洗涤的目的是除去沉淀表面的杂质离子。确认该沉淀洗涤干净的实验方法是 ▲ 。
(2)试计算x的值(写出计算步骤)。
25.(8分)实验探究酸性氧化物与碱的反应,以“CO2与NaOH溶液反应为例”,实验装置见图1。
实验过程
【方案1】CO2溶于水
①用三颈烧瓶收集满CO2。
②用注射器取4mL蒸馏水注入三颈烧瓶。
③通过气体压强传感器获得三颈烧瓶内气体的压强变化如图2中所示曲线。
【方案2】CO2与NaOH溶液反应
用NaOH溶液替换蒸馏水,重复上述方案1中的步骤,观察到三颈烧瓶内压强如图2中所示曲线。
根据上述实验,请回答下列问题:
(1)CO2与足量NaOH溶液反应的化学方程式: ▲ 。
(2)CO2溶于水的压强变化曲线: ▲ (写编号)。
(3)曲线②先升高后下降的原因: ▲ 。
高一化学参考答案与评分标准
一、单项选择题:本题包括20小题,每小题3分,共60分。每小题只有一个选项符合题意。
1.C 2.D 3.C 4.A 5.C 6.C 7.A 8.B 9.D 10.B
11.D 12.A 13.C 14.D 15.A 16.C 17.C 18.D 19.C 20.A
二、非选择题:(本部分5题,共40分)
21.(1)NH3
(2)Cr2O3+3 H2SO4= Cr2(SO4)3+ 3H2O
(3)NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
(4)2NH3·H2O+SO2=(NH4)2SO3+H2O
(5)
【每空2分,共10分,第(5)合理即给分】
22.(1)①
(2)
(3)将部分Fe(OH)2氧化为Fe(OH)3
【每空2分,共6分】
23.(1)过滤(1分) 蒸馏 (1分)
(2)苯与水互不相溶,碘在苯中的溶解度比在水中大(2分)CCl4(1分)分液漏斗(1分)
(3)取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色,如果变蓝,说明还有碘(2分) 【共8分】
24.(1)取少量最后一次洗涤液于试管中,加入几滴硝酸银溶液和稀硝酸,如无明显现象则证明沉淀已洗涤干净。(2分)
(2)
【共8分】
25.(1)2NaOH+CO2=Na2CO3+H2O (2分)
(2)① (2分)
(3)注射器中4mLNaOH溶液注入三颈烧瓶中,溶液增加的体积大于二氧化碳被吸收的体积,三颈烧瓶内的压强增大,曲线上升;随后氢氧化钠溶液吸收大量的二氧化碳,压强下降,曲线下降。 (4分)
【共8分】
化学学科试题
注意事项:
1.本试卷分为选择题和非选择题两部分,总分:100分。考试时间:75分钟。
2.请把答案写在答题卡的指定栏目内。
可能用到的相对原子质量:H1 C12 O16 Na23 S32 Ba137
一、单项选择题:本题包括20小题,每小题3分,共计60分。每小题只有一个选项符合题意。
1.运输浓硫酸的槽罐车应悬挂的危险化学品标志是
A. B. C. D.
2.许多化学物质在日常生活中有俗名。下列物质的俗名与化学式对应正确的是
A.双氧水—Na2O2 B.小苏打—NaOH
C.胆矾—Cu(OH)2 D.干冰—CO2
3.K2FeO4是一种高效水处理剂。它属于
A.酸 B.碱 C.盐 D.单质
4.下列电离方程式,书写正确的是
A. B.
C. D.
5.胶体和溶液的本质区别在于
A.分散系是否有颜色 B.分散系是否均匀
C.分散质粒子的直径 D.是否发生丁达尔效应
6.下列物质属于电解质的是
A. NaOH溶液 B.乙醇 C.熔融KNO3 D. NH3
7.下列混合物,可依次用溶解、过滤、蒸发操作进行分离的是
A.混有泥沙的食盐 B.混有水的酒精
C.白糖与食盐的混合物 D.铁粉与泥沙的混合物
8.能够用于鉴别氯化钡、氯化钠、碳酸钠三种物质的试剂是
A.硝酸银溶液 B.稀硫酸
C.氢氧化钾溶液 D.氢氧化钠溶液
9.标准状况下,下列物质所占体积最大的是
A. 360gH2O B. 32gO2
C. 1.5molH2 D.约3.01×1024个氮分子
10. KClO3和MnO2反应制取O2的化学方程式为:。下列制取O2并回收MnO2和KCl的装置和原理正确,且能达到实验目的的是
A.制取O2 B.固体混合物溶解 C.过滤回收MnO2 D.蒸发回收KCl
11.有一份样品,可能是下列物质中的一种或几种:CuSO4、BaSO4、KOH、NaCl、CaCO3。对该样品进行初步测试后,得出如下图所示的结果。该白色粉末是
白色粉末 能溶于水 无色 呈强碱性
A.一定是KOH B.一定是KOH、NaCl混合物
C.可能是KOH、CaCO3混合物 D.可能是KOH、NaCl混合物
12.不同温度下,某固体物质X在四种溶剂中的溶解度变化如右图所示。更适宜用冷却结晶提纯X的溶剂
A.溶剂A B.溶剂B C.溶剂C D.溶剂D
13.下列关于仪器使用和操作的说法中不正确的是
A.蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
B.除去KNO3中少量NaCl:将混合物制成热的饱和溶液,冷却结晶,过滤
C.蒸馏时温度计水银球可以高于蒸馏烧瓶支管口
D.振摇分液漏斗时应关闭其玻璃塞和活塞
14.下列关于物质聚集状态的说法正确的是
A.气体有固定的形状和体积
B.固体、液体不易被压缩的原因是构成的粒子直径太大
C.影响物质聚集状态的外界因素是温度
D.不同聚集状态的物质其内部微粒之间的平均距离、运动方式不相同
15.有相同氧原子数目的Fe3O4和Fe2O3,它们的物质的量之比为
A. 3∶4 B. 4∶3 C. 2∶3 D. 2∶1
16.分子数相等的任何物质具有相同的
A.质量 B.体积 C.物质的量 D.摩尔质量
17.实验室用高锰酸钾制备氧气,现欲制取1.12L(标准状况)氧气,理论消耗高锰酸钾的物质的量
A. 0.5mol B. 0.05mol C. 0.1mol D. 0.01mol
18.以下表示的是碳及其化合物的转化关系,其中涉及的基本反应类型依次是
A.化合、置换、分解、复分解
B.置换、复分解、化合、分解
C.置换、化合、分解、复分解
D.置换、化合、复分解、分解
19.某一由硫酸钾、硫酸铝和硫酸组成的混合溶液中:,,,则为
A. 0.15mol B. 0.2mol C. 0.3mol D. 0.4mol
20.铅笔芯的主要成分石墨和粘土,假设铅笔芯质量的一半是石墨(其余的组成物质中不含碳),用铅笔写一个汉字消耗的质量约为1mg,那么这个汉字中含有的碳原子数约为
A. 2.5×1019 B. 2.5×1022 C. 5×1019 D. 5×1022
二、非选择题:本部分5题,共40分。
21.(10分)根据信息书写反应的化学方程式或物质的化学式:
(1)NO是制备硝酸的中间产物,生成NO的化学方程式为:,则X的化学式为: ▲ 。
(2)三氧化二铬(Cr2O3,碱性氧化物)溶于硫酸的化学方程式: ▲ 。
(3)我国科学家侯德榜先生发明了“联合制碱法”,其原理是向饱和食盐水中通入足量的NH3再通入足量CO2会有固体NaHCO3析出,写出该反应的化学方程式: ▲ 。
(4)用氨水吸收工厂烟气中的SO2(酸性氧化物),能有效减少SO2对空气的污染,写出用足量的氨水吸收SO2的化学方程式: ▲ 。
(5)写出一例铵盐与强碱在加热条件下反应的化学方程式: ▲ 。
22.(6分)铁黑[Fe3O4]是常见的含铁颜料。工业上可利用钛白工业的副产品硫酸亚铁,以及氨水,空气等,经过如下图所示的一系列生产步骤来制取铁黑。
从合成到干燥阶段发生反应的化学方程式如下:
①
②
③
(1)上述三个反应属于氧化还原反应的是 ▲ (写编号)。
(2)加入氨水调至碱性时主要发生的化学方程式: ▲ 。
(3)合成步骤中通入空气的目的: ▲ 。
23.(8分)海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤③的实验操作名称是 ▲ ;步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是 ▲ ;
(2)步骤⑤中,某学生选择用苯来提取碘的理由是 ▲ ,还可选用 ▲ (写试剂的化学式),该步骤所用主要玻璃仪器的名称是 ▲ 。
(3)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法是: ▲ 。
24.(8分)某兴趣小组测定Na2SO4·xH2O晶体中x的值的过程如下:
①称取32.2gNa2SO4·xH2O晶体溶于适量的水中。
②向上述溶液中边搅拌边加入BaCl2溶液至沉淀不再产生。
③经过滤、洗涤、干燥、称量得到23.3g白色沉淀。
(1)步骤③中洗涤的目的是除去沉淀表面的杂质离子。确认该沉淀洗涤干净的实验方法是 ▲ 。
(2)试计算x的值(写出计算步骤)。
25.(8分)实验探究酸性氧化物与碱的反应,以“CO2与NaOH溶液反应为例”,实验装置见图1。
实验过程
【方案1】CO2溶于水
①用三颈烧瓶收集满CO2。
②用注射器取4mL蒸馏水注入三颈烧瓶。
③通过气体压强传感器获得三颈烧瓶内气体的压强变化如图2中所示曲线。
【方案2】CO2与NaOH溶液反应
用NaOH溶液替换蒸馏水,重复上述方案1中的步骤,观察到三颈烧瓶内压强如图2中所示曲线。
根据上述实验,请回答下列问题:
(1)CO2与足量NaOH溶液反应的化学方程式: ▲ 。
(2)CO2溶于水的压强变化曲线: ▲ (写编号)。
(3)曲线②先升高后下降的原因: ▲ 。
高一化学参考答案与评分标准
一、单项选择题:本题包括20小题,每小题3分,共60分。每小题只有一个选项符合题意。
1.C 2.D 3.C 4.A 5.C 6.C 7.A 8.B 9.D 10.B
11.D 12.A 13.C 14.D 15.A 16.C 17.C 18.D 19.C 20.A
二、非选择题:(本部分5题,共40分)
21.(1)NH3
(2)Cr2O3+3 H2SO4= Cr2(SO4)3+ 3H2O
(3)NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
(4)2NH3·H2O+SO2=(NH4)2SO3+H2O
(5)
【每空2分,共10分,第(5)合理即给分】
22.(1)①
(2)
(3)将部分Fe(OH)2氧化为Fe(OH)3
【每空2分,共6分】
23.(1)过滤(1分) 蒸馏 (1分)
(2)苯与水互不相溶,碘在苯中的溶解度比在水中大(2分)CCl4(1分)分液漏斗(1分)
(3)取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色,如果变蓝,说明还有碘(2分) 【共8分】
24.(1)取少量最后一次洗涤液于试管中,加入几滴硝酸银溶液和稀硝酸,如无明显现象则证明沉淀已洗涤干净。(2分)
(2)
【共8分】
25.(1)2NaOH+CO2=Na2CO3+H2O (2分)
(2)① (2分)
(3)注射器中4mLNaOH溶液注入三颈烧瓶中,溶液增加的体积大于二氧化碳被吸收的体积,三颈烧瓶内的压强增大,曲线上升;随后氢氧化钠溶液吸收大量的二氧化碳,压强下降,曲线下降。 (4分)
【共8分】
同课章节目录
