第八单元 课题2金属的化学性质 第1课时同步练习—2020—2021学年九年级化学人教版下册(含解析)
文档属性
| 名称 | 第八单元 课题2金属的化学性质 第1课时同步练习—2020—2021学年九年级化学人教版下册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 172.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-21 17:16:04 | ||
图片预览


文档简介
第八单元 课题2金属的化学性质 第1课时
一、选择题
1.取相同形状和大小的金属片分别在空气中加热,能燃烧的是 ( )
A.金 B.铜 C.镁 D.铁
2.[2020·北京] 下列不能与稀盐酸反应的金属是 ( )
A.Cu B.Zn C.Al D.Mg
3.下列化学反应不属于置换反应的是 ( )
A.Mg+2HClMgCl2+H2↑
B.Fe+CuSO4Cu+FeSO4
C.3CO+Fe2O32Fe+3CO2
D.C+2CuO 2Cu+CO2↑
4.下列有关实验现象的描述正确的是 ( )
A.镁条在空气中燃烧,发出白光,生成黑色固体
B.细铁丝在氧气中燃烧,火星四射,生成四氧化三铁
C.铁与稀盐酸反应后溶液颜色由无色变成了浅绿色
D.铜丝放入稀硫酸中有气泡冒出
5.黄金是一种贵重金属,它不仅被视为美好和富有的象征,还以其特有的价值造福于人类。“真金不怕火炼”主要是指金 ( )
A.熔点高 B.延展性好 C.有金属光泽 D.化学性质稳定
6.将铁片和铜片分别放入稀硫酸中,铁片表面有气泡产生,而铜片表面无明显现象,通过这一现象可以判断 ( )
A.铁的硬度比铜大 B.铁的金属活动性比铜强
C.铁的导电性比铜强 D.铁的金属活动性比铜弱
7.下列金属制品中最不容易被酸雨腐蚀的是 ( )
A.镀锌水管 B.铜质器皿
C.铁质栏杆 D.镁合金的飞机外壳
8.对于金光闪闪的“假金元宝”(含铜和锌的合金),你认为下列鉴别方法不可行的是 ( )
A.用火烧 B.加入稀硫酸 C.测密度 D.看颜色
9.相同质量的下列金属分别与足量稀盐酸反应,生成氢气最多的是 ( )
A.Al B.Mg C.Fe D.Zn
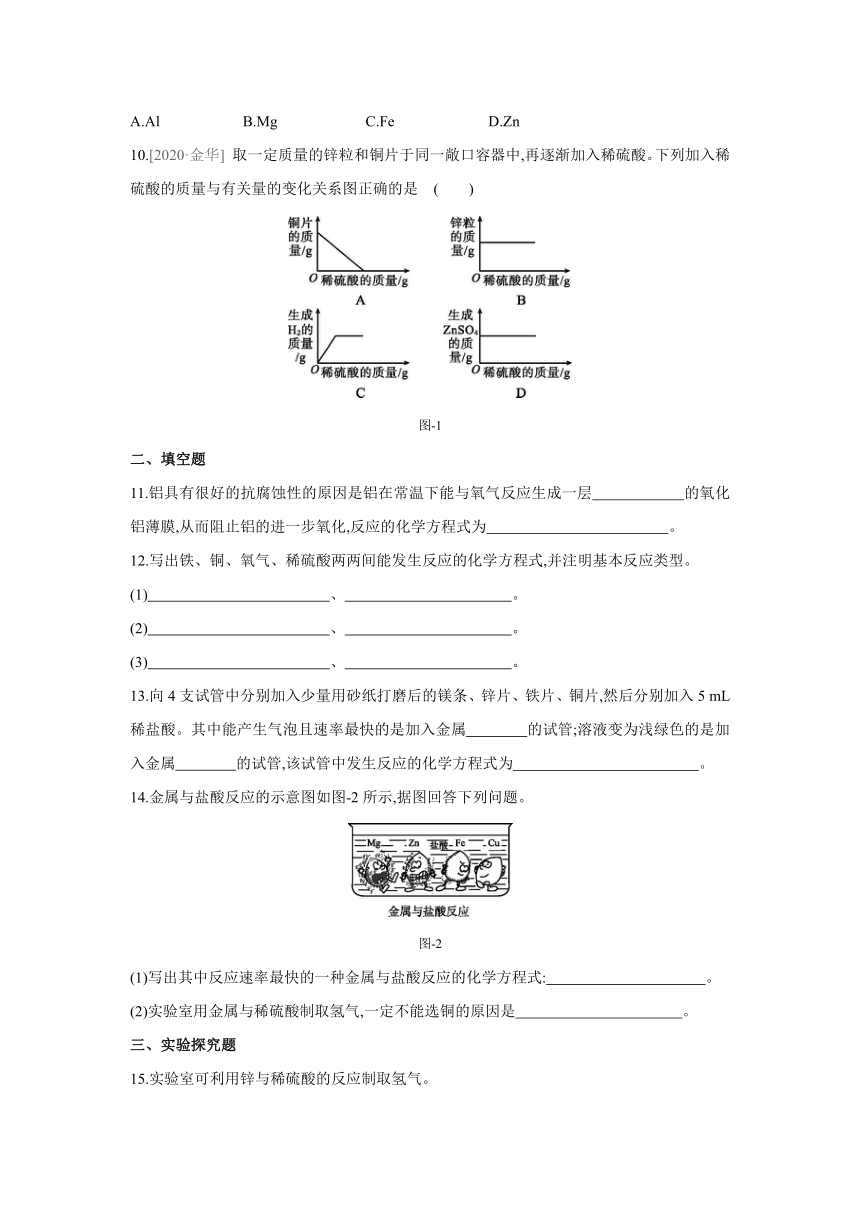
10.[2020·金华] 取一定质量的锌粒和铜片于同一敞口容器中,再逐渐加入稀硫酸。下列加入稀硫酸的质量与有关量的变化关系图正确的是 ( )
图-1
二、填空题
11.铝具有很好的抗腐蚀性的原因是铝在常温下能与氧气反应生成一层 的氧化铝薄膜,从而阻止铝的进一步氧化,反应的化学方程式为 。
12.写出铁、铜、氧气、稀硫酸两两间能发生反应的化学方程式,并注明基本反应类型。
(1) 、 。
(2) 、 。
(3) 、 。
13.向4支试管中分别加入少量用砂纸打磨后的镁条、锌片、铁片、铜片,然后分别加入5 mL稀盐酸。其中能产生气泡且速率最快的是加入金属 的试管;溶液变为浅绿色的是加入金属 的试管,该试管中发生反应的化学方程式为 。
14.金属与盐酸反应的示意图如图-2所示,据图回答下列问题。
图-2
(1)写出其中反应速率最快的一种金属与盐酸反应的化学方程式: 。
(2)实验室用金属与稀硫酸制取氢气,一定不能选铜的原因是 。
三、实验探究题
15.实验室可利用锌与稀硫酸的反应制取氢气。
为探究影响锌与稀硫酸反应快慢的因素,进行以下三组实验,室温下,取颗粒大小相同的锌粒与足量的稀硫酸反应,测量产生10 mL 氢气(通常状况)所需的时间,下表为实验数据:
实验编号 硫酸的质量分数/% 硫酸的体积/mL 锌粒的质量/g 时间/s
1 10 10 1 78
2 10 10 2 57
3 40 10 1 9
(1)比较实验1、2的数据,可以得出的结论是 。
(2)由实验数据可知,该实验中对锌与稀硫酸反应快慢影响较大的因素是 。
(3)比较不同条件下锌粒与稀硫酸反应的快慢有不同的方法,除测量产生相同体积的氢气所需的时间,还可采用的测量方法是 (写出一种)。
四、计算题
16.[2020·东莞] 为测定某铁粉样品(含少量木炭粉)中铁的含量,往盛有足量稀盐酸的烧杯中不断加入铁粉样品,测得生成氢气质量与所加铁粉样品质量的关系如图-3所示。
(1)稀盐酸恰好完全反应时,生成氢气的质量为 g。
(2)求该铁粉样品中铁的质量分数(写出计算过程,结果保留1位小数)。
(3)从上述铁粉样品中分离出纯铁粉的方法是 。
图-3
【能力提升】
17.[2021·达州] 已知一包铁粉中含有两种杂质,小明同学取5.6 g该粉末,向其中加入足量的稀硫酸,充分反应后,得到0.5 g氢气。则该样品中的杂质可能是 ( )
A.Mg和Zn B.Al和Zn
C.Zn和Cu D.Mg和Cu
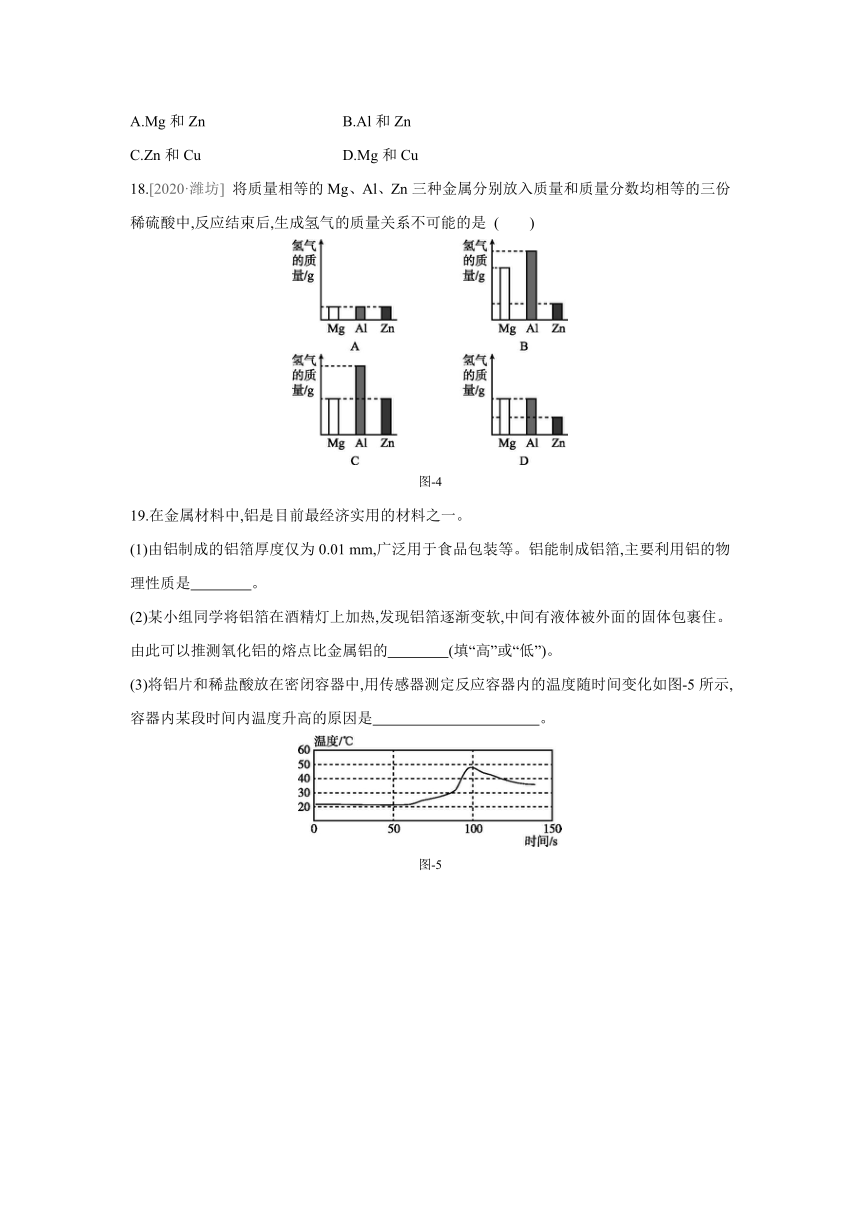
18.[2020·潍坊] 将质量相等的Mg、Al、Zn三种金属分别放入质量和质量分数均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系不可能的是 ( )
图-4
19.在金属材料中,铝是目前最经济实用的材料之一。
(1)由铝制成的铝箔厚度仅为0.01 mm,广泛用于食品包装等。铝能制成铝箔,主要利用铝的物理性质是 。
(2)某小组同学将铝箔在酒精灯上加热,发现铝箔逐渐变软,中间有液体被外面的固体包裹住。由此可以推测氧化铝的熔点比金属铝的 (填“高”或“低”)。
(3)将铝片和稀盐酸放在密闭容器中,用传感器测定反应容器内的温度随时间变化如图-5所示,容器内某段时间内温度升高的原因是 。
图-5
答案解析
1.C 2.A 3.C 4.C
5.D [解析] 金在高温的条件下也不与氧气反应,说明金的化学性质稳定。
6.B
7.B [解析] 铜与盐酸及稀硫酸不反应,故最不容易被酸雨腐蚀。
8.D [解析] “假金元宝”的颜色与真金元宝的颜色一致,仅凭颜色无法鉴别。
9.A [解析] 等质量的金属与足量的稀酸反应产生氢气的多少,可利用“”来判断,比值越小,产生的氢气越多,反之,产生的氢气越少。
10.C [解析] 铜不与稀硫酸反应,铜片的质量在加入稀硫酸后不变;锌能与稀硫酸反应,随着稀硫酸的加入,锌粒质量逐渐减少直至为零;随着稀硫酸的加入,氢气和硫酸锌的质量由零逐渐增加,直至锌粒完全反应后不再增加。
11.致密 4Al+3O22Al2O3
12.(1)3Fe+2O2Fe3O4 化合反应
(2)Fe+H2SO4FeSO4+H2↑ 置换反应
(3)2Cu+O22CuO 化合反应
13.镁 铁 Fe+2HClFeCl2+H2↑
14.(1)Mg+2HClMgCl2+H2 ↑
(2)铜与稀硫酸不反应
15.(1)硫酸的质量分数、体积一定时,锌粒的质量越大,反应速率越快
(2)硫酸的质量分数 (3)相同时间内产生氢气的体积(合理即可)
[解析] (1)比较实验1、2的数据可知,在硫酸的质量分数、体积相同时,锌粒的质量越大,产生10 mL 氢气(通常状况)所需的时间越短,即反应越快。(2)由实验1、3的数据可知,在锌粒质量相同的条件下,硫酸的质量分数越大,产生10 mL氢气(通常状况)所需的时间越短,且所用时间比实验2少得多,说明该实验中对锌与稀硫酸反应快慢影响较大的因素是硫酸的质量分数。(3)比较不同条件下锌粒与稀硫酸反应的快慢有不同的方法,除测量产生相同体积的氢气所需的时间,还可采用测量相同时间内产生氢气的体积多少的方法。
16.(1)0.6
(2)解:设18 g样品中铁的质量为x。
Fe+2HClFeCl2+H2↑
56 2
x 0.6 g
= x=16.8 g
该铁粉样品中铁的质量分数为×100%=93.3%。
答:该铁粉样品中铁的质量分数为93.3%。
(3)利用磁铁吸引(合理即可)
[解析] (1)曲线达到拐点时,说明稀盐酸恰好完全反应,此时生成氢气的质量为0.6 g。(2)依据化学方程式,代入氢气质量可以求出18 g样品中铁的质量,然后再计算铁的质量分数。
17.B [解析] 5.6 g铁、锌、镁、铝与稀硫酸反应生成氢气的质量分别为
Fe+H2SO4FeSO4+H2↑
56 2
5.6 g 0.2 g
Zn+H2SO4ZnSO4+H2↑
65 2
5.6 g 0.17 g
Mg+H2SO4MgSO4+H2↑
24 2
5.6 g 0.47 g
2Al+3H2SO4Al2(SO4)3+3H2↑
54 6
5.6 g 0.62 g
铜和稀硫酸不反应。
由分析可知,样品中必定含铝。
18.C [解析] 如果稀硫酸不足,生成氢气的质量决定于硫酸,生成氢气的质量相等;如果稀硫酸都过量,生成氢气的质量决定于金属单质,质量相等的镁、铝、锌与足量稀硫酸反应生成氢气质量的大小关系是:铝>镁>锌;无论金属单质质量、硫酸质量是多少,都不会出现铝反应生成氢气质量最大,镁和锌反应生成氢气质量相等的情况;如果稀硫酸恰好和锌完全反应,则铝、镁过量,此时镁、铝反应生成氢气质量相等,并且大于锌反应生成的氢气质量。
19.(1)延展性 (2)高 (3)铝与稀盐酸反应放热,使容器内温度升高
[解析] (1)铝能制成铝箔,是因为铝具有良好的延展性。(2)铝的表面有一层致密的氧化铝薄膜,将铝箔在酒精灯上加热,发现铝箔逐渐变软,中间有液体被外面的固体包裹,说明外面的氧化铝固体的熔点高。
一、选择题
1.取相同形状和大小的金属片分别在空气中加热,能燃烧的是 ( )
A.金 B.铜 C.镁 D.铁
2.[2020·北京] 下列不能与稀盐酸反应的金属是 ( )
A.Cu B.Zn C.Al D.Mg
3.下列化学反应不属于置换反应的是 ( )
A.Mg+2HClMgCl2+H2↑
B.Fe+CuSO4Cu+FeSO4
C.3CO+Fe2O32Fe+3CO2
D.C+2CuO 2Cu+CO2↑
4.下列有关实验现象的描述正确的是 ( )
A.镁条在空气中燃烧,发出白光,生成黑色固体
B.细铁丝在氧气中燃烧,火星四射,生成四氧化三铁
C.铁与稀盐酸反应后溶液颜色由无色变成了浅绿色
D.铜丝放入稀硫酸中有气泡冒出
5.黄金是一种贵重金属,它不仅被视为美好和富有的象征,还以其特有的价值造福于人类。“真金不怕火炼”主要是指金 ( )
A.熔点高 B.延展性好 C.有金属光泽 D.化学性质稳定
6.将铁片和铜片分别放入稀硫酸中,铁片表面有气泡产生,而铜片表面无明显现象,通过这一现象可以判断 ( )
A.铁的硬度比铜大 B.铁的金属活动性比铜强
C.铁的导电性比铜强 D.铁的金属活动性比铜弱
7.下列金属制品中最不容易被酸雨腐蚀的是 ( )
A.镀锌水管 B.铜质器皿
C.铁质栏杆 D.镁合金的飞机外壳
8.对于金光闪闪的“假金元宝”(含铜和锌的合金),你认为下列鉴别方法不可行的是 ( )
A.用火烧 B.加入稀硫酸 C.测密度 D.看颜色
9.相同质量的下列金属分别与足量稀盐酸反应,生成氢气最多的是 ( )
A.Al B.Mg C.Fe D.Zn
10.[2020·金华] 取一定质量的锌粒和铜片于同一敞口容器中,再逐渐加入稀硫酸。下列加入稀硫酸的质量与有关量的变化关系图正确的是 ( )
图-1
二、填空题
11.铝具有很好的抗腐蚀性的原因是铝在常温下能与氧气反应生成一层 的氧化铝薄膜,从而阻止铝的进一步氧化,反应的化学方程式为 。
12.写出铁、铜、氧气、稀硫酸两两间能发生反应的化学方程式,并注明基本反应类型。
(1) 、 。
(2) 、 。
(3) 、 。
13.向4支试管中分别加入少量用砂纸打磨后的镁条、锌片、铁片、铜片,然后分别加入5 mL稀盐酸。其中能产生气泡且速率最快的是加入金属 的试管;溶液变为浅绿色的是加入金属 的试管,该试管中发生反应的化学方程式为 。
14.金属与盐酸反应的示意图如图-2所示,据图回答下列问题。
图-2
(1)写出其中反应速率最快的一种金属与盐酸反应的化学方程式: 。
(2)实验室用金属与稀硫酸制取氢气,一定不能选铜的原因是 。
三、实验探究题
15.实验室可利用锌与稀硫酸的反应制取氢气。
为探究影响锌与稀硫酸反应快慢的因素,进行以下三组实验,室温下,取颗粒大小相同的锌粒与足量的稀硫酸反应,测量产生10 mL 氢气(通常状况)所需的时间,下表为实验数据:
实验编号 硫酸的质量分数/% 硫酸的体积/mL 锌粒的质量/g 时间/s
1 10 10 1 78
2 10 10 2 57
3 40 10 1 9
(1)比较实验1、2的数据,可以得出的结论是 。
(2)由实验数据可知,该实验中对锌与稀硫酸反应快慢影响较大的因素是 。
(3)比较不同条件下锌粒与稀硫酸反应的快慢有不同的方法,除测量产生相同体积的氢气所需的时间,还可采用的测量方法是 (写出一种)。
四、计算题
16.[2020·东莞] 为测定某铁粉样品(含少量木炭粉)中铁的含量,往盛有足量稀盐酸的烧杯中不断加入铁粉样品,测得生成氢气质量与所加铁粉样品质量的关系如图-3所示。
(1)稀盐酸恰好完全反应时,生成氢气的质量为 g。
(2)求该铁粉样品中铁的质量分数(写出计算过程,结果保留1位小数)。
(3)从上述铁粉样品中分离出纯铁粉的方法是 。
图-3
【能力提升】
17.[2021·达州] 已知一包铁粉中含有两种杂质,小明同学取5.6 g该粉末,向其中加入足量的稀硫酸,充分反应后,得到0.5 g氢气。则该样品中的杂质可能是 ( )
A.Mg和Zn B.Al和Zn
C.Zn和Cu D.Mg和Cu
18.[2020·潍坊] 将质量相等的Mg、Al、Zn三种金属分别放入质量和质量分数均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系不可能的是 ( )
图-4
19.在金属材料中,铝是目前最经济实用的材料之一。
(1)由铝制成的铝箔厚度仅为0.01 mm,广泛用于食品包装等。铝能制成铝箔,主要利用铝的物理性质是 。
(2)某小组同学将铝箔在酒精灯上加热,发现铝箔逐渐变软,中间有液体被外面的固体包裹住。由此可以推测氧化铝的熔点比金属铝的 (填“高”或“低”)。
(3)将铝片和稀盐酸放在密闭容器中,用传感器测定反应容器内的温度随时间变化如图-5所示,容器内某段时间内温度升高的原因是 。
图-5
答案解析
1.C 2.A 3.C 4.C
5.D [解析] 金在高温的条件下也不与氧气反应,说明金的化学性质稳定。
6.B
7.B [解析] 铜与盐酸及稀硫酸不反应,故最不容易被酸雨腐蚀。
8.D [解析] “假金元宝”的颜色与真金元宝的颜色一致,仅凭颜色无法鉴别。
9.A [解析] 等质量的金属与足量的稀酸反应产生氢气的多少,可利用“”来判断,比值越小,产生的氢气越多,反之,产生的氢气越少。
10.C [解析] 铜不与稀硫酸反应,铜片的质量在加入稀硫酸后不变;锌能与稀硫酸反应,随着稀硫酸的加入,锌粒质量逐渐减少直至为零;随着稀硫酸的加入,氢气和硫酸锌的质量由零逐渐增加,直至锌粒完全反应后不再增加。
11.致密 4Al+3O22Al2O3
12.(1)3Fe+2O2Fe3O4 化合反应
(2)Fe+H2SO4FeSO4+H2↑ 置换反应
(3)2Cu+O22CuO 化合反应
13.镁 铁 Fe+2HClFeCl2+H2↑
14.(1)Mg+2HClMgCl2+H2 ↑
(2)铜与稀硫酸不反应
15.(1)硫酸的质量分数、体积一定时,锌粒的质量越大,反应速率越快
(2)硫酸的质量分数 (3)相同时间内产生氢气的体积(合理即可)
[解析] (1)比较实验1、2的数据可知,在硫酸的质量分数、体积相同时,锌粒的质量越大,产生10 mL 氢气(通常状况)所需的时间越短,即反应越快。(2)由实验1、3的数据可知,在锌粒质量相同的条件下,硫酸的质量分数越大,产生10 mL氢气(通常状况)所需的时间越短,且所用时间比实验2少得多,说明该实验中对锌与稀硫酸反应快慢影响较大的因素是硫酸的质量分数。(3)比较不同条件下锌粒与稀硫酸反应的快慢有不同的方法,除测量产生相同体积的氢气所需的时间,还可采用测量相同时间内产生氢气的体积多少的方法。
16.(1)0.6
(2)解:设18 g样品中铁的质量为x。
Fe+2HClFeCl2+H2↑
56 2
x 0.6 g
= x=16.8 g
该铁粉样品中铁的质量分数为×100%=93.3%。
答:该铁粉样品中铁的质量分数为93.3%。
(3)利用磁铁吸引(合理即可)
[解析] (1)曲线达到拐点时,说明稀盐酸恰好完全反应,此时生成氢气的质量为0.6 g。(2)依据化学方程式,代入氢气质量可以求出18 g样品中铁的质量,然后再计算铁的质量分数。
17.B [解析] 5.6 g铁、锌、镁、铝与稀硫酸反应生成氢气的质量分别为
Fe+H2SO4FeSO4+H2↑
56 2
5.6 g 0.2 g
Zn+H2SO4ZnSO4+H2↑
65 2
5.6 g 0.17 g
Mg+H2SO4MgSO4+H2↑
24 2
5.6 g 0.47 g
2Al+3H2SO4Al2(SO4)3+3H2↑
54 6
5.6 g 0.62 g
铜和稀硫酸不反应。
由分析可知,样品中必定含铝。
18.C [解析] 如果稀硫酸不足,生成氢气的质量决定于硫酸,生成氢气的质量相等;如果稀硫酸都过量,生成氢气的质量决定于金属单质,质量相等的镁、铝、锌与足量稀硫酸反应生成氢气质量的大小关系是:铝>镁>锌;无论金属单质质量、硫酸质量是多少,都不会出现铝反应生成氢气质量最大,镁和锌反应生成氢气质量相等的情况;如果稀硫酸恰好和锌完全反应,则铝、镁过量,此时镁、铝反应生成氢气质量相等,并且大于锌反应生成的氢气质量。
19.(1)延展性 (2)高 (3)铝与稀盐酸反应放热,使容器内温度升高
[解析] (1)铝能制成铝箔,是因为铝具有良好的延展性。(2)铝的表面有一层致密的氧化铝薄膜,将铝箔在酒精灯上加热,发现铝箔逐渐变软,中间有液体被外面的固体包裹,说明外面的氧化铝固体的熔点高。
同课章节目录
