第十单元 课题2 第1课时 中和反应 同步练习—2020-2021学年九年级化学人教版下册(含解析)
文档属性
| 名称 | 第十单元 课题2 第1课时 中和反应 同步练习—2020-2021学年九年级化学人教版下册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 197.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-21 20:18:42 | ||
图片预览


文档简介
第十单元 课题2 第1课时 中和反应
一、选择题
1.在滴加了酚酞的氢氧化钠溶液中,逐滴加入稀盐酸至过量,溶液颜色的变化是 ( )
A.红色-蓝色 B.蓝色-红色
C.红色-无色 D.无色-红色
2.下列反应属于中和反应的是 ( )
A.CuO+H2SO4CuSO4+H2O
B.CO2+Ca(OH)2CaCO3↓+H2O
C.2NaOH+H2SO4Na2SO4+2H2O
D.CaCO3+2HClCaCl2+H2O+CO2↑
3.蚊子、蚂蚁等昆虫叮咬人后,会向人体注入一种叫蚁酸(甲酸)的物质,使皮肤红肿疼痛。要减轻肿痛,可涂抹下列物质中的 ( )
A.氢氧化钠溶液 B.食醋
C.稀氨水 D.食盐水
4.下列说法正确的是 ( )
A.中和反应的反应物一定是酸和碱 B.生成盐和水的反应一定是中和反应
C.中和反应属于基本反应类型 D.氢氧化钠可用来改良酸性土壤
5.[2021·安徽] 中和反应在生产、生活中应用广泛。下列应用的主要原理不涉及中和反应的是 ( )
A.生石灰用于加热即热食品 B.氢氧化铝用于治疗胃酸过多
C.熟石灰用于改良酸性土壤 D.硼酸用于处理皮肤上沾有的碱
6.根据如图1所示实验,判断下列说法错误的是 ( )
图1
A.浓盐酸有挥发性
B.HCl分子在运动
C.Y杯溶液的颜色不会改变
D.Y杯内发生了中和反应
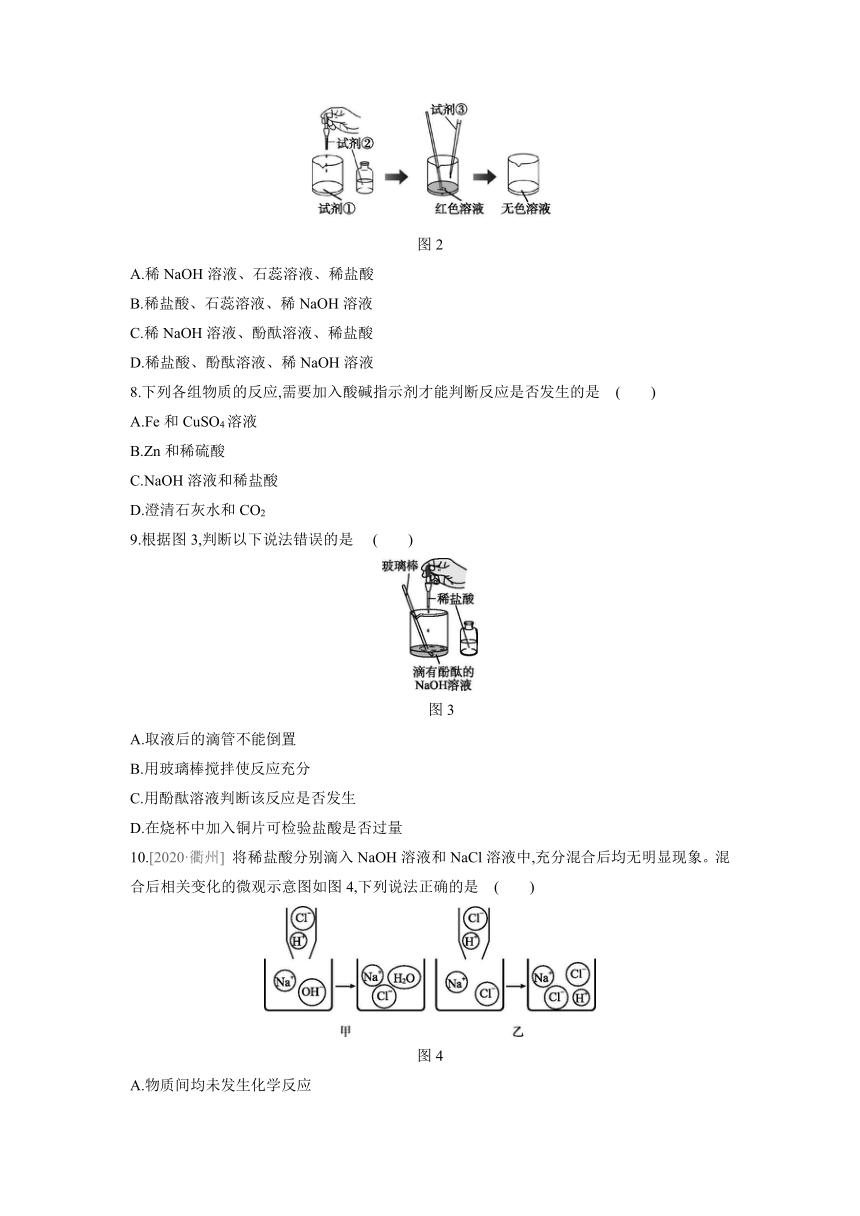
7.某同学在探究“酸与碱能否发生反应”时,用稀NaOH溶液、稀盐酸和酸碱指示剂进行实验的过程如图2所示。图中所加试剂①②③分别是 ( )
图2
A.稀NaOH溶液、石蕊溶液、稀盐酸
B.稀盐酸、石蕊溶液、稀NaOH溶液
C.稀NaOH溶液、酚酞溶液、稀盐酸
D.稀盐酸、酚酞溶液、稀NaOH溶液
8.下列各组物质的反应,需要加入酸碱指示剂才能判断反应是否发生的是 ( )
A.Fe和CuSO4溶液
B.Zn和稀硫酸
C.NaOH溶液和稀盐酸
D.澄清石灰水和CO2
9.根据图3,判断以下说法错误的是 ( )
图3
A.取液后的滴管不能倒置
B.用玻璃棒搅拌使反应充分
C.用酚酞溶液判断该反应是否发生
D.在烧杯中加入铜片可检验盐酸是否过量
10.[2020·衢州] 将稀盐酸分别滴入NaOH溶液和NaCl溶液中,充分混合后均无明显现象。混合后相关变化的微观示意图如图4,下列说法正确的是 ( )
图4
A.物质间均未发生化学反应
B.变化中都有新物质产生
C.混合后溶液酸碱性都不变
D.图甲可表示酸碱反应的实质
二、填空题
11.下列方法可以解决生活中的一些问题。
(1)服用含氢氧化铝的药物可以治疗胃酸过多症,反应的化学方程式为 。
(2)用熟石灰处理硫酸厂污水中含有的硫酸,反应的化学方程式为
。
(3)用稀盐酸除去热水瓶水垢中的碳酸钙,反应的化学方程式为 。
以上三个问题的解决方法中,应用了中和反应原理的是 (填序号)。
12. 如图5所示,在白色点滴板1~6的孔穴中,分别滴加2滴紫色石蕊溶液。
图5
(1)孔穴6中溶液变为蓝色,说明碳酸钾溶液显 (填“酸性”或“碱性”)。
(2)溶液变为红色的孔穴有 (填孔穴序号)。
(3)再向孔穴4中滴加稀硫酸,溶液变为紫色,用化学方程式解释其原因: 。
三、实验探究题
13.某化学兴趣小组用实验室常用药品(或溶液)对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究。
[知识卡片] 氯化钠溶液显中性。
[实验探究]
(1)方案Ⅰ:某同学先向试管中加入约2 mL NaOH溶液,再滴入几滴酚酞溶液,溶液变红。然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为无色。
①实验结论: 。
②从微观的角度分析,该反应的实质是 。
(2)方案Ⅱ:
实验步骤 实验现象 结论
取2 mL NaOH溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 若 稀盐酸过量
若没有明显现象 NaOH溶液与稀盐酸恰好完全反应
[实验反思]
(3)另有同学提出方案Ⅱ不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是
。
四、计算题
14.学习小组的同学通过如图6所示实验测定一瓶失去标签的稀硫酸中溶质的质量分数。请计算。
图6
(1)反应中用去稀硫酸的质量为 。
(2)稀硫酸中溶质的质量分数。
答案
1.C [解析] 无色酚酞溶液遇酸性、中性溶液不变色,遇碱性溶液变红。氢氧化钠溶液显碱性,能使酚酞溶液变为红色;逐滴加入稀盐酸至过量,氢氧化钠与盐酸反应生成氯化钠和水,恰好完全反应时溶液显中性,溶液由红色变为无色;至稀盐酸过量,溶液显酸性,溶液仍显无色,故溶液颜色的变化是红色-无色。
2.C [解析] NaOH是碱,H2SO4是酸,酸和碱作用生成盐和水的反应叫作中和反应。
3.C [解析] 消除蚁酸需涂抹碱性物质。氢氧化钠溶液碱性太强,且有强腐蚀性,不宜涂抹,可涂抹碱性较弱的稀氨水或肥皂水。
4.A
5.A [解析] 中和反应是酸和碱反应生成盐和水的过程。生石灰与水反应放热生成氢氧化钙,即CaO+H2OCa(OH)2,不是中和反应。
6.C
7.C [解析] 氢氧化钠溶液显碱性,可使酚酞溶液变红,当加入的盐酸与氢氧化钠恰好完全反应或盐酸过量时,溶液将变为无色。
8.C 9.D
10.D [解析] 由图甲可知,稀盐酸与氢氧化钠发生化学反应生成了氯化钠和水;图乙中稀盐酸与氯化钠溶液混合后,溶液中的离子没有发生变化,没有新物质生成;图甲中反应前盐酸显酸性,氢氧化钠溶液显碱性,混合后溶液显中性,溶液酸碱性发生了改变;图甲反应的实质是氢离子与氢氧根离子结合生成水分子,可表示酸碱反应的实质。
11.(1)Al(OH)3+3HClAlCl3+3H2O
(2)Ca(OH)2+H2SO4CaSO4+2H2O
(3)CaCO3+2HClCaCl2+H2O+CO2↑
(1)和(2)
[解析] 碳酸钙是盐,它与盐酸的反应不是中和反应。
12. (1)碱性
(2)2、5
(3)2NaOH+H2SO4Na2SO4+2H2O
[解析] (1)紫色石蕊遇碱性物质变蓝。(2)紫色石蕊遇酸性物质变红。(3)孔穴4中原来是氢氧化钠溶液,向其中滴加稀硫酸,发生中和反应,恰好完全反应时,溶液为紫色,反应的化学方程式为2NaOH+H2SO4Na2SO4+2H2O。
13.(1)①NaOH溶液与稀盐酸恰好完全反应
②氢离子和氢氧根离子结合生成水分子
(2)有气泡产生
(3)在稀盐酸量不足的情况下,也无明显现象
[解析] (2)当稀盐酸过量时,加入镁条能与之反应生成氢气,会观察到有气泡产生。(3)当稀盐酸的量不足时,加入镁条也没有明显的现象,所以该方案不能证明NaOH溶液与稀盐酸恰好完全反应。
14.(1)20 g
(2)解:设稀硫酸中溶质的质量分数为x。
H2SO4 + 2NaOHNa2SO4+2H2O
98 80
20 g×x 20 g×20%
= x=24.5%
答:稀硫酸中溶质的质量分数为24.5%。
一、选择题
1.在滴加了酚酞的氢氧化钠溶液中,逐滴加入稀盐酸至过量,溶液颜色的变化是 ( )
A.红色-蓝色 B.蓝色-红色
C.红色-无色 D.无色-红色
2.下列反应属于中和反应的是 ( )
A.CuO+H2SO4CuSO4+H2O
B.CO2+Ca(OH)2CaCO3↓+H2O
C.2NaOH+H2SO4Na2SO4+2H2O
D.CaCO3+2HClCaCl2+H2O+CO2↑
3.蚊子、蚂蚁等昆虫叮咬人后,会向人体注入一种叫蚁酸(甲酸)的物质,使皮肤红肿疼痛。要减轻肿痛,可涂抹下列物质中的 ( )
A.氢氧化钠溶液 B.食醋
C.稀氨水 D.食盐水
4.下列说法正确的是 ( )
A.中和反应的反应物一定是酸和碱 B.生成盐和水的反应一定是中和反应
C.中和反应属于基本反应类型 D.氢氧化钠可用来改良酸性土壤
5.[2021·安徽] 中和反应在生产、生活中应用广泛。下列应用的主要原理不涉及中和反应的是 ( )
A.生石灰用于加热即热食品 B.氢氧化铝用于治疗胃酸过多
C.熟石灰用于改良酸性土壤 D.硼酸用于处理皮肤上沾有的碱
6.根据如图1所示实验,判断下列说法错误的是 ( )
图1
A.浓盐酸有挥发性
B.HCl分子在运动
C.Y杯溶液的颜色不会改变
D.Y杯内发生了中和反应
7.某同学在探究“酸与碱能否发生反应”时,用稀NaOH溶液、稀盐酸和酸碱指示剂进行实验的过程如图2所示。图中所加试剂①②③分别是 ( )
图2
A.稀NaOH溶液、石蕊溶液、稀盐酸
B.稀盐酸、石蕊溶液、稀NaOH溶液
C.稀NaOH溶液、酚酞溶液、稀盐酸
D.稀盐酸、酚酞溶液、稀NaOH溶液
8.下列各组物质的反应,需要加入酸碱指示剂才能判断反应是否发生的是 ( )
A.Fe和CuSO4溶液
B.Zn和稀硫酸
C.NaOH溶液和稀盐酸
D.澄清石灰水和CO2
9.根据图3,判断以下说法错误的是 ( )
图3
A.取液后的滴管不能倒置
B.用玻璃棒搅拌使反应充分
C.用酚酞溶液判断该反应是否发生
D.在烧杯中加入铜片可检验盐酸是否过量
10.[2020·衢州] 将稀盐酸分别滴入NaOH溶液和NaCl溶液中,充分混合后均无明显现象。混合后相关变化的微观示意图如图4,下列说法正确的是 ( )
图4
A.物质间均未发生化学反应
B.变化中都有新物质产生
C.混合后溶液酸碱性都不变
D.图甲可表示酸碱反应的实质
二、填空题
11.下列方法可以解决生活中的一些问题。
(1)服用含氢氧化铝的药物可以治疗胃酸过多症,反应的化学方程式为 。
(2)用熟石灰处理硫酸厂污水中含有的硫酸,反应的化学方程式为
。
(3)用稀盐酸除去热水瓶水垢中的碳酸钙,反应的化学方程式为 。
以上三个问题的解决方法中,应用了中和反应原理的是 (填序号)。
12. 如图5所示,在白色点滴板1~6的孔穴中,分别滴加2滴紫色石蕊溶液。
图5
(1)孔穴6中溶液变为蓝色,说明碳酸钾溶液显 (填“酸性”或“碱性”)。
(2)溶液变为红色的孔穴有 (填孔穴序号)。
(3)再向孔穴4中滴加稀硫酸,溶液变为紫色,用化学方程式解释其原因: 。
三、实验探究题
13.某化学兴趣小组用实验室常用药品(或溶液)对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究。
[知识卡片] 氯化钠溶液显中性。
[实验探究]
(1)方案Ⅰ:某同学先向试管中加入约2 mL NaOH溶液,再滴入几滴酚酞溶液,溶液变红。然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为无色。
①实验结论: 。
②从微观的角度分析,该反应的实质是 。
(2)方案Ⅱ:
实验步骤 实验现象 结论
取2 mL NaOH溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 若 稀盐酸过量
若没有明显现象 NaOH溶液与稀盐酸恰好完全反应
[实验反思]
(3)另有同学提出方案Ⅱ不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是
。
四、计算题
14.学习小组的同学通过如图6所示实验测定一瓶失去标签的稀硫酸中溶质的质量分数。请计算。
图6
(1)反应中用去稀硫酸的质量为 。
(2)稀硫酸中溶质的质量分数。
答案
1.C [解析] 无色酚酞溶液遇酸性、中性溶液不变色,遇碱性溶液变红。氢氧化钠溶液显碱性,能使酚酞溶液变为红色;逐滴加入稀盐酸至过量,氢氧化钠与盐酸反应生成氯化钠和水,恰好完全反应时溶液显中性,溶液由红色变为无色;至稀盐酸过量,溶液显酸性,溶液仍显无色,故溶液颜色的变化是红色-无色。
2.C [解析] NaOH是碱,H2SO4是酸,酸和碱作用生成盐和水的反应叫作中和反应。
3.C [解析] 消除蚁酸需涂抹碱性物质。氢氧化钠溶液碱性太强,且有强腐蚀性,不宜涂抹,可涂抹碱性较弱的稀氨水或肥皂水。
4.A
5.A [解析] 中和反应是酸和碱反应生成盐和水的过程。生石灰与水反应放热生成氢氧化钙,即CaO+H2OCa(OH)2,不是中和反应。
6.C
7.C [解析] 氢氧化钠溶液显碱性,可使酚酞溶液变红,当加入的盐酸与氢氧化钠恰好完全反应或盐酸过量时,溶液将变为无色。
8.C 9.D
10.D [解析] 由图甲可知,稀盐酸与氢氧化钠发生化学反应生成了氯化钠和水;图乙中稀盐酸与氯化钠溶液混合后,溶液中的离子没有发生变化,没有新物质生成;图甲中反应前盐酸显酸性,氢氧化钠溶液显碱性,混合后溶液显中性,溶液酸碱性发生了改变;图甲反应的实质是氢离子与氢氧根离子结合生成水分子,可表示酸碱反应的实质。
11.(1)Al(OH)3+3HClAlCl3+3H2O
(2)Ca(OH)2+H2SO4CaSO4+2H2O
(3)CaCO3+2HClCaCl2+H2O+CO2↑
(1)和(2)
[解析] 碳酸钙是盐,它与盐酸的反应不是中和反应。
12. (1)碱性
(2)2、5
(3)2NaOH+H2SO4Na2SO4+2H2O
[解析] (1)紫色石蕊遇碱性物质变蓝。(2)紫色石蕊遇酸性物质变红。(3)孔穴4中原来是氢氧化钠溶液,向其中滴加稀硫酸,发生中和反应,恰好完全反应时,溶液为紫色,反应的化学方程式为2NaOH+H2SO4Na2SO4+2H2O。
13.(1)①NaOH溶液与稀盐酸恰好完全反应
②氢离子和氢氧根离子结合生成水分子
(2)有气泡产生
(3)在稀盐酸量不足的情况下,也无明显现象
[解析] (2)当稀盐酸过量时,加入镁条能与之反应生成氢气,会观察到有气泡产生。(3)当稀盐酸的量不足时,加入镁条也没有明显的现象,所以该方案不能证明NaOH溶液与稀盐酸恰好完全反应。
14.(1)20 g
(2)解:设稀硫酸中溶质的质量分数为x。
H2SO4 + 2NaOHNa2SO4+2H2O
98 80
20 g×x 20 g×20%
= x=24.5%
答:稀硫酸中溶质的质量分数为24.5%。
同课章节目录
