人教版(五四制)九年级全一册化学 第二单元 课题2 溶解度(教案)
文档属性
| 名称 | 人教版(五四制)九年级全一册化学 第二单元 课题2 溶解度(教案) |

|
|
| 格式 | doc | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-22 18:04:23 | ||
图片预览



文档简介
教学设计方案
《溶解度》
(人教版九年级化学第九单元课题2“溶解度”第2课时)
一、教学思路分析
(一)教材分析
《溶解度》是人教版九年级化学第九单元课题2的内容,本课题包括饱和溶液和溶解度两部分知识。本节课主要从定量的角度让学生认识物质溶解性的强弱——溶解度。
在前面的学习中,学生已经接触了一些试剂,比如稀硫酸、盐酸等,它们都是溶液。本单元集中学习溶液知识,可以加深学生对所学知识的理解。下一单元将要学习酸、碱、盐等知识,有关他们之间的化学反应几乎都是在溶液中发生的,因此本单元的内容整个初三化学学习中起到承上启下的作用。
溶解度是溶液的基础知识,在学习过程中对于“易溶、微溶、难溶”等现象做出了比较明确的解释,这为过滤、结晶等内容的学习提供了理论依据。溶解度是一个从定量的角度定义物质溶解性强弱的物理量,所以这也为后面学习溶液中溶质的质量分数、有关化学方程式的计算作了铺垫。
图1 《溶解度》在教材中的地位
(二)内容分析
1、知识脉络
本节课主要以“夏天晒盐,冬天捞碱“为线索,从固体的溶解度这一概念出发,通过固体物质溶解度曲线的绘制、解读及其应用,归纳总结出常见的结晶方法。最后将所学知识应用到“夏天晒盐,冬天捞碱”这一生活原理的解释中,达到学以致用的目的,同时也体现化学源于生活,又为生活服务的宗旨。
在认识了固体溶解度概念的基础上,趁热打铁延伸出气体溶解度的概念,根据生活经验分析气体溶解度的影响因素,使知识循序渐进的呈现,为学生形成系统的知识网络打下基础。
图2 知识脉络
知识框架
回顾饱和溶液的形成及其影响因素,思考“如何定量的比较两种固体物质溶解能力的强弱?”,得出固体溶解度的概念,又利用溶解度的相对大小对“易溶、可溶、微溶、难溶”等概念进行界定,从而将“溶解性”与“溶解度”两个概念巧妙地联系在一起,给学生的认知过程留下一定的过渡空间。
溶解度分为固体溶解度和气体溶解度,对于固体溶解度概念的认识,固体溶解度曲线的分析及其利用固体溶解度曲线解释生活问题是本节课的学习重点。气体溶解度概念的形成及其影响因素也是学生需掌握的。
图3 《溶解度》知识框架图
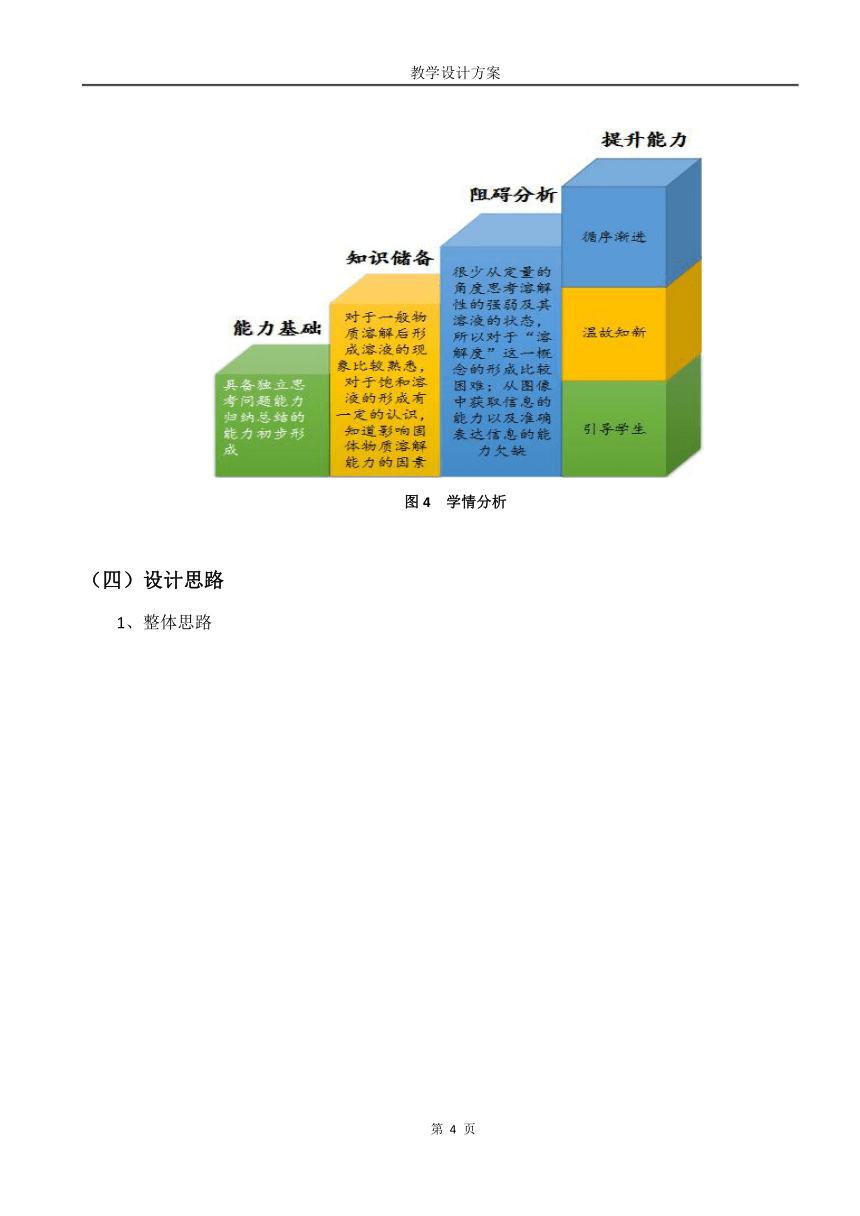
(三)学情分析
1、能力基础
通过一年的学习,学习者已经具备了一定的学习化学的思维,针对生活中的某种现象,学习者具有发现问题及独立思考问题的能力。但是对问题的解释往往局限于所学的零散知识,没有形成系统性的思维,此时老师应该引导学生对所学知识进行整合,进而归纳出新的知识。
2、知识储备
通过前面的学习,学习者对于一般物质溶解后形成溶液这一现象比较熟悉了,而且对于饱和溶液的形成有一定的认识,学习者已经知道温度和溶解的量对形成饱和溶液的影响,这些都为学习者从定量的角度认识溶解性的强弱埋下伏笔,
3、阻碍分析
学习者在之前的学习中,只是从定性角度的去认识固体物质溶解能力的强弱及其溶液的状态,很少从定量的角度思考溶解性的强弱及其溶液的状态,所以对于“溶解度”这一概念的形成需要将溶解性与溶解度建立联系,这对于初学者难度较大。
从溶解度的表示方法——溶解度曲线中获取有关信息是认识固体溶解度的方法,由于九年级的学生读图能力及其表达能力都欠佳,所以这对学习者深刻理解溶解度的含义产生了一定的障碍。
图4 学情分析
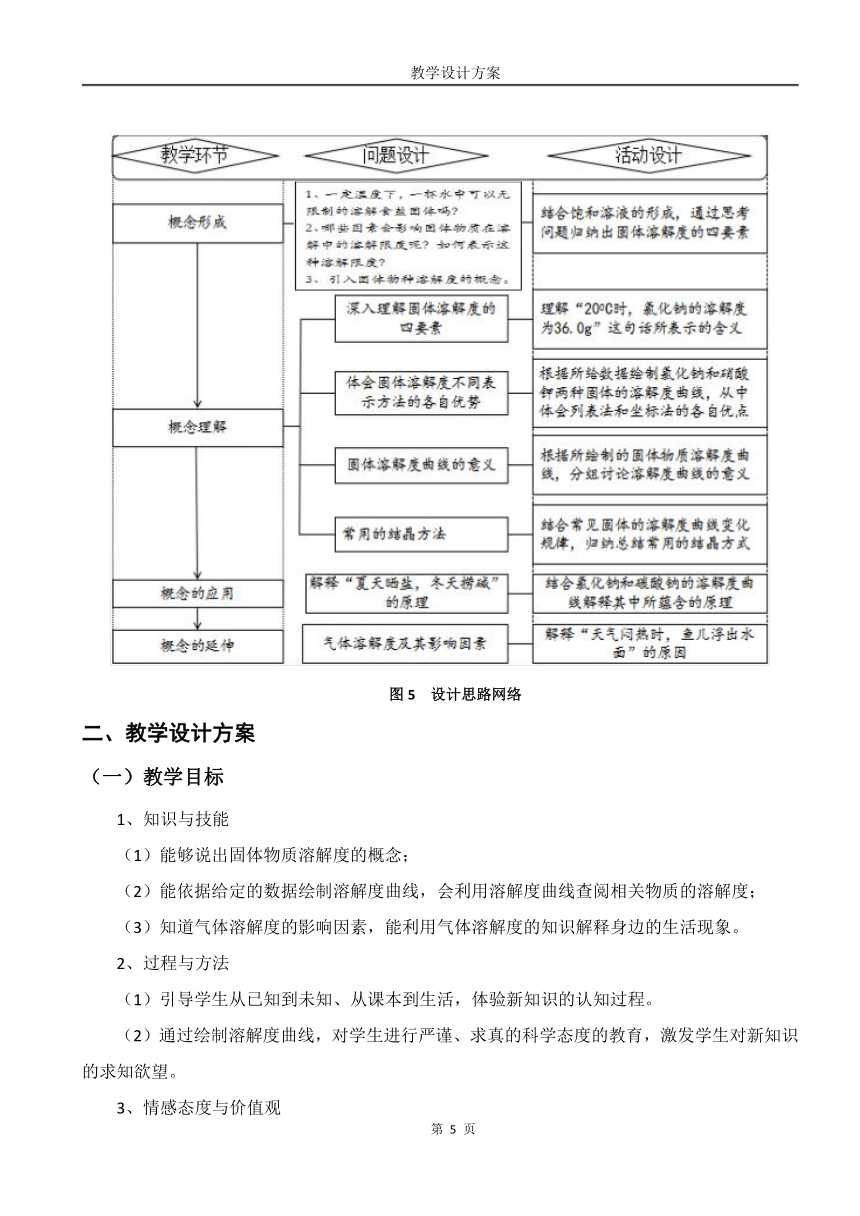
设计思路
整体思路
图5 设计思路网络
二、教学设计方案
(一)教学目标
1、知识与技能
(1)能够说出固体物质溶解度的概念;
(2)能依据给定的数据绘制溶解度曲线,会利用溶解度曲线查阅相关物质的溶解度;
(3)知道气体溶解度的影响因素,能利用气体溶解度的知识解释身边的生活现象。
2、过程与方法
(1)引导学生从已知到未知、从课本到生活,体验新知识的认知过程。
(2)通过绘制溶解度曲线,对学生进行严谨、求真的科学态度的教育,激发学生对新知识的求知欲望。
3、情感态度与价值观
(1)通过解释青海湖夏天晒盐,冬天捞碱的生活现象,体验我国劳动人民的聪明智慧,感受化学与生活的密切关系。
(二)教学重难点
1、教学重点
利用溶解度曲线获得相关信息;
2、教学难点
(1)固体物质溶解度的含义;
(2)利用溶解度曲线获取相关信息。
(三)教学方法
本节课采用小组讨论法、合作探究法、多媒体辅助教学法
(四)教学过程
教学环节 教师活动 学生活动 设计意图
创设情境导入新课预习检测建立概念固体溶解度的概念及其理解固体溶解度的表示溶解度曲线的意义固体溶解度曲线的变化规律气体溶解度概念及影响因素 【视屏展示】青海湖里含有丰富的食盐(NaCl)和纯碱(Na2CO3)资源,生活在湖区附近的人们习惯“夏天晒盐,冬天捞碱”。【提问】同学们是否知道生活在湖区附近的居民夏天晒盐,冬天捞碱的原理呢?【引入】让我们带着这个疑问走进今天的课堂——溶解度。【提出问题】一定温度下,一杯水中可以无限制的溶解食盐固体吗?【问题延伸】哪些因素影响固体物质在溶解中的溶解限度呢?我们改如何表示这种溶解限度?【过渡】化学上用溶解度来表示固体物质的这种溶解限度。 观看视频,疑问浮现思考问题回答:温度溶剂的种类溶质的种类溶剂的质量回答1:在200C时,36.0g氯化钠固体溶解在100g水中形成饱和溶液;回答2:在200C时,100g水中最多可溶解氯化钠固体36.0g; 齐答:18g回答:68g回答:根据200C时溶解度的相对大小,通常讲溶解度大于10g的定为易溶,溶解度大于1g小于10g的定为可溶,溶解度大于0.01g小于1g的定为微溶,溶解度小于0.01g的定为难溶或不溶回答1:读取数据快捷、直观回答2:没列出的数据无法确定,不能直观的观察到溶解度的变化绘图小组讨论合作学习小组1:KNO3固体的溶解度随温度的升高呈明显的上升趋势,氯化钠的溶解度随温度的升高变化不大。各小组进行讨论汇报讨论结果回答1:大多数固体物质的溶解度随温度的升高而升高;回答2:少数固体的溶解度随温度的升高变化不大;回答3:氢氧化钙的溶解度随温度的升高而降低;小组之间进行讨论、交流根据氯化钠和碳酸钠的溶解度曲线进行作答【现象】不打开时,没现象打开后,有大量气泡冒出回答1:说明气体的溶解度与温度有关,压强增大,气体溶解度增大。回答2:说明气体的溶解度还与温度有关,温度升高,气体溶解度减小。 从生活中的现象“夏天晒盐,冬天捞碱”出发,引发学生思考,体现化学与我们的生活息息相关的特点,培养学生在生活中学习化学的习惯,激发学生的求知欲。通过比较两种固体物质溶解能力的因素,指导学生总结固体溶解度的概念,培养学生归纳总结的能力。在理解概念的基础上,循序渐近的追问,使学生对固体溶解度有了更深层次的认识。在比较中发现列表法表示固体溶解度的有点与不足,引入坐标法表示固体溶解度的方法,通过学生亲自绘制固体物质的溶解度曲线,旨在培养学生动手,动脑的能力。通过小组讨论及其各小组汇报展示等形式的学习,在培养学生合作探究能力的同时,也激发了学生学习化学的信心。本着化学为生活服务的宗旨,让学生利用所学化学知识解决课前留给学生的疑问,达到学以致用的目的根据生活经验认识气体溶解度的影响因素,通过解决生活现象体现化学源于生活,又服务于生活的理念。
一、固体溶解度1、.概念:在一定温度下,某固体物质在100g溶剂中达到饱和状态时所溶解的质量。四要素:一定的温度 100g溶剂(通常为水) 达到饱和状态 单位:g【思考】1、“200C时,氯化钠固体的溶解度为36.0g”这句话所表达的含义是什么? 温度 溶剂的量 状 态 溶质的质量200C 100g 饱和 36.0g【评价】以上这两位同学根据固体物质溶解度的四要素深刻地理会了这句话的含义;请问此时溶液的质量为多少?【提问】在该温度下,50g水中最对可溶解氯化钠多少克?【追问】该温度下,如果将20g氯化钠溶解在50g水中,所得溶液的的质量为多少?【过渡】通过前面的学习,我们知道可以用溶解度来定量的表示溶解度的大小。在一定的温度下,固体物质溶解度的数值越大,其溶解性越强,所以, 溶解性的强弱可用溶解度来划分。现在,请同学们通过阅读教材“资料卡片”上的内容了解“易溶、可溶、微溶、难溶”等概念的理解。资料卡片 溶解度的相对大小(200C)【总结】由此可知,对于某种固体物质而言,没有绝对的不溶,只有溶解的相对多少。而且随着温度的改变,固体物质的溶解度也会随之改变。【引入】下表是通过实验所测得氯化钠和硝酸钾两种固体物质在不同温度下的溶解度,我们把这种表示固体物质溶解度与温度关系的方法叫做列表法。【提问】用列表法表示固体物质溶解度与温度的关系有什么优点呢?【追问】有什么不足呢?【过渡】为了能够弥补这些不足,我们可以将我们用坐标法来表示固体物质的溶解度与温度的关系,接下来请同学们将表中氯化钠和硝酸钾两种固体物质的溶解度与温度的关系在坐标轴中标示出来(坐标纸课前准备)。任务一:绘制溶解度曲线温馨提示:绘制时以温度为纵坐标,溶解度为横坐标。任务二:从绘制的溶解度曲线中,你能获取那些信息?(小组讨论)【展示】展示组内讨论结果,小组代表进行汇报。 拍照,小组代表汇报工作【总结】溶解度曲线所表示的意义:点:(1)曲线上的点:表示固体物质在该温度下的饱和溶液; (2)交点表示:该温度下两固体物质的溶解度相等。线:固体物质的物质的溶解度曲线随温度的变化而变化。面:(1)曲线下面表示该固体物的不饱和溶液; (2)曲线上面表示该固体物质的饱和溶液,且有不溶解的固体。【过渡】从同学们所绘制的溶解度曲线中,我们获取了很多有用的信息,请同学们根据教材中所给出的几种常见固体物质的溶解度曲线,你能发现固体物质的溶解度有什么变化规律吗? 【展示】几种常见固体物质的溶解度曲线任务三:固体物质溶解度的变化规律?(小组讨论)绝大多数固体物质的溶解度随温度的升高而升高,如KNO3,NaNO3等;少数固体的溶解度随温度的升高变化不大,如NaCl;【追问】是不是所有的固体物质的溶解度都呈现这样的规律呢?极少数固体物质的溶解度随温度的升高而降低,如Ca(OH)2;【提问】根据常见固体物质溶解度随温度的变化规律,请同学们思考从某固体物质的不饱和溶液中析出晶体的方法?(小组讨论)【总结】(1)对于绝大多数溶解度随温度升高而明显升高的固体物质而言,可采用降温结晶的方式析出晶体; (2)对于少数溶解度随温度升高变化不大的固体物质而言,可采用蒸发溶剂的方法结晶;所以,针对不同的固体物质,结晶时我们可以根据该固体的物质的溶解度随温度的变化规律选择合适的方式结晶。【疑云再现】为什么生活在青海湖区的人们“夏天晒盐,冬天捞碱”? 【评价】青海湖区的居民“夏天晒盐,冬天捞碱”的生活方式中,蕴含着如此丰富而有趣的化学知识,可见我国劳动人民的聪明才智是不言而喻的。【过渡】除了固体能溶解在水中外,生活中气体溶解在水中的现象也很多,例如鱼儿在水中生存,说明水中溶有氧气,那么气体的溶解度受哪些因素的影响呢?二、气体的溶解度【讨论】1.打开汽水(或含有二氧化碳气体的饮料)瓶盖时,汽水会自动喷出来。这说明气体在水中的溶解度与什么有关?2.2.烧开水时,水未开时就看到水中冒气泡,这些气泡是什么 这说明气体的溶解度还与什么有关?【总结】气体的溶解度受温度和压强的影响,温度越高,气体溶解度越小;压强越大,气体溶解度越大。 1、定义: 在压强为101KPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。2、影响因素:温度、压强【思考】天气闷热时,鱼儿为什么总是接近水面游动?
随堂练习课堂小结 【随堂练习】见导学案【总结】回顾今天这堂课, ( http: / / www.21cnjy.com )我最大的收获是什么? 学生回答总结收获 通过学生总结本节课的收获情况,使学生对所学知识系统化。
作业布置 完成导学案中的“学以致用”。
(五)板书设计
(六)教学反思
本节课我首先让学生结合上节课的知识思考“一定温度下,一杯水中可以无限制的溶解食盐固体吗?”这一问题,进而延生至影响固体物质在溶剂中的溶解限量问题,引入溶解度这一概念。从学生的反应来看,对”溶解度“这一概念的理解比较深刻。根据硝酸钾和氯化钠两种固体物质在不同温度下所对应的溶解度大小,使学生认识到固体的溶解度随温度的变化。利用实验数据,让学生动手绘制固体物质的溶解度曲线,通过小组讨论的方式从溶解度曲线中获取信息,不仅可以帮助学生理解溶解度曲线,还能够使学生很快地接受所学知识。
本节课以“溶解度的含义”为中心目标, 以解释“夏天晒盐,冬天捞碱”的原理为主线,围绕固体物质溶解度曲线,进行了合作探究的学习方式,充分理解了固体溶解度的含义。利用生活中的汽水、烧开水等素材,让学生更能充分理解了气体溶解度受温度和压强的影响。
《溶解度》
(人教版九年级化学第九单元课题2“溶解度”第2课时)
一、教学思路分析
(一)教材分析
《溶解度》是人教版九年级化学第九单元课题2的内容,本课题包括饱和溶液和溶解度两部分知识。本节课主要从定量的角度让学生认识物质溶解性的强弱——溶解度。
在前面的学习中,学生已经接触了一些试剂,比如稀硫酸、盐酸等,它们都是溶液。本单元集中学习溶液知识,可以加深学生对所学知识的理解。下一单元将要学习酸、碱、盐等知识,有关他们之间的化学反应几乎都是在溶液中发生的,因此本单元的内容整个初三化学学习中起到承上启下的作用。
溶解度是溶液的基础知识,在学习过程中对于“易溶、微溶、难溶”等现象做出了比较明确的解释,这为过滤、结晶等内容的学习提供了理论依据。溶解度是一个从定量的角度定义物质溶解性强弱的物理量,所以这也为后面学习溶液中溶质的质量分数、有关化学方程式的计算作了铺垫。
图1 《溶解度》在教材中的地位
(二)内容分析
1、知识脉络
本节课主要以“夏天晒盐,冬天捞碱“为线索,从固体的溶解度这一概念出发,通过固体物质溶解度曲线的绘制、解读及其应用,归纳总结出常见的结晶方法。最后将所学知识应用到“夏天晒盐,冬天捞碱”这一生活原理的解释中,达到学以致用的目的,同时也体现化学源于生活,又为生活服务的宗旨。
在认识了固体溶解度概念的基础上,趁热打铁延伸出气体溶解度的概念,根据生活经验分析气体溶解度的影响因素,使知识循序渐进的呈现,为学生形成系统的知识网络打下基础。
图2 知识脉络
知识框架
回顾饱和溶液的形成及其影响因素,思考“如何定量的比较两种固体物质溶解能力的强弱?”,得出固体溶解度的概念,又利用溶解度的相对大小对“易溶、可溶、微溶、难溶”等概念进行界定,从而将“溶解性”与“溶解度”两个概念巧妙地联系在一起,给学生的认知过程留下一定的过渡空间。
溶解度分为固体溶解度和气体溶解度,对于固体溶解度概念的认识,固体溶解度曲线的分析及其利用固体溶解度曲线解释生活问题是本节课的学习重点。气体溶解度概念的形成及其影响因素也是学生需掌握的。
图3 《溶解度》知识框架图
(三)学情分析
1、能力基础
通过一年的学习,学习者已经具备了一定的学习化学的思维,针对生活中的某种现象,学习者具有发现问题及独立思考问题的能力。但是对问题的解释往往局限于所学的零散知识,没有形成系统性的思维,此时老师应该引导学生对所学知识进行整合,进而归纳出新的知识。
2、知识储备
通过前面的学习,学习者对于一般物质溶解后形成溶液这一现象比较熟悉了,而且对于饱和溶液的形成有一定的认识,学习者已经知道温度和溶解的量对形成饱和溶液的影响,这些都为学习者从定量的角度认识溶解性的强弱埋下伏笔,
3、阻碍分析
学习者在之前的学习中,只是从定性角度的去认识固体物质溶解能力的强弱及其溶液的状态,很少从定量的角度思考溶解性的强弱及其溶液的状态,所以对于“溶解度”这一概念的形成需要将溶解性与溶解度建立联系,这对于初学者难度较大。
从溶解度的表示方法——溶解度曲线中获取有关信息是认识固体溶解度的方法,由于九年级的学生读图能力及其表达能力都欠佳,所以这对学习者深刻理解溶解度的含义产生了一定的障碍。
图4 学情分析
设计思路
整体思路
图5 设计思路网络
二、教学设计方案
(一)教学目标
1、知识与技能
(1)能够说出固体物质溶解度的概念;
(2)能依据给定的数据绘制溶解度曲线,会利用溶解度曲线查阅相关物质的溶解度;
(3)知道气体溶解度的影响因素,能利用气体溶解度的知识解释身边的生活现象。
2、过程与方法
(1)引导学生从已知到未知、从课本到生活,体验新知识的认知过程。
(2)通过绘制溶解度曲线,对学生进行严谨、求真的科学态度的教育,激发学生对新知识的求知欲望。
3、情感态度与价值观
(1)通过解释青海湖夏天晒盐,冬天捞碱的生活现象,体验我国劳动人民的聪明智慧,感受化学与生活的密切关系。
(二)教学重难点
1、教学重点
利用溶解度曲线获得相关信息;
2、教学难点
(1)固体物质溶解度的含义;
(2)利用溶解度曲线获取相关信息。
(三)教学方法
本节课采用小组讨论法、合作探究法、多媒体辅助教学法
(四)教学过程
教学环节 教师活动 学生活动 设计意图
创设情境导入新课预习检测建立概念固体溶解度的概念及其理解固体溶解度的表示溶解度曲线的意义固体溶解度曲线的变化规律气体溶解度概念及影响因素 【视屏展示】青海湖里含有丰富的食盐(NaCl)和纯碱(Na2CO3)资源,生活在湖区附近的人们习惯“夏天晒盐,冬天捞碱”。【提问】同学们是否知道生活在湖区附近的居民夏天晒盐,冬天捞碱的原理呢?【引入】让我们带着这个疑问走进今天的课堂——溶解度。【提出问题】一定温度下,一杯水中可以无限制的溶解食盐固体吗?【问题延伸】哪些因素影响固体物质在溶解中的溶解限度呢?我们改如何表示这种溶解限度?【过渡】化学上用溶解度来表示固体物质的这种溶解限度。 观看视频,疑问浮现思考问题回答:温度溶剂的种类溶质的种类溶剂的质量回答1:在200C时,36.0g氯化钠固体溶解在100g水中形成饱和溶液;回答2:在200C时,100g水中最多可溶解氯化钠固体36.0g; 齐答:18g回答:68g回答:根据200C时溶解度的相对大小,通常讲溶解度大于10g的定为易溶,溶解度大于1g小于10g的定为可溶,溶解度大于0.01g小于1g的定为微溶,溶解度小于0.01g的定为难溶或不溶回答1:读取数据快捷、直观回答2:没列出的数据无法确定,不能直观的观察到溶解度的变化绘图小组讨论合作学习小组1:KNO3固体的溶解度随温度的升高呈明显的上升趋势,氯化钠的溶解度随温度的升高变化不大。各小组进行讨论汇报讨论结果回答1:大多数固体物质的溶解度随温度的升高而升高;回答2:少数固体的溶解度随温度的升高变化不大;回答3:氢氧化钙的溶解度随温度的升高而降低;小组之间进行讨论、交流根据氯化钠和碳酸钠的溶解度曲线进行作答【现象】不打开时,没现象打开后,有大量气泡冒出回答1:说明气体的溶解度与温度有关,压强增大,气体溶解度增大。回答2:说明气体的溶解度还与温度有关,温度升高,气体溶解度减小。 从生活中的现象“夏天晒盐,冬天捞碱”出发,引发学生思考,体现化学与我们的生活息息相关的特点,培养学生在生活中学习化学的习惯,激发学生的求知欲。通过比较两种固体物质溶解能力的因素,指导学生总结固体溶解度的概念,培养学生归纳总结的能力。在理解概念的基础上,循序渐近的追问,使学生对固体溶解度有了更深层次的认识。在比较中发现列表法表示固体溶解度的有点与不足,引入坐标法表示固体溶解度的方法,通过学生亲自绘制固体物质的溶解度曲线,旨在培养学生动手,动脑的能力。通过小组讨论及其各小组汇报展示等形式的学习,在培养学生合作探究能力的同时,也激发了学生学习化学的信心。本着化学为生活服务的宗旨,让学生利用所学化学知识解决课前留给学生的疑问,达到学以致用的目的根据生活经验认识气体溶解度的影响因素,通过解决生活现象体现化学源于生活,又服务于生活的理念。
一、固体溶解度1、.概念:在一定温度下,某固体物质在100g溶剂中达到饱和状态时所溶解的质量。四要素:一定的温度 100g溶剂(通常为水) 达到饱和状态 单位:g【思考】1、“200C时,氯化钠固体的溶解度为36.0g”这句话所表达的含义是什么? 温度 溶剂的量 状 态 溶质的质量200C 100g 饱和 36.0g【评价】以上这两位同学根据固体物质溶解度的四要素深刻地理会了这句话的含义;请问此时溶液的质量为多少?【提问】在该温度下,50g水中最对可溶解氯化钠多少克?【追问】该温度下,如果将20g氯化钠溶解在50g水中,所得溶液的的质量为多少?【过渡】通过前面的学习,我们知道可以用溶解度来定量的表示溶解度的大小。在一定的温度下,固体物质溶解度的数值越大,其溶解性越强,所以, 溶解性的强弱可用溶解度来划分。现在,请同学们通过阅读教材“资料卡片”上的内容了解“易溶、可溶、微溶、难溶”等概念的理解。资料卡片 溶解度的相对大小(200C)【总结】由此可知,对于某种固体物质而言,没有绝对的不溶,只有溶解的相对多少。而且随着温度的改变,固体物质的溶解度也会随之改变。【引入】下表是通过实验所测得氯化钠和硝酸钾两种固体物质在不同温度下的溶解度,我们把这种表示固体物质溶解度与温度关系的方法叫做列表法。【提问】用列表法表示固体物质溶解度与温度的关系有什么优点呢?【追问】有什么不足呢?【过渡】为了能够弥补这些不足,我们可以将我们用坐标法来表示固体物质的溶解度与温度的关系,接下来请同学们将表中氯化钠和硝酸钾两种固体物质的溶解度与温度的关系在坐标轴中标示出来(坐标纸课前准备)。任务一:绘制溶解度曲线温馨提示:绘制时以温度为纵坐标,溶解度为横坐标。任务二:从绘制的溶解度曲线中,你能获取那些信息?(小组讨论)【展示】展示组内讨论结果,小组代表进行汇报。 拍照,小组代表汇报工作【总结】溶解度曲线所表示的意义:点:(1)曲线上的点:表示固体物质在该温度下的饱和溶液; (2)交点表示:该温度下两固体物质的溶解度相等。线:固体物质的物质的溶解度曲线随温度的变化而变化。面:(1)曲线下面表示该固体物的不饱和溶液; (2)曲线上面表示该固体物质的饱和溶液,且有不溶解的固体。【过渡】从同学们所绘制的溶解度曲线中,我们获取了很多有用的信息,请同学们根据教材中所给出的几种常见固体物质的溶解度曲线,你能发现固体物质的溶解度有什么变化规律吗? 【展示】几种常见固体物质的溶解度曲线任务三:固体物质溶解度的变化规律?(小组讨论)绝大多数固体物质的溶解度随温度的升高而升高,如KNO3,NaNO3等;少数固体的溶解度随温度的升高变化不大,如NaCl;【追问】是不是所有的固体物质的溶解度都呈现这样的规律呢?极少数固体物质的溶解度随温度的升高而降低,如Ca(OH)2;【提问】根据常见固体物质溶解度随温度的变化规律,请同学们思考从某固体物质的不饱和溶液中析出晶体的方法?(小组讨论)【总结】(1)对于绝大多数溶解度随温度升高而明显升高的固体物质而言,可采用降温结晶的方式析出晶体; (2)对于少数溶解度随温度升高变化不大的固体物质而言,可采用蒸发溶剂的方法结晶;所以,针对不同的固体物质,结晶时我们可以根据该固体的物质的溶解度随温度的变化规律选择合适的方式结晶。【疑云再现】为什么生活在青海湖区的人们“夏天晒盐,冬天捞碱”? 【评价】青海湖区的居民“夏天晒盐,冬天捞碱”的生活方式中,蕴含着如此丰富而有趣的化学知识,可见我国劳动人民的聪明才智是不言而喻的。【过渡】除了固体能溶解在水中外,生活中气体溶解在水中的现象也很多,例如鱼儿在水中生存,说明水中溶有氧气,那么气体的溶解度受哪些因素的影响呢?二、气体的溶解度【讨论】1.打开汽水(或含有二氧化碳气体的饮料)瓶盖时,汽水会自动喷出来。这说明气体在水中的溶解度与什么有关?2.2.烧开水时,水未开时就看到水中冒气泡,这些气泡是什么 这说明气体的溶解度还与什么有关?【总结】气体的溶解度受温度和压强的影响,温度越高,气体溶解度越小;压强越大,气体溶解度越大。 1、定义: 在压强为101KPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。2、影响因素:温度、压强【思考】天气闷热时,鱼儿为什么总是接近水面游动?
随堂练习课堂小结 【随堂练习】见导学案【总结】回顾今天这堂课, ( http: / / www.21cnjy.com )我最大的收获是什么? 学生回答总结收获 通过学生总结本节课的收获情况,使学生对所学知识系统化。
作业布置 完成导学案中的“学以致用”。
(五)板书设计
(六)教学反思
本节课我首先让学生结合上节课的知识思考“一定温度下,一杯水中可以无限制的溶解食盐固体吗?”这一问题,进而延生至影响固体物质在溶剂中的溶解限量问题,引入溶解度这一概念。从学生的反应来看,对”溶解度“这一概念的理解比较深刻。根据硝酸钾和氯化钠两种固体物质在不同温度下所对应的溶解度大小,使学生认识到固体的溶解度随温度的变化。利用实验数据,让学生动手绘制固体物质的溶解度曲线,通过小组讨论的方式从溶解度曲线中获取信息,不仅可以帮助学生理解溶解度曲线,还能够使学生很快地接受所学知识。
本节课以“溶解度的含义”为中心目标, 以解释“夏天晒盐,冬天捞碱”的原理为主线,围绕固体物质溶解度曲线,进行了合作探究的学习方式,充分理解了固体溶解度的含义。利用生活中的汽水、烧开水等素材,让学生更能充分理解了气体溶解度受温度和压强的影响。
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
