氯气教案
图片预览



文档简介
氯气·教案
第一课时
教学目标
知识技能:初步掌握氯气的化学性质,并从氯的原子结构特点和氯气跟金属、非金属化合物的反应了解氯气是一种化学性质非常活泼的非金属。
能力培养:观察能力及抽象概括、形成规律性认识和总结归纳的能力。
科学思想:培养对化学现象与化学本质的辩证认识,以及热爱科学,尊重科学的思想。
科学品质:激发学习兴趣,培养主动意识、严谨求实的科学态度和努力探索的优良品质。
科学方法:观察、记录、科学抽象,通过实验来研究物质及其变化的科学方法。
重点、难点 氯气的化学性质。培养通过现象,挖掘本质的科学研究能力。
教学过程设计
教师活动 学生活动 设计意图
【引入】(1)在初中化学里我们学过氟原子和氯原子的原子结构示意图,请画出。(2)看投影,观察溴、碘、砹三种元素的原子结构示意图,它们与氟、氯有何相似的结构?【投影】氟、氯、溴、碘由于具有相似的结构,因而具有相似的化学性质,成为一族,称为卤族元素,简称卤素。“卤”在希腊文中是“成盐”的意思。在这一章里,重点学习氯的单质——氯气及由氯形成的化合物,并在认识氯的基础上,学习卤素。【板书】第一节氯气 回忆,画出原子结构示意图:看投影思考,回答:最外层电子数都是7。体会是由于结构相似决定的性质相似的理论。 复习初中知识,为新课引入打下基础。 使学生开始接触“结构决定性质”的化学思想。
【板书】一、氯气的性质【展示】出示一瓶氯气,瓶后衬一张白纸。(1)请学生观察并描述其颜色和状态。(2)请一名学生上来闻氯气的气味,并强调闻味的方法。 观察,描述:氯气是黄绿色气体。 闻味,描述:刺鼻的气味。 培养学生观察能力。使学生学会闻味的方法。
续表
教师活动 学生活动 设计意图
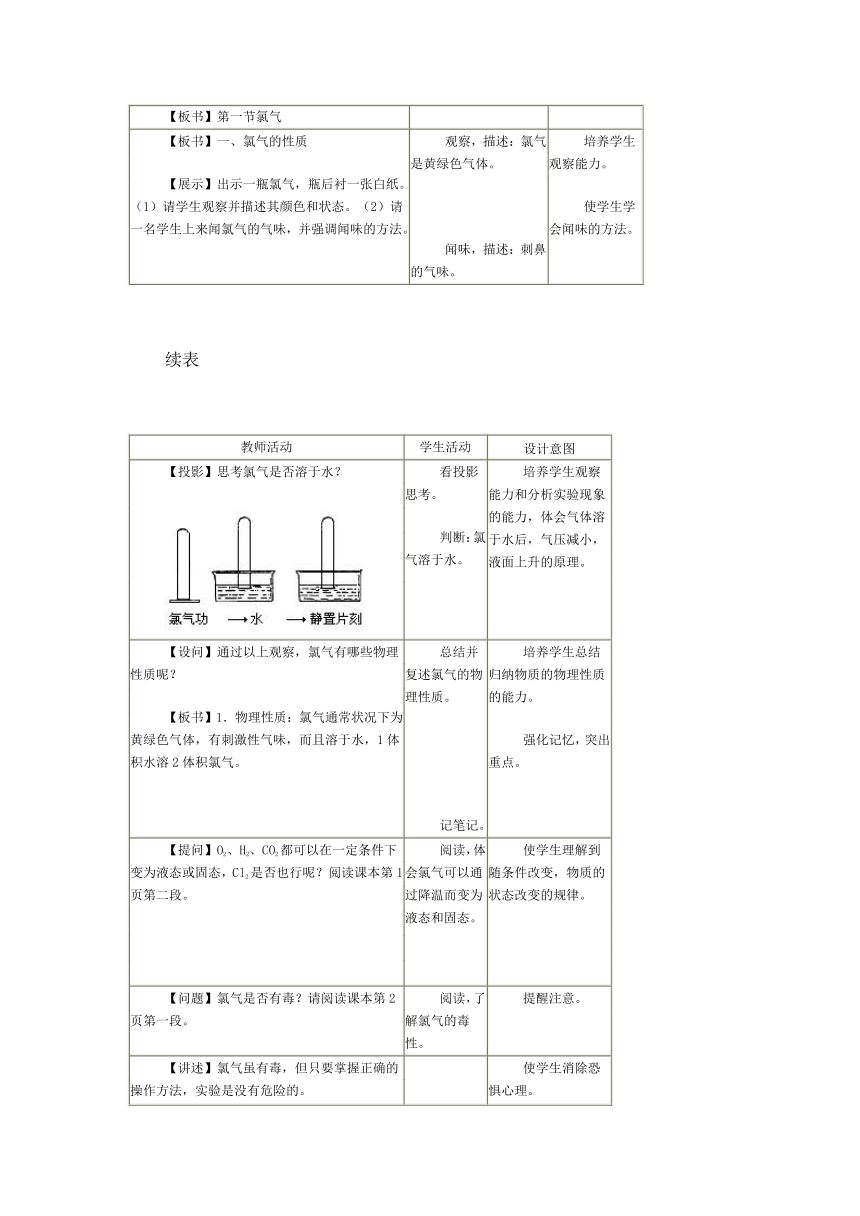
【投影】思考氯气是否溶于水? 看投影思考。判断:氯气溶于水。 培养学生观察能力和分析实验现象的能力,体会气体溶于水后,气压减小,液面上升的原理。
【设问】通过以上观察,氯气有哪些物理性质呢?【板书】1.物理性质:氯气通常状况下为黄绿色气体,有刺激性气味,而且溶于水,1体积水溶2体积氯气。 总结并复述氯气的物理性质。 记笔记。 培养学生总结归纳物质的物理性质的能力。强化记忆,突出重点。
【提问】O2、H2、CO2都可以在一定条件下变为液态或固态,Cl2是否也行呢?阅读课本第1页第二段。 阅读,体会氯气可以通过降温而变为液态和固态。 使学生理解到随条件改变,物质的状态改变的规律。
【问题】氯气是否有毒?请阅读课本第2页第一段。 阅读,了解氯气的毒性。 提醒注意。
【讲述】氯气虽有毒,但只要掌握正确的操作方法,实验是没有危险的。 使学生消除恐惧心理。
【板书】2.氯气的化学性质【设问】初中学过Cl2和什么物质反应?写出化学方程式及实验现象。 回忆。 书写。 复习有关旧知识。
【投影】(生成白色固体) 对照修改。 强化记忆,突出重点。
【思考】氯气除了和金属钠反应,是否还会和其它金属反应呢? 思考,设想,寻求证明。 设疑,激发求知欲望。
续表
教师活动 学生活动 设计意图
【演示】将两根细铁丝用砂纸打亮,螺旋绕于火柴棍上,用镊子夹住,在酒精灯上引燃火柴,稍停,待火柴将燃尽,置于盛有氯气的集气瓶中,观察现象。反应完毕,用洗瓶注少量水于集气瓶中,观察溶液颜色。(用实物投影仪将现象投影在大屏幕上) 观察:描述:棕色烟→棕黄色溶液 培养学生的观察和表述能力。
【复习】烟和气体的区别 回忆、思考,回答:烟是固体小颗粒组成。 理解烟和气的本质区别。
【结论】铁在氯气中燃烧生成氯化铁。请写出化学方程式及实验现象。 总结,书写化学方程式。 培养学生归纳总结能力。
【投影】(燃烧,棕色烟,棕黄色溶液) 对照修改。 强化记忆,突出重点。
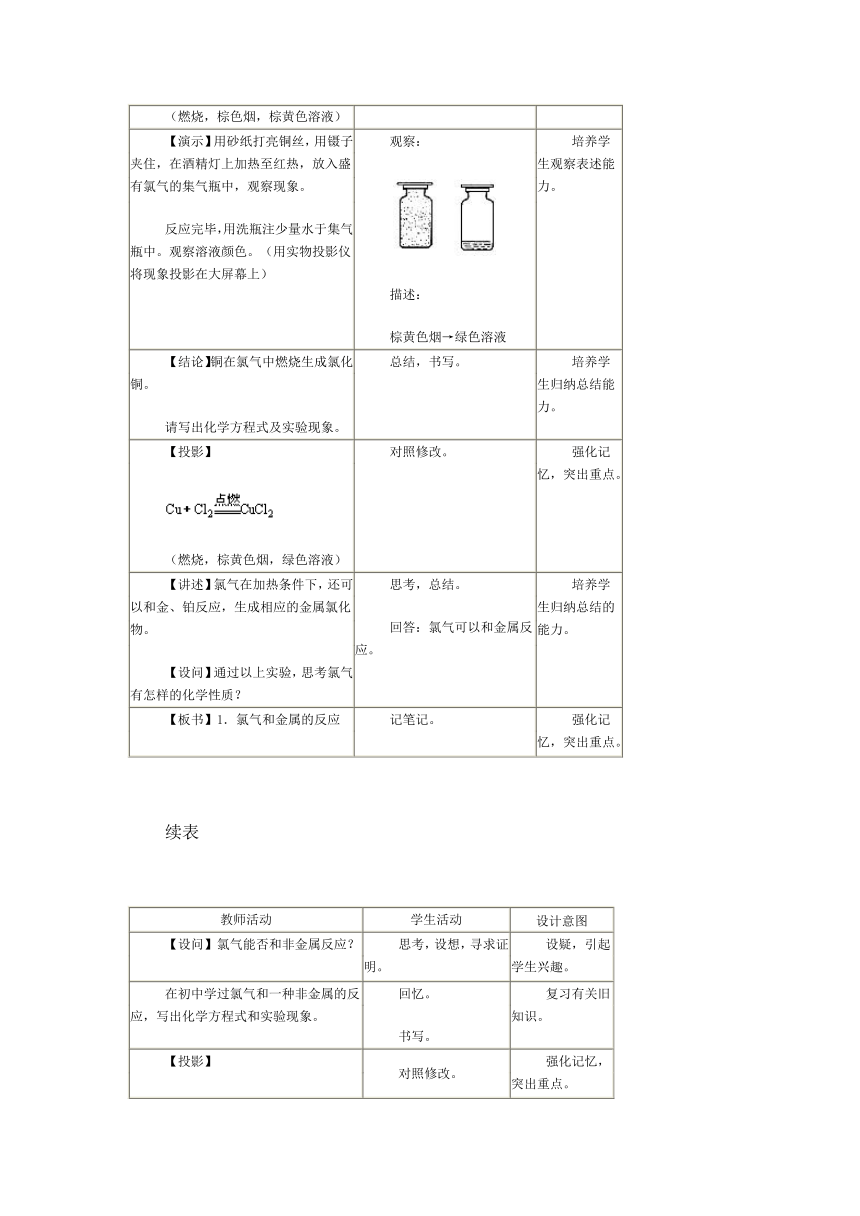
【演示】用砂纸打亮铜丝,用镊子夹住,在酒精灯上加热至红热,放入盛有氯气的集气瓶中,观察现象。反应完毕,用洗瓶注少量水于集气瓶中。观察溶液颜色。(用实物投影仪将现象投影在大屏幕上) 观察:描述:棕黄色烟→绿色溶液 培养学生观察表述能力。
【结论】铜在氯气中燃烧生成氯化铜。请写出化学方程式及实验现象。 总结,书写。 培养学生归纳总结能力。
【投影】(燃烧,棕黄色烟,绿色溶液) 对照修改。 强化记忆,突出重点。
【讲述】氯气在加热条件下,还可以和金、铂反应,生成相应的金属氯化物。【设问】通过以上实验,思考氯气有怎样的化学性质? 思考,总结。回答:氯气可以和金属反应。 培养学生归纳总结的能力。
【板书】1.氯气和金属的反应 记笔记。 强化记忆,突出重点。
续表
教师活动 学生活动 设计意图
【设问】氯气能否和非金属反应? 思考,设想,寻求证明。 设疑,引起学生兴趣。
在初中学过氯气和一种非金属的反应,写出化学方程式和实验现象。 回忆。书写。 复习有关旧知识。
【投影】(安静燃烧,苍白色火焰,瓶口有白雾产生,有刺激性气味气体生成。) 对照修改。 强化记忆,突出重点。
【演示】向学生交代事先准备的放在试管架上的试管中盛有氯酸钾和镁粉,滴入浓盐酸将会产生氢气和氯气。然后打开塞子,用弯头滴管吸取少量37%的浓盐酸(最好是新开瓶的分析纯盐酸),以每秒钟1滴的速度滴入试管中。当试管内产生黄绿色气体时,慢一些滴加盐酸。大约一分钟后会产生强烈爆鸣声。(资料见附2) 观察:描述:有强烈爆鸣声。 培养学生观察和表述的能力。
【结论】氢气与氯气混合,见强光爆炸。请写出化学方程式及实验现象。 总结,书写。 培养学生总结归纳能力。
【投影】 (爆炸,瓶口有白雾) 对照修改。 强化记忆,突出重点。
【设问】氯气除了和氢气反应外,是否还和其它非金属单质反应呢? 思考,设想,寻求证明。 设疑,激发求知欲望。
【演示】将少量红磷放在燃烧匙中,在酒精灯上加热至燃烧后,放入盛有氯气的集气瓶中。指导学生观察瓶壁上及瓶内现象。 观察并描述现象:红磷在氯气中燃烧,瓶壁上有无色液滴,瓶内有大量白色烟雾产生。 培养学生观察和描述现象的能力。
【复习】烟和雾的区别。 回忆并回答:烟是固体小颗粒组成,雾是液体小液滴组成的。 辨析概念。
续表
教师活动 学生活动 设计意图
【结论】红磷在氯气中燃烧产生三氯化磷液体和五氯化磷固体。请写出化学方程式及实验现象。 总结,书写。 培养学生归纳总结能力。
【投影】(燃烧,白色烟雾) 对照修改。 强化记忆,突出重点。
【设问】通过以上实验,思考氯气有怎样的化学性质? 回答:氯气可以和非金属反应。 培养学生科学的抽象归纳的能力。
【板书】2.氯气和非金属的反应。 记笔记。 强化记忆,突出重点。
【提问】燃烧的定义是什么? 回忆,回答:物质跟氧气发生的发光发热的剧烈的化学反应。 复习有关旧知识。
【讨论】(1)可燃物是否一定有氧气才能燃烧呢?(2)请重新给燃烧下定义。 讨论,回答:(1)燃烧不一定有氧气。(2)发光放热的剧烈的化学反应叫做燃烧。 培养学生科学的抽象归纳的能力。
【板书】燃烧:发光放热的剧烈的化学反应。 记笔记。 强化记忆,突出重点。
【问题讨论】(1)为何氯气的化学性质活泼呢?看投影,分析氯元素在这些化学反应中化合价是如何变化的,有怎样的规律?(2)为何有这样的规律,试从氯元素的微观结构上找原因。【投影】 思考,讨论。回答:(1)氯元素在这些化学反应中化合价都是由0价变为-1价。(2)氯原子最外层有7个电子,容易得一个电子而达到8个电子的稳定结构, 使学生初步形成结构决定性质的理论,并学会用这个理论来解释现象。
续表
教师活动 学生活动 设计意图
从而由0价变为-1价。由于氯原子有这样的微观结构,决定了它的化学性质非常活泼。
【小结】氯气是一种化学性质非常活泼的气体,一定条件下,能与金属、非金属反应。 记笔记。 强化记忆,突出重点。
【作业】课本第9页习题2(1)(3)、5。 巩固知识。
【随堂检测】1.在下列各组物质的反应过程中:(A)氢气与氯气混合,见光。(B)铁丝在氯气中燃烧。(C)铜丝在氯气中燃烧。(D)金属钠在氯气中燃烧。(E)红磷在氯气中燃烧。(1)能生成白色烟的是( );(2)能生成棕黄色烟的是( ),溶于水得______色溶液;(3)能生成白色烟雾的是( );(4)能爆炸的是( );(5)能生成棕色烟的是( ),溶于水得______色溶液。请写出各反应的化学方程式。2.下列微粒化学性质最活泼的是( )。(A)氢原于(B)氯离子(C)钠离子(D)氩原子 1.考察学生对重点实验的现象和化学方程式的掌握情况。2.检查学生是否会用微粒结构分析判断化学性质。
附2:备注 事先用天平称取新镁粉和氯酸钾晶体各0.2g,把镁粉平均分为五份,取一份装在洁净而干燥的试管(15×150mm)中然后在装入的镁粉上铺一层氯酸钾晶体(约40mg),放在试管架上,塞好橡皮塞,保存备用。另外课前需将微型杯放在集气瓶中加氯酸钾和浓盐酸制好六瓶氯气。
第二课时
教学目标
知识技能:认识氯气能溶于水,掌握氯气跟水的反应;了解氯水可用来漂白杀菌及氯水的不稳定性;掌握氯气跟碱的反应及漂白粉的制法和漂白原理;从中进一步认识氯气是一种活泼的非金属。
能力培养:通过学生自己动手实验(氯气跟水的反应,氯水的漂白、氯气跟碱的反应)培养学生对比、观察和表达的能力;并从上述实验事实中体会到氯气跟水反应因条件的改变而出现反应程度的差异;并从中培养学生抽象概括的能力。
思想情感:结合学生实验,培养学生认真仔细、严谨求实的科学态度;通过氯气跟水反应因条件的改变而出现反应程度的差异,培养学生探究精神。
科学方法:观察、记录、科学抽象,通过实验来研究物质及其变化的科学方法。
重点、难点 氯气跟水的反应;对比观察实验的能力;抽象概括出氯气跟水反应因条件的改变而出现反应程度的差异。
教学过程设计
教师活动 学生活动 设计意图
【复习引入】上节课学习了氯气的哪些重要化学性质?这节课我们继续学习氯气的另两种重要的化学性质。 回忆、学生回答。 复习,引导学生进入新课情境。
【指导实验】向一支充满氯气的大试管中加入2~3mL水后,迅速塞紧塞子,充分振荡,将上述试管和另一支充满氯气的大试管以及另外一支装有4~5mL蒸馏水的试管放在一起。对比观察:加入水后的试管中溶液颜色有什么变化?试管上部空间气体颜色有什么变化?【设问】上述变化说明什么?氯水的气味,是哪种物质的气味?你曾经闻到过吗?【板书】①氯气能溶于水,但溶解度不大。②氯水呈现黄绿色,说明氯水中有游离的氯。 完成实验一。观察现象:思考后表述:①溶液有点发黄;②上部空间气体颜色变浅。上述变化说明氯气能溶在水中,但溶的不多。闻氯水的气味。回答:好像游泳池中的气味。 ①培养学生对比、观察及表达能力。②培养学生认真仔细的科学态度。③鼓励学生积极思考。④理论联系实际。
【指导实验】分别用两只玻璃棒蘸取稀盐酸和氯水,分别滴在两条蓝色石蕊试纸上。观察两条试纸的颜色变化并比较两者有什么不同?【解疑】氯气与水反应有酸生成【设问】新制氯水的成分是什么?【点拨】新制的氯水中大约有40%的氯和水反应。【板书】氯水是混合物 完成实验二:观察现象并回答:滴有盐酸的试纸变红,而滴有氯水的试纸中间变白,外圈变红。概括:新制氯水的成分:H2O、Cl2、HClO、H+、Cl-。 ①培养学生对比、观察及表达能力。②培养学生综合的能力。③为突破难点作准备。
续表
教师活动 学生活动 设计意图
【设疑】当我们改变上述反应条件时,上述反应进行的程度会不会发生变化呢? 思考。 突出本节课的难点。为突破难点而设疑。
【启发】观察滴有氯水的蓝色石蕊试纸中间变白,说明氯水中有能够使有色物质褪色的物质生成。我们已知道H2O和盐酸没有漂白的作用,要么氯气有漂白作用,要么HClO有漂白作用,或两者都有。请自己设计一个实验(用所给仪器和试剂)证明到底是哪种物质有漂白作用?【设疑】仔细观察两支试管内上部空间的气体颜色有什么不同?装有氯水的试管内上部空间的气体颜色为什么会变浅?【概括解疑】①次氯酸有强氧化性,因此氯水可用来漂白、杀菌。②当氯水遇到被漂白的物质时,消耗了次氯酸,使没有和H2O反应的Cl2又继续和水反应,也使没有溶在水中的Cl2又继续溶在水中,这样循环往复,只要加入的被漂白的物质的量足够,最终上部空间气体的颜色会消失。即当氯水遇到被漂白的物质时,使氯气与水的反应趋于完全。 讨论、并完成该实验。找2~3个小组汇报实验结果。方法:取2条蓝色石蕊试纸分别放入装有氯气的大试管和装有氯水的大试管中。 结果:前者不褪色而后者褪色。 概括:次氯酸具有漂白作用,而氯气没有漂白作用。 ①教给学生如何分析问题、初步解决问题的基本思路和方法。②激励学生勇于探究。③引导学生如何观察,从而为突破难点,打下感性认识的基础。④培养学生抽象概括的能力以及逻辑推理的能力。⑤与设疑前后呼应,从而突出重点和难点。
【演示】氯水见光分解【设问】氯水中什么物质可以分解放出氧气?为什么?【点拨】实验证明氯水见光后可以产生气体——这个气体是氧气。【设疑】当氯水放在强光下长时间放置时,氯水的颜色有什么变化?组成上有什么变化?为什么? 思考概括:氯水中只有H2O和HClO中含有氧元素,而H2O见光不能分解,所以只能是HClO见光分解放出氧气。抽象概括:由于次氯酸的见光分解,消耗了HClO,使得氯气与水的反应趋于完全。所以氯水的颜色会慢慢变浅,盐酸的成分会越来越多。 ①培养学生逻辑推理的能力。②与上述的设疑前后呼应,从而突破难点。③培养表达能力、概括能力。
续表
教师活动 学生活动 设计意图
【指导实验】向学生实验一中加入水后的试管中加入1粒固体NaOH,充分振荡。将三支试管放在一起对比观察:溶液颜色有什么变化?上部空间的气体颜色有什么变化?为什么?【投影】Cl2+2NaOH=NaCl+NaClO+H2O【点拨】氯气与氢氧化钙反应即工业制漂白粉的原理。2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 完成实验三。讨论后,抽象概括:①NaOH与氯水中的盐酸和次氯酸反应生成盐,消耗了氯水中的次氯酸,使得Cl2与H2O的反应趋于完全。②NaOH的量足够,即可使溶液颜色变为无色,上部气体也变为无色。 书写NaOH与盐酸和次氯酸反应的化学方程式。 ①培养学生对比、观察及表达概括能力。②与上述设疑前后呼应,从而突破难点,强调重点。③从而使学生认识到量变到质变这个普遍存在的客观规律,对学生进行辩证唯物主义教育。④培养学生书写化学方程式要规范。
【指导看书】课本第七页最后两个自然段。【点拨】次氯酸盐比次氯酸稳定,且在一定条件下转化为次氯酸,故次氯酸盐也可用来漂白、杀菌。 看书后归纳:①漂白粉的成分;②漂白粉的有效成分;③漂白粉的漂白原理。 培养自学、概括的能力。
请同学们自己总结氯气的化学性质。【板书】氯气是一种活泼的非金属。 总结氯气的化学性质:①氯气能与绝大多数金属反应;②氯气能与非金属反应;③氯气跟水反应;④氯气跟碱反应。 及时反馈,了解学生掌握情况。
【巩固、演示】把一装满Cl2的试管倒立在滴有酚酞试液的氢氧化钠溶液中,摇动试管。请描述现象并解释原因。 现象:①粉红色逐渐褪去;②液体沿试管内壁上升到一定高度。原因:①由于Cl2与NaOH反应,从而使NaOH减少,所以粉红色褪去;②Cl2减 及时反馈,了解学生掌握情况。
续表
教师活动 学生活动 设计意图
少,试管内气体压强减小,外界大气压大于内部大气压,将液体压入试管内。
【随堂检测】1.下列关于氯水的叙述正确的是( )。(A)新制氯水中只含Cl2和H2O分子(B)新制氯水可使紫色石蕊试液先变红,后褪色(C)光照氯水有气泡逸出,该气体是Cl2(D)氯水放置数天后pH值变小2.将下列物质分别滴加到干燥的红色布条上,不能使其褪色的是( )。(A)新制的氯水(B)盐酸(C)液氯 (D)盐酸与次氯酸钠的混合溶液3.书写下列过程所发生反应的化学方程式:向盛有KOH溶液的烧杯中通入足量的Cl2后,再将粉红色的纸花放入溶液中。 知识点:氯水的成分;氯水可漂白的原理;氯与碱反应的方程式及次氯酸的漂白原理。能力水平:理解、应用。
附:随堂检测答案
1.(B)、(D)2.(B)、(C)
3.2KOH+Cl2=KCl+KClO+H2O
Cl2+H2O=HCl+HClO
第一课时
教学目标
知识技能:初步掌握氯气的化学性质,并从氯的原子结构特点和氯气跟金属、非金属化合物的反应了解氯气是一种化学性质非常活泼的非金属。
能力培养:观察能力及抽象概括、形成规律性认识和总结归纳的能力。
科学思想:培养对化学现象与化学本质的辩证认识,以及热爱科学,尊重科学的思想。
科学品质:激发学习兴趣,培养主动意识、严谨求实的科学态度和努力探索的优良品质。
科学方法:观察、记录、科学抽象,通过实验来研究物质及其变化的科学方法。
重点、难点 氯气的化学性质。培养通过现象,挖掘本质的科学研究能力。
教学过程设计
教师活动 学生活动 设计意图
【引入】(1)在初中化学里我们学过氟原子和氯原子的原子结构示意图,请画出。(2)看投影,观察溴、碘、砹三种元素的原子结构示意图,它们与氟、氯有何相似的结构?【投影】氟、氯、溴、碘由于具有相似的结构,因而具有相似的化学性质,成为一族,称为卤族元素,简称卤素。“卤”在希腊文中是“成盐”的意思。在这一章里,重点学习氯的单质——氯气及由氯形成的化合物,并在认识氯的基础上,学习卤素。【板书】第一节氯气 回忆,画出原子结构示意图:看投影思考,回答:最外层电子数都是7。体会是由于结构相似决定的性质相似的理论。 复习初中知识,为新课引入打下基础。 使学生开始接触“结构决定性质”的化学思想。
【板书】一、氯气的性质【展示】出示一瓶氯气,瓶后衬一张白纸。(1)请学生观察并描述其颜色和状态。(2)请一名学生上来闻氯气的气味,并强调闻味的方法。 观察,描述:氯气是黄绿色气体。 闻味,描述:刺鼻的气味。 培养学生观察能力。使学生学会闻味的方法。
续表
教师活动 学生活动 设计意图
【投影】思考氯气是否溶于水? 看投影思考。判断:氯气溶于水。 培养学生观察能力和分析实验现象的能力,体会气体溶于水后,气压减小,液面上升的原理。
【设问】通过以上观察,氯气有哪些物理性质呢?【板书】1.物理性质:氯气通常状况下为黄绿色气体,有刺激性气味,而且溶于水,1体积水溶2体积氯气。 总结并复述氯气的物理性质。 记笔记。 培养学生总结归纳物质的物理性质的能力。强化记忆,突出重点。
【提问】O2、H2、CO2都可以在一定条件下变为液态或固态,Cl2是否也行呢?阅读课本第1页第二段。 阅读,体会氯气可以通过降温而变为液态和固态。 使学生理解到随条件改变,物质的状态改变的规律。
【问题】氯气是否有毒?请阅读课本第2页第一段。 阅读,了解氯气的毒性。 提醒注意。
【讲述】氯气虽有毒,但只要掌握正确的操作方法,实验是没有危险的。 使学生消除恐惧心理。
【板书】2.氯气的化学性质【设问】初中学过Cl2和什么物质反应?写出化学方程式及实验现象。 回忆。 书写。 复习有关旧知识。
【投影】(生成白色固体) 对照修改。 强化记忆,突出重点。
【思考】氯气除了和金属钠反应,是否还会和其它金属反应呢? 思考,设想,寻求证明。 设疑,激发求知欲望。
续表
教师活动 学生活动 设计意图
【演示】将两根细铁丝用砂纸打亮,螺旋绕于火柴棍上,用镊子夹住,在酒精灯上引燃火柴,稍停,待火柴将燃尽,置于盛有氯气的集气瓶中,观察现象。反应完毕,用洗瓶注少量水于集气瓶中,观察溶液颜色。(用实物投影仪将现象投影在大屏幕上) 观察:描述:棕色烟→棕黄色溶液 培养学生的观察和表述能力。
【复习】烟和气体的区别 回忆、思考,回答:烟是固体小颗粒组成。 理解烟和气的本质区别。
【结论】铁在氯气中燃烧生成氯化铁。请写出化学方程式及实验现象。 总结,书写化学方程式。 培养学生归纳总结能力。
【投影】(燃烧,棕色烟,棕黄色溶液) 对照修改。 强化记忆,突出重点。
【演示】用砂纸打亮铜丝,用镊子夹住,在酒精灯上加热至红热,放入盛有氯气的集气瓶中,观察现象。反应完毕,用洗瓶注少量水于集气瓶中。观察溶液颜色。(用实物投影仪将现象投影在大屏幕上) 观察:描述:棕黄色烟→绿色溶液 培养学生观察表述能力。
【结论】铜在氯气中燃烧生成氯化铜。请写出化学方程式及实验现象。 总结,书写。 培养学生归纳总结能力。
【投影】(燃烧,棕黄色烟,绿色溶液) 对照修改。 强化记忆,突出重点。
【讲述】氯气在加热条件下,还可以和金、铂反应,生成相应的金属氯化物。【设问】通过以上实验,思考氯气有怎样的化学性质? 思考,总结。回答:氯气可以和金属反应。 培养学生归纳总结的能力。
【板书】1.氯气和金属的反应 记笔记。 强化记忆,突出重点。
续表
教师活动 学生活动 设计意图
【设问】氯气能否和非金属反应? 思考,设想,寻求证明。 设疑,引起学生兴趣。
在初中学过氯气和一种非金属的反应,写出化学方程式和实验现象。 回忆。书写。 复习有关旧知识。
【投影】(安静燃烧,苍白色火焰,瓶口有白雾产生,有刺激性气味气体生成。) 对照修改。 强化记忆,突出重点。
【演示】向学生交代事先准备的放在试管架上的试管中盛有氯酸钾和镁粉,滴入浓盐酸将会产生氢气和氯气。然后打开塞子,用弯头滴管吸取少量37%的浓盐酸(最好是新开瓶的分析纯盐酸),以每秒钟1滴的速度滴入试管中。当试管内产生黄绿色气体时,慢一些滴加盐酸。大约一分钟后会产生强烈爆鸣声。(资料见附2) 观察:描述:有强烈爆鸣声。 培养学生观察和表述的能力。
【结论】氢气与氯气混合,见强光爆炸。请写出化学方程式及实验现象。 总结,书写。 培养学生总结归纳能力。
【投影】 (爆炸,瓶口有白雾) 对照修改。 强化记忆,突出重点。
【设问】氯气除了和氢气反应外,是否还和其它非金属单质反应呢? 思考,设想,寻求证明。 设疑,激发求知欲望。
【演示】将少量红磷放在燃烧匙中,在酒精灯上加热至燃烧后,放入盛有氯气的集气瓶中。指导学生观察瓶壁上及瓶内现象。 观察并描述现象:红磷在氯气中燃烧,瓶壁上有无色液滴,瓶内有大量白色烟雾产生。 培养学生观察和描述现象的能力。
【复习】烟和雾的区别。 回忆并回答:烟是固体小颗粒组成,雾是液体小液滴组成的。 辨析概念。
续表
教师活动 学生活动 设计意图
【结论】红磷在氯气中燃烧产生三氯化磷液体和五氯化磷固体。请写出化学方程式及实验现象。 总结,书写。 培养学生归纳总结能力。
【投影】(燃烧,白色烟雾) 对照修改。 强化记忆,突出重点。
【设问】通过以上实验,思考氯气有怎样的化学性质? 回答:氯气可以和非金属反应。 培养学生科学的抽象归纳的能力。
【板书】2.氯气和非金属的反应。 记笔记。 强化记忆,突出重点。
【提问】燃烧的定义是什么? 回忆,回答:物质跟氧气发生的发光发热的剧烈的化学反应。 复习有关旧知识。
【讨论】(1)可燃物是否一定有氧气才能燃烧呢?(2)请重新给燃烧下定义。 讨论,回答:(1)燃烧不一定有氧气。(2)发光放热的剧烈的化学反应叫做燃烧。 培养学生科学的抽象归纳的能力。
【板书】燃烧:发光放热的剧烈的化学反应。 记笔记。 强化记忆,突出重点。
【问题讨论】(1)为何氯气的化学性质活泼呢?看投影,分析氯元素在这些化学反应中化合价是如何变化的,有怎样的规律?(2)为何有这样的规律,试从氯元素的微观结构上找原因。【投影】 思考,讨论。回答:(1)氯元素在这些化学反应中化合价都是由0价变为-1价。(2)氯原子最外层有7个电子,容易得一个电子而达到8个电子的稳定结构, 使学生初步形成结构决定性质的理论,并学会用这个理论来解释现象。
续表
教师活动 学生活动 设计意图
从而由0价变为-1价。由于氯原子有这样的微观结构,决定了它的化学性质非常活泼。
【小结】氯气是一种化学性质非常活泼的气体,一定条件下,能与金属、非金属反应。 记笔记。 强化记忆,突出重点。
【作业】课本第9页习题2(1)(3)、5。 巩固知识。
【随堂检测】1.在下列各组物质的反应过程中:(A)氢气与氯气混合,见光。(B)铁丝在氯气中燃烧。(C)铜丝在氯气中燃烧。(D)金属钠在氯气中燃烧。(E)红磷在氯气中燃烧。(1)能生成白色烟的是( );(2)能生成棕黄色烟的是( ),溶于水得______色溶液;(3)能生成白色烟雾的是( );(4)能爆炸的是( );(5)能生成棕色烟的是( ),溶于水得______色溶液。请写出各反应的化学方程式。2.下列微粒化学性质最活泼的是( )。(A)氢原于(B)氯离子(C)钠离子(D)氩原子 1.考察学生对重点实验的现象和化学方程式的掌握情况。2.检查学生是否会用微粒结构分析判断化学性质。
附2:备注 事先用天平称取新镁粉和氯酸钾晶体各0.2g,把镁粉平均分为五份,取一份装在洁净而干燥的试管(15×150mm)中然后在装入的镁粉上铺一层氯酸钾晶体(约40mg),放在试管架上,塞好橡皮塞,保存备用。另外课前需将微型杯放在集气瓶中加氯酸钾和浓盐酸制好六瓶氯气。
第二课时
教学目标
知识技能:认识氯气能溶于水,掌握氯气跟水的反应;了解氯水可用来漂白杀菌及氯水的不稳定性;掌握氯气跟碱的反应及漂白粉的制法和漂白原理;从中进一步认识氯气是一种活泼的非金属。
能力培养:通过学生自己动手实验(氯气跟水的反应,氯水的漂白、氯气跟碱的反应)培养学生对比、观察和表达的能力;并从上述实验事实中体会到氯气跟水反应因条件的改变而出现反应程度的差异;并从中培养学生抽象概括的能力。
思想情感:结合学生实验,培养学生认真仔细、严谨求实的科学态度;通过氯气跟水反应因条件的改变而出现反应程度的差异,培养学生探究精神。
科学方法:观察、记录、科学抽象,通过实验来研究物质及其变化的科学方法。
重点、难点 氯气跟水的反应;对比观察实验的能力;抽象概括出氯气跟水反应因条件的改变而出现反应程度的差异。
教学过程设计
教师活动 学生活动 设计意图
【复习引入】上节课学习了氯气的哪些重要化学性质?这节课我们继续学习氯气的另两种重要的化学性质。 回忆、学生回答。 复习,引导学生进入新课情境。
【指导实验】向一支充满氯气的大试管中加入2~3mL水后,迅速塞紧塞子,充分振荡,将上述试管和另一支充满氯气的大试管以及另外一支装有4~5mL蒸馏水的试管放在一起。对比观察:加入水后的试管中溶液颜色有什么变化?试管上部空间气体颜色有什么变化?【设问】上述变化说明什么?氯水的气味,是哪种物质的气味?你曾经闻到过吗?【板书】①氯气能溶于水,但溶解度不大。②氯水呈现黄绿色,说明氯水中有游离的氯。 完成实验一。观察现象:思考后表述:①溶液有点发黄;②上部空间气体颜色变浅。上述变化说明氯气能溶在水中,但溶的不多。闻氯水的气味。回答:好像游泳池中的气味。 ①培养学生对比、观察及表达能力。②培养学生认真仔细的科学态度。③鼓励学生积极思考。④理论联系实际。
【指导实验】分别用两只玻璃棒蘸取稀盐酸和氯水,分别滴在两条蓝色石蕊试纸上。观察两条试纸的颜色变化并比较两者有什么不同?【解疑】氯气与水反应有酸生成【设问】新制氯水的成分是什么?【点拨】新制的氯水中大约有40%的氯和水反应。【板书】氯水是混合物 完成实验二:观察现象并回答:滴有盐酸的试纸变红,而滴有氯水的试纸中间变白,外圈变红。概括:新制氯水的成分:H2O、Cl2、HClO、H+、Cl-。 ①培养学生对比、观察及表达能力。②培养学生综合的能力。③为突破难点作准备。
续表
教师活动 学生活动 设计意图
【设疑】当我们改变上述反应条件时,上述反应进行的程度会不会发生变化呢? 思考。 突出本节课的难点。为突破难点而设疑。
【启发】观察滴有氯水的蓝色石蕊试纸中间变白,说明氯水中有能够使有色物质褪色的物质生成。我们已知道H2O和盐酸没有漂白的作用,要么氯气有漂白作用,要么HClO有漂白作用,或两者都有。请自己设计一个实验(用所给仪器和试剂)证明到底是哪种物质有漂白作用?【设疑】仔细观察两支试管内上部空间的气体颜色有什么不同?装有氯水的试管内上部空间的气体颜色为什么会变浅?【概括解疑】①次氯酸有强氧化性,因此氯水可用来漂白、杀菌。②当氯水遇到被漂白的物质时,消耗了次氯酸,使没有和H2O反应的Cl2又继续和水反应,也使没有溶在水中的Cl2又继续溶在水中,这样循环往复,只要加入的被漂白的物质的量足够,最终上部空间气体的颜色会消失。即当氯水遇到被漂白的物质时,使氯气与水的反应趋于完全。 讨论、并完成该实验。找2~3个小组汇报实验结果。方法:取2条蓝色石蕊试纸分别放入装有氯气的大试管和装有氯水的大试管中。 结果:前者不褪色而后者褪色。 概括:次氯酸具有漂白作用,而氯气没有漂白作用。 ①教给学生如何分析问题、初步解决问题的基本思路和方法。②激励学生勇于探究。③引导学生如何观察,从而为突破难点,打下感性认识的基础。④培养学生抽象概括的能力以及逻辑推理的能力。⑤与设疑前后呼应,从而突出重点和难点。
【演示】氯水见光分解【设问】氯水中什么物质可以分解放出氧气?为什么?【点拨】实验证明氯水见光后可以产生气体——这个气体是氧气。【设疑】当氯水放在强光下长时间放置时,氯水的颜色有什么变化?组成上有什么变化?为什么? 思考概括:氯水中只有H2O和HClO中含有氧元素,而H2O见光不能分解,所以只能是HClO见光分解放出氧气。抽象概括:由于次氯酸的见光分解,消耗了HClO,使得氯气与水的反应趋于完全。所以氯水的颜色会慢慢变浅,盐酸的成分会越来越多。 ①培养学生逻辑推理的能力。②与上述的设疑前后呼应,从而突破难点。③培养表达能力、概括能力。
续表
教师活动 学生活动 设计意图
【指导实验】向学生实验一中加入水后的试管中加入1粒固体NaOH,充分振荡。将三支试管放在一起对比观察:溶液颜色有什么变化?上部空间的气体颜色有什么变化?为什么?【投影】Cl2+2NaOH=NaCl+NaClO+H2O【点拨】氯气与氢氧化钙反应即工业制漂白粉的原理。2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 完成实验三。讨论后,抽象概括:①NaOH与氯水中的盐酸和次氯酸反应生成盐,消耗了氯水中的次氯酸,使得Cl2与H2O的反应趋于完全。②NaOH的量足够,即可使溶液颜色变为无色,上部气体也变为无色。 书写NaOH与盐酸和次氯酸反应的化学方程式。 ①培养学生对比、观察及表达概括能力。②与上述设疑前后呼应,从而突破难点,强调重点。③从而使学生认识到量变到质变这个普遍存在的客观规律,对学生进行辩证唯物主义教育。④培养学生书写化学方程式要规范。
【指导看书】课本第七页最后两个自然段。【点拨】次氯酸盐比次氯酸稳定,且在一定条件下转化为次氯酸,故次氯酸盐也可用来漂白、杀菌。 看书后归纳:①漂白粉的成分;②漂白粉的有效成分;③漂白粉的漂白原理。 培养自学、概括的能力。
请同学们自己总结氯气的化学性质。【板书】氯气是一种活泼的非金属。 总结氯气的化学性质:①氯气能与绝大多数金属反应;②氯气能与非金属反应;③氯气跟水反应;④氯气跟碱反应。 及时反馈,了解学生掌握情况。
【巩固、演示】把一装满Cl2的试管倒立在滴有酚酞试液的氢氧化钠溶液中,摇动试管。请描述现象并解释原因。 现象:①粉红色逐渐褪去;②液体沿试管内壁上升到一定高度。原因:①由于Cl2与NaOH反应,从而使NaOH减少,所以粉红色褪去;②Cl2减 及时反馈,了解学生掌握情况。
续表
教师活动 学生活动 设计意图
少,试管内气体压强减小,外界大气压大于内部大气压,将液体压入试管内。
【随堂检测】1.下列关于氯水的叙述正确的是( )。(A)新制氯水中只含Cl2和H2O分子(B)新制氯水可使紫色石蕊试液先变红,后褪色(C)光照氯水有气泡逸出,该气体是Cl2(D)氯水放置数天后pH值变小2.将下列物质分别滴加到干燥的红色布条上,不能使其褪色的是( )。(A)新制的氯水(B)盐酸(C)液氯 (D)盐酸与次氯酸钠的混合溶液3.书写下列过程所发生反应的化学方程式:向盛有KOH溶液的烧杯中通入足量的Cl2后,再将粉红色的纸花放入溶液中。 知识点:氯水的成分;氯水可漂白的原理;氯与碱反应的方程式及次氯酸的漂白原理。能力水平:理解、应用。
附:随堂检测答案
1.(B)、(D)2.(B)、(C)
3.2KOH+Cl2=KCl+KClO+H2O
Cl2+H2O=HCl+HClO
