6.2 金属的化学性质(第2课时金属活动性顺序的应用 )同步练习--2020-2021学年九年级化学科粤版(2012)下册(含解析)
文档属性
| 名称 | 6.2 金属的化学性质(第2课时金属活动性顺序的应用 )同步练习--2020-2021学年九年级化学科粤版(2012)下册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 155.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-23 00:05:31 | ||
图片预览


文档简介
6.2 第2课时 金属活动性顺序的应用
一、选择题
1.下列金属中,金属活动性最强的是 ( )
A.铁 B.镁
C.锌 D.铜
2.下列金属不能和FeSO4溶液反应的是 ( )
A.Zn B.Mg
C.Cu D.Al
3.[2020·无锡] 将一根洁净的铜丝放入AgNO3溶液中,一段时间后,溶液从无色变为蓝色,铜丝表面生长出如图1所示的白色“树枝”,下列叙述错误的是 ( )
图1
A.白色“树枝”的成分是银
B.溶液变为蓝色,表明Cu转变为Cu2+
C.所得溶液中肯定不含Ag+
D.铜的金属活动性比银强
4.[2020·郴州] 为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是 ( )
A.将镁片放入稀盐酸中
B.将铜片放入稀盐酸中
C.将镁片放入硝酸银溶液中
D.将铜片放入硝酸银溶液中
5.化学小组为探究铝、铜、银三种金属的活动性顺序,设计了如图2所示的实验方案。下列说法不正确的是 ( )
图2
A.由实验甲可知金属活动性:Al>Cu
B.由实验乙可知金属活动性:Cu>Ag
C.由实验乙、丙可知金属活动性:Al>Cu>Ag
D.将实验甲中的CuSO4溶液改为CuCl2溶液不能达到本实验的探究目的
6.将一定质量的Zn加入Fe(NO3)2和AgNO3的混合溶液中,充分反应后过滤,滤液仍为浅绿色。下列叙述正确的是 ( )
①滤液中一定有Zn2+、Fe2+ ②滤液中可能有Ag+ ③滤渣中一定有Ag,可能有Fe
A.①② B.①③ C.②③ D.①②③
二、填空题
7.为了验证银、铜、锌的金属活动性强弱,同学们设计了如图3所示的实验。
图3
(1)实验一中产生气体的金属是 ,该反应的化学方程式为 。其他金属不能反应的原因是 。
(2)为了达到实验目的,且实验二中固体X和Y溶液发生了化学反应,则X、Y分别为 ,观察到的现象是 。
8.[2021·北京期末] 如图4为化学小组探究金属的化学性质所做的三个实验。回答下列问题。
图4
(1)B中发生反应的化学方程式为 。
(2)无明显现象的实验是 (填字母),原因是 。
(3)综合三个实验,得出三种金属活动性强弱的关系是 。
三、实验探究题
9.在探究金属活动性顺序时,小雪同学把两根绕成螺旋状的洁净铜丝分别浸入硫酸铝溶液、硝酸银溶液中,过一会儿取出。
(1)铜丝浸入硫酸铝溶液中,可观察到 。
(2)铜丝浸入硝酸银溶液中,可观察到铜丝上有银白色物质生成,溶液逐渐变成 色。
(3)铜丝浸入硝酸银溶液中,离子数目减少的是 ,离子数目增多的是 。
(4)根据上述实验所观察到的现象,小雪同学 (填“能”或“不能”)证明铝、铜、银的金属活动性顺序为铝>铜>银。
10.某化学兴趣小组的同学要探究铝、铁、铜三种金属的活动性顺序,请你参与探究并回答问题。
[实验探究] 同学们用粗细相同的铝丝和铁丝、硫酸亚铁溶液、硫酸铜溶液进行如下表所示的实验。
操作 根据现象得出金属活动性顺序为
固体表面现象 铝丝表面附着黑色固体 铝丝表面附着紫红色固体
写出铝与硫酸铜溶液反应的化学方程式: 。
[交流讨论]
(1)同学们经过讨论后认为上述方案可以优化, (填“甲”“乙”或“丙”)实验是多余的。
(2)小明认为,只用一支盛有少量稀硫酸的试管,合理安排金属丝的插入顺序(能与稀硫酸反应的要一次将稀硫酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。他设计了两种插入顺序,请你补全顺序二。
顺序一:铜丝、铁丝、铝丝;
顺序二: 。
[实验验证] 小明按顺序一做实验时,发现铁丝放入稀硫酸中片刻,无气泡产生,几分钟后才有少量气泡产生,你认为可能的原因是 ,所以你建议做金属活动性顺序的探究实验之前应该 。
四、计算题
11.[2020·海南] 湿法炼铜为我国首创。早在西汉时期,就有从胆矾水溶液中置换出铜的记载,其反应的化学方程式为Fe+CuSO4Cu+FeSO4。若采用此法炼制128 t铜,需要消耗铁的质量是多少
【能力提升】
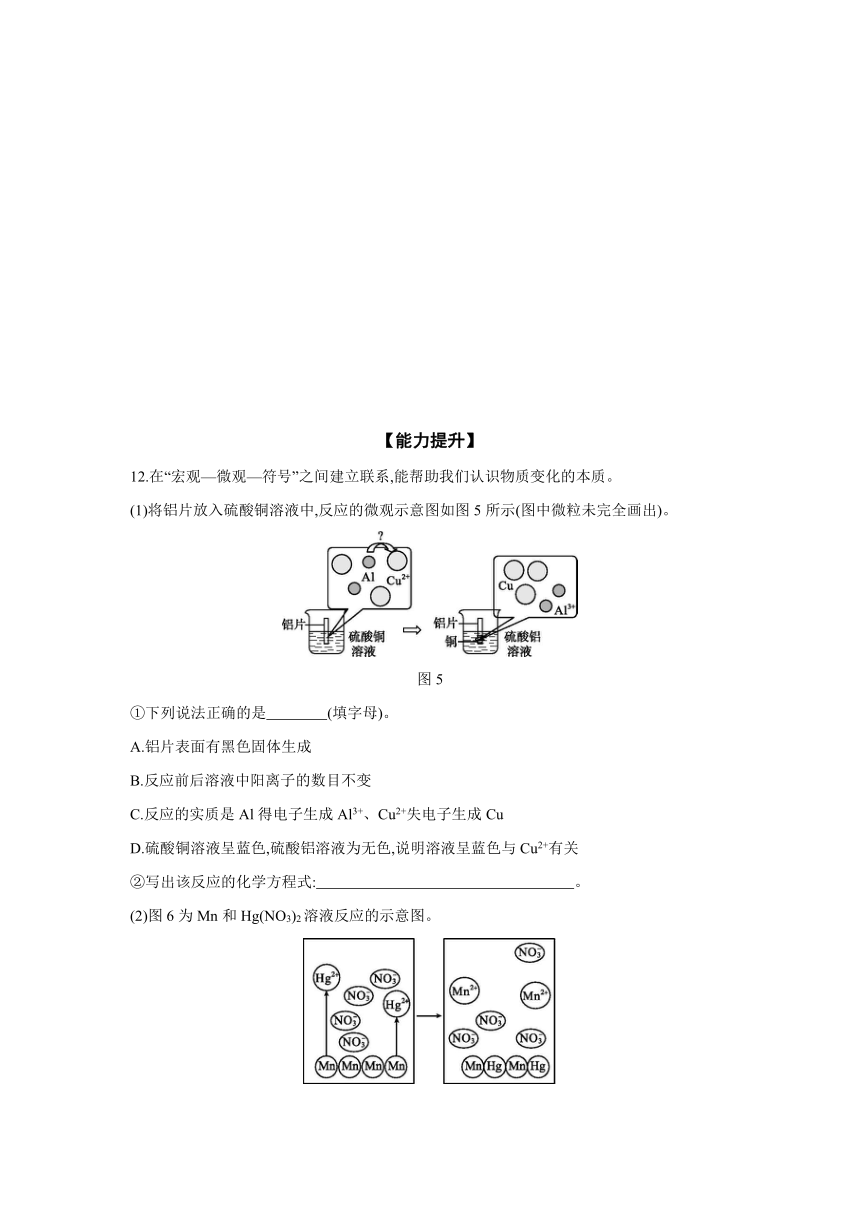
12.在“宏观—微观—符号”之间建立联系,能帮助我们认识物质变化的本质。
(1)将铝片放入硫酸铜溶液中,反应的微观示意图如图5所示(图中微粒未完全画出)。
图5
①下列说法正确的是 (填字母)。
A.铝片表面有黑色固体生成
B.反应前后溶液中阳离子的数目不变
C.反应的实质是Al得电子生成Al3+、Cu2+失电子生成Cu
D.硫酸铜溶液呈蓝色,硫酸铝溶液为无色,说明溶液呈蓝色与Cu2+有关
②写出该反应的化学方程式: 。
(2)图6为Mn和Hg(NO3)2溶液反应的示意图。
图6
①由反应可知金属的活动性:Mn (填“>”或“<”)Hg。
②该反应的实质是Mn与 (填微粒名称)反应。
答案
1.B
2.C [解析] 在金属活动性顺序表中Cu在Fe后,不能和FeSO4溶液反应。
3.C [解析] 铜能与硝酸银发生置换反应,说明铜的金属活动性比银强;反应生成硝酸铜和银,白色“树枝”的成分是银;溶液变为蓝色,表明Cu转变为Cu2+;无法确定硝酸银是否有剩余,所得溶液中可能含有Ag+。
4.C [解析] 在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把位于它后面的金属从其化合物溶液中置换出来。将镁片放入稀盐酸中,反应生成氢气,说明镁的金属活动性比氢强;将铜片放入稀盐酸中,无明显现象,说明铜和稀盐酸不反应,说明铜的金属活动性比氢弱;将镁片放入硝酸银溶液中,镁与硝酸银溶液反应置换出银,说明镁的金属活动性强于银;将铜片放入硝酸银溶液中,铜与硝酸银溶液反应置换出银,说明铜的金属活动性强于银;根据A、B、D可得出三种金属活动性顺序:镁>铜>银。所以将镁片放入硝酸银溶液中的实验不必进行。
5.D
6.D [解析] 将一定质量的锌加入含有硝酸亚铁和硝酸银两种物质的混合溶液中,锌会先与硝酸银反应,然后再与硝酸亚铁反应,充分反应后过滤,滤液仍为浅绿色,说明溶液中的硝酸亚铁可能部分参加反应,也可能没有参加反应。所以滤液中一定有Zn2+、Fe2+,可能有Ag+,滤渣中一定有Ag,可能有Fe。
7.(1)锌片 Zn+H2SO4ZnSO4+H2↑
在金属活动性顺序表中,银、铜位于氢的后面
(2)铜、硝酸银 铜片的表面有银白色固体析出,溶液由无色变为蓝色
8.(1)Fe+CuSO4FeSO4+Cu
(2)C 在金属活动性顺序表中铜位于氢的后面
(3)Fe>Cu>Ag
[解析] (1)B中铁能与硫酸铜反应生成硫酸亚铁和铜,化学方程式为Fe+CuSO4FeSO4+Cu。(2)无明显现象的实验是C,因为在金属活动性顺序表中,位于氢前面的金属能置换出酸中的氢,铜位于氢的后面,铜与稀盐酸不反应。(3)铜能与硝酸银溶液反应,说明铜的金属活动性比银强;铁能与硫酸铜反应,说明铁的金属活动性比铜强,则三种金属活动性强弱的关系是Fe>Cu>Ag。
9.(1)无明显现象 (2)蓝
(3)Ag+ Cu2+ (4)能
[解析] (3)铜丝浸入硝酸银溶液中,生成硝酸铜溶液和银,其中银离子得到电子转化为银原子,铜原子失去电子转化为铜离子。(4)根据铜丝浸入硫酸铝溶液中,无明显现象,说明金属活动性铝强于铜,铜丝浸入硝酸银溶液中,铜丝表面有银白色固体析出,溶液由无色逐渐变成蓝色,说明金属活动性铜强于银,可得铝、铜、银的金属活动性顺序为铝>铜>银。
10.[实验探究] 铁丝表面附着紫红色固体 铝>铁>铜 2Al+3CuSO4Al2(SO4)3+3Cu
[交流讨论] (1)丙 (2)铁丝、铜丝、铝丝
[实验验证] 铁丝表面有铁锈(其他合理答案均可) 先用砂纸打磨金属,除去表面的氧化物及污物
[解析] [交流讨论] (1)铝丝能和硫酸亚铁反应,说明铝比铁活泼,铁丝能和硫酸铜反应,说明铁比铜活泼,即活动性铝>铁>铜,无须再做丙实验。(2)加入铁丝时,铁和稀硫酸反应生成硫酸亚铁和氢气;加入铜丝时,无明显现象,说明铜不能和硫酸亚铁反应,即铁比铜活泼;加入铝丝时,铝丝表面附着黑色固体,溶液由浅绿色变成无色,说明铝比铁活泼,即能证明活动性铝>铁>铜。
11.解:设需要消耗铁的质量为x。
Fe+CuSO4Cu+FeSO4
56 64
x 128 t
= x=112 t
答:需要消耗铁的质量为112 t。
[解析] 根据反应的化学方程式及其提供数据,依据在化学反应中各物质的质量比等于各物质的相对分子质量与系数乘积之比,进行相关方面的计算。
12.(1)①D ②2Al+3CuSO4Al2(SO4)3+3Cu
(2)①> ②汞离子
[解析] (1)铝和硫酸铜反应生成硫酸铝和铜,①铝片表面有紫红色固体生成;由化学方程式2Al+3CuSO4Al2(SO4)3+3Cu可知,硫酸根离子不变,2个铝原子和3个铜离子反应生成3个铜原子和2个铝离子,所以反应前后溶液中阳离子的数目减少;反应的实质是Al失去电子生成Al3+、Cu2+得到电子生成Cu;硫酸铜溶液呈蓝色,硫酸铝溶液为无色,说明溶液呈蓝色与Cu2+有关。
一、选择题
1.下列金属中,金属活动性最强的是 ( )
A.铁 B.镁
C.锌 D.铜
2.下列金属不能和FeSO4溶液反应的是 ( )
A.Zn B.Mg
C.Cu D.Al
3.[2020·无锡] 将一根洁净的铜丝放入AgNO3溶液中,一段时间后,溶液从无色变为蓝色,铜丝表面生长出如图1所示的白色“树枝”,下列叙述错误的是 ( )
图1
A.白色“树枝”的成分是银
B.溶液变为蓝色,表明Cu转变为Cu2+
C.所得溶液中肯定不含Ag+
D.铜的金属活动性比银强
4.[2020·郴州] 为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是 ( )
A.将镁片放入稀盐酸中
B.将铜片放入稀盐酸中
C.将镁片放入硝酸银溶液中
D.将铜片放入硝酸银溶液中
5.化学小组为探究铝、铜、银三种金属的活动性顺序,设计了如图2所示的实验方案。下列说法不正确的是 ( )
图2
A.由实验甲可知金属活动性:Al>Cu
B.由实验乙可知金属活动性:Cu>Ag
C.由实验乙、丙可知金属活动性:Al>Cu>Ag
D.将实验甲中的CuSO4溶液改为CuCl2溶液不能达到本实验的探究目的
6.将一定质量的Zn加入Fe(NO3)2和AgNO3的混合溶液中,充分反应后过滤,滤液仍为浅绿色。下列叙述正确的是 ( )
①滤液中一定有Zn2+、Fe2+ ②滤液中可能有Ag+ ③滤渣中一定有Ag,可能有Fe
A.①② B.①③ C.②③ D.①②③
二、填空题
7.为了验证银、铜、锌的金属活动性强弱,同学们设计了如图3所示的实验。
图3
(1)实验一中产生气体的金属是 ,该反应的化学方程式为 。其他金属不能反应的原因是 。
(2)为了达到实验目的,且实验二中固体X和Y溶液发生了化学反应,则X、Y分别为 ,观察到的现象是 。
8.[2021·北京期末] 如图4为化学小组探究金属的化学性质所做的三个实验。回答下列问题。
图4
(1)B中发生反应的化学方程式为 。
(2)无明显现象的实验是 (填字母),原因是 。
(3)综合三个实验,得出三种金属活动性强弱的关系是 。
三、实验探究题
9.在探究金属活动性顺序时,小雪同学把两根绕成螺旋状的洁净铜丝分别浸入硫酸铝溶液、硝酸银溶液中,过一会儿取出。
(1)铜丝浸入硫酸铝溶液中,可观察到 。
(2)铜丝浸入硝酸银溶液中,可观察到铜丝上有银白色物质生成,溶液逐渐变成 色。
(3)铜丝浸入硝酸银溶液中,离子数目减少的是 ,离子数目增多的是 。
(4)根据上述实验所观察到的现象,小雪同学 (填“能”或“不能”)证明铝、铜、银的金属活动性顺序为铝>铜>银。
10.某化学兴趣小组的同学要探究铝、铁、铜三种金属的活动性顺序,请你参与探究并回答问题。
[实验探究] 同学们用粗细相同的铝丝和铁丝、硫酸亚铁溶液、硫酸铜溶液进行如下表所示的实验。
操作 根据现象得出金属活动性顺序为
固体表面现象 铝丝表面附着黑色固体 铝丝表面附着紫红色固体
写出铝与硫酸铜溶液反应的化学方程式: 。
[交流讨论]
(1)同学们经过讨论后认为上述方案可以优化, (填“甲”“乙”或“丙”)实验是多余的。
(2)小明认为,只用一支盛有少量稀硫酸的试管,合理安排金属丝的插入顺序(能与稀硫酸反应的要一次将稀硫酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。他设计了两种插入顺序,请你补全顺序二。
顺序一:铜丝、铁丝、铝丝;
顺序二: 。
[实验验证] 小明按顺序一做实验时,发现铁丝放入稀硫酸中片刻,无气泡产生,几分钟后才有少量气泡产生,你认为可能的原因是 ,所以你建议做金属活动性顺序的探究实验之前应该 。
四、计算题
11.[2020·海南] 湿法炼铜为我国首创。早在西汉时期,就有从胆矾水溶液中置换出铜的记载,其反应的化学方程式为Fe+CuSO4Cu+FeSO4。若采用此法炼制128 t铜,需要消耗铁的质量是多少
【能力提升】
12.在“宏观—微观—符号”之间建立联系,能帮助我们认识物质变化的本质。
(1)将铝片放入硫酸铜溶液中,反应的微观示意图如图5所示(图中微粒未完全画出)。
图5
①下列说法正确的是 (填字母)。
A.铝片表面有黑色固体生成
B.反应前后溶液中阳离子的数目不变
C.反应的实质是Al得电子生成Al3+、Cu2+失电子生成Cu
D.硫酸铜溶液呈蓝色,硫酸铝溶液为无色,说明溶液呈蓝色与Cu2+有关
②写出该反应的化学方程式: 。
(2)图6为Mn和Hg(NO3)2溶液反应的示意图。
图6
①由反应可知金属的活动性:Mn (填“>”或“<”)Hg。
②该反应的实质是Mn与 (填微粒名称)反应。
答案
1.B
2.C [解析] 在金属活动性顺序表中Cu在Fe后,不能和FeSO4溶液反应。
3.C [解析] 铜能与硝酸银发生置换反应,说明铜的金属活动性比银强;反应生成硝酸铜和银,白色“树枝”的成分是银;溶液变为蓝色,表明Cu转变为Cu2+;无法确定硝酸银是否有剩余,所得溶液中可能含有Ag+。
4.C [解析] 在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把位于它后面的金属从其化合物溶液中置换出来。将镁片放入稀盐酸中,反应生成氢气,说明镁的金属活动性比氢强;将铜片放入稀盐酸中,无明显现象,说明铜和稀盐酸不反应,说明铜的金属活动性比氢弱;将镁片放入硝酸银溶液中,镁与硝酸银溶液反应置换出银,说明镁的金属活动性强于银;将铜片放入硝酸银溶液中,铜与硝酸银溶液反应置换出银,说明铜的金属活动性强于银;根据A、B、D可得出三种金属活动性顺序:镁>铜>银。所以将镁片放入硝酸银溶液中的实验不必进行。
5.D
6.D [解析] 将一定质量的锌加入含有硝酸亚铁和硝酸银两种物质的混合溶液中,锌会先与硝酸银反应,然后再与硝酸亚铁反应,充分反应后过滤,滤液仍为浅绿色,说明溶液中的硝酸亚铁可能部分参加反应,也可能没有参加反应。所以滤液中一定有Zn2+、Fe2+,可能有Ag+,滤渣中一定有Ag,可能有Fe。
7.(1)锌片 Zn+H2SO4ZnSO4+H2↑
在金属活动性顺序表中,银、铜位于氢的后面
(2)铜、硝酸银 铜片的表面有银白色固体析出,溶液由无色变为蓝色
8.(1)Fe+CuSO4FeSO4+Cu
(2)C 在金属活动性顺序表中铜位于氢的后面
(3)Fe>Cu>Ag
[解析] (1)B中铁能与硫酸铜反应生成硫酸亚铁和铜,化学方程式为Fe+CuSO4FeSO4+Cu。(2)无明显现象的实验是C,因为在金属活动性顺序表中,位于氢前面的金属能置换出酸中的氢,铜位于氢的后面,铜与稀盐酸不反应。(3)铜能与硝酸银溶液反应,说明铜的金属活动性比银强;铁能与硫酸铜反应,说明铁的金属活动性比铜强,则三种金属活动性强弱的关系是Fe>Cu>Ag。
9.(1)无明显现象 (2)蓝
(3)Ag+ Cu2+ (4)能
[解析] (3)铜丝浸入硝酸银溶液中,生成硝酸铜溶液和银,其中银离子得到电子转化为银原子,铜原子失去电子转化为铜离子。(4)根据铜丝浸入硫酸铝溶液中,无明显现象,说明金属活动性铝强于铜,铜丝浸入硝酸银溶液中,铜丝表面有银白色固体析出,溶液由无色逐渐变成蓝色,说明金属活动性铜强于银,可得铝、铜、银的金属活动性顺序为铝>铜>银。
10.[实验探究] 铁丝表面附着紫红色固体 铝>铁>铜 2Al+3CuSO4Al2(SO4)3+3Cu
[交流讨论] (1)丙 (2)铁丝、铜丝、铝丝
[实验验证] 铁丝表面有铁锈(其他合理答案均可) 先用砂纸打磨金属,除去表面的氧化物及污物
[解析] [交流讨论] (1)铝丝能和硫酸亚铁反应,说明铝比铁活泼,铁丝能和硫酸铜反应,说明铁比铜活泼,即活动性铝>铁>铜,无须再做丙实验。(2)加入铁丝时,铁和稀硫酸反应生成硫酸亚铁和氢气;加入铜丝时,无明显现象,说明铜不能和硫酸亚铁反应,即铁比铜活泼;加入铝丝时,铝丝表面附着黑色固体,溶液由浅绿色变成无色,说明铝比铁活泼,即能证明活动性铝>铁>铜。
11.解:设需要消耗铁的质量为x。
Fe+CuSO4Cu+FeSO4
56 64
x 128 t
= x=112 t
答:需要消耗铁的质量为112 t。
[解析] 根据反应的化学方程式及其提供数据,依据在化学反应中各物质的质量比等于各物质的相对分子质量与系数乘积之比,进行相关方面的计算。
12.(1)①D ②2Al+3CuSO4Al2(SO4)3+3Cu
(2)①> ②汞离子
[解析] (1)铝和硫酸铜反应生成硫酸铝和铜,①铝片表面有紫红色固体生成;由化学方程式2Al+3CuSO4Al2(SO4)3+3Cu可知,硫酸根离子不变,2个铝原子和3个铜离子反应生成3个铜原子和2个铝离子,所以反应前后溶液中阳离子的数目减少;反应的实质是Al失去电子生成Al3+、Cu2+得到电子生成Cu;硫酸铜溶液呈蓝色,硫酸铝溶液为无色,说明溶液呈蓝色与Cu2+有关。
