6.2第1课时 认识金属的主要化学性质 同步练习 —2020—2021学年九年级化学科粤版下册(含解析)
文档属性
| 名称 | 6.2第1课时 认识金属的主要化学性质 同步练习 —2020—2021学年九年级化学科粤版下册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 145.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-23 00:07:15 | ||
图片预览


文档简介
6.2 第1课时 认识金属的主要化学性质
一、选择题
1.黄金是一种贵重金属,它不仅被视为美好和富有的象征,还可以利用其特有的价值造福于人类。“真金不怕火炼”主要是指金 ( )
A.熔点高 B.延展性好
C.有金属光泽 D.化学性质稳定
2.下列关于金属的化学性质的探究中,叙述与事实相符的是 ( )
A.铜丝在空气中燃烧,生成黑色固体
B.细铁丝在空气中剧烈燃烧、火星四射
C.铜丝插入稀硫酸中,溶液由无色变为蓝色
D.分别向盛有镁条和铁钉的试管中滴加稀硫酸,均有气泡产生,且镁条反应剧烈
3.[2021·福建] 据文献报道:一种特殊的铜纳米颗粒具有与金、银极其相似的反应惰性,可替代黄金制作精密电子元器件。下列对该铜纳米颗粒的判断,正确的是 ( )
A.能与盐酸反应产生氢气 B.在空气中容易锈蚀
C.能与硫酸亚铁发生置换反应 D.具有良好的导电性
4.[2020·北京] 下列不能与稀盐酸反应的金属是( )
A.Cu B.Zn
C.Al D.Mg
5.[2020·淄博改编] 手机的某些部件中含有Mg、Al、Cu等金属,将废旧手机的部件粉碎并浸入足量稀硫酸中充分反应,反应后所得溶液中含有的金属离子是 ( )
A.Mg2+、Al3+ B.Mg2+、Cu2+
C.Al3+、Cu2+ D.Mg2+、Al3+、Cu2+
6.芯片是电脑、“智能”家电等的核心部件,它是用高纯度硅制成的。下面是生产单质硅的过程中的一个重要反应:SiO2+2CSi+2CO↑,该反应的基本类型是( )
A.化合反应 B.分解反应
C.置换反应 D.都不是
7.等质量的Zn、Mg、Al分别与足量稀盐酸反应,消耗酸的质量的关系是 ( )
A.Zn=Mg=Al B.Zn>Mg>Al
C.Al>Zn>Mg D.Al>Mg>Zn
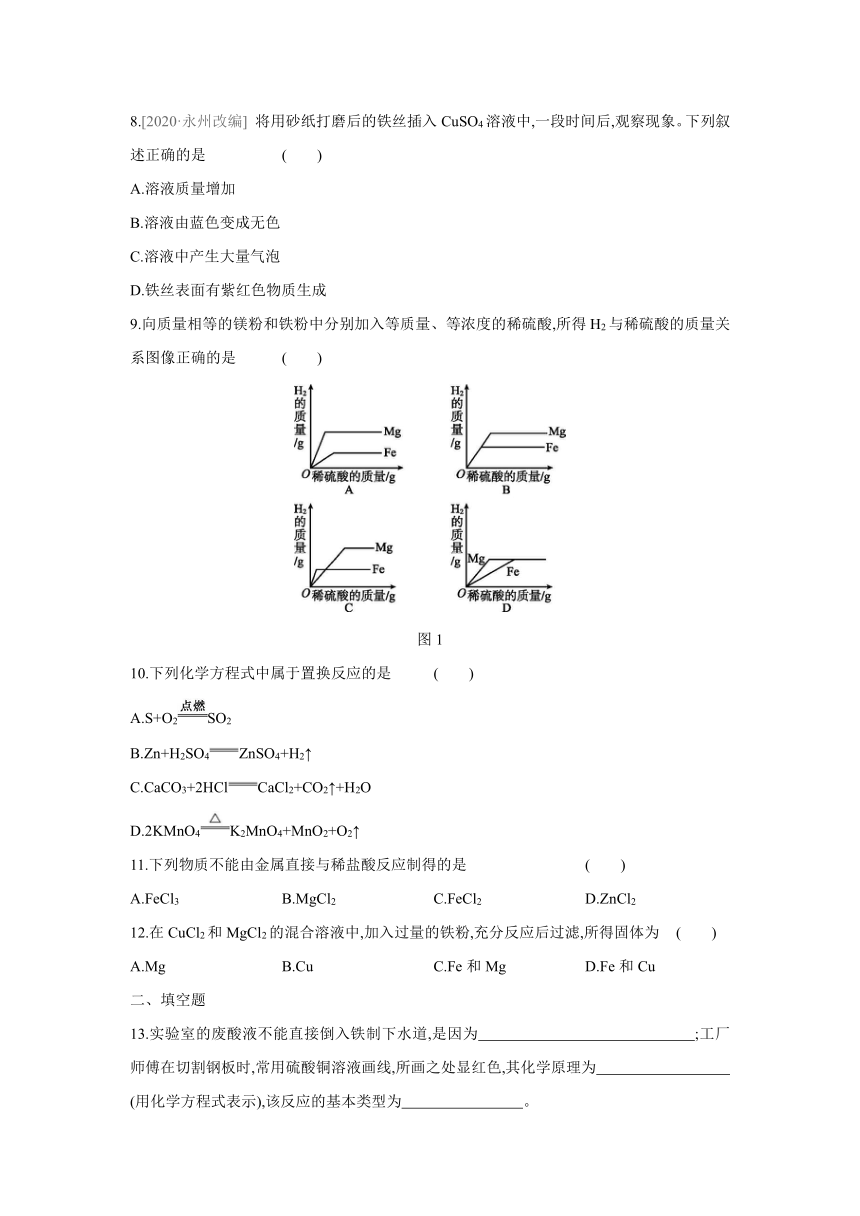
8.[2020·永州改编] 将用砂纸打磨后的铁丝插入CuSO4溶液中,一段时间后,观察现象。下列叙述正确的是 ( )
A.溶液质量增加
B.溶液由蓝色变成无色
C.溶液中产生大量气泡
D.铁丝表面有紫红色物质生成
9.向质量相等的镁粉和铁粉中分别加入等质量、等浓度的稀硫酸,所得H2与稀硫酸的质量关系图像正确的是 ( )
图1
10.下列化学方程式中属于置换反应的是 ( )
A.S+O2SO2
B.Zn+H2SO4ZnSO4+H2↑
C.CaCO3+2HClCaCl2+CO2↑+H2O
D.2KMnO4K2MnO4+MnO2+O2↑
11.下列物质不能由金属直接与稀盐酸反应制得的是 ( )
A.FeCl3 B.MgCl2 C.FeCl2 D.ZnCl2
12.在CuCl2和MgCl2的混合溶液中,加入过量的铁粉,充分反应后过滤,所得固体为 ( )
A.Mg B.Cu C.Fe和Mg D.Fe和Cu
二、填空题
13.实验室的废酸液不能直接倒入铁制下水道,是因为 ;工厂师傅在切割钢板时,常用硫酸铜溶液画线,所画之处显红色,其化学原理为
(用化学方程式表示),该反应的基本类型为 。
14.某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计的流程如图2所示。
图2
(1)过滤操作中用到的所有玻璃仪器为 。
(2)Ⅰ中有关反应的化学方程式为 。
(3)溶液B中所含的溶质是 ;固体A的成分是 。(均填化学式)
(4)Ⅱ中加入过量的稀硫酸的目的是 。
三、计算题
15.[2020·湘西州改编] 向一定量的稀硫酸中加入锌粉(仅含不溶于酸的杂质),所加锌粉的质量与产生气体的质量的关系如图3所示。求:
(1)最终产生氢气的质量是 g。
(2)锌粉中锌的质量分数。(请写出计算过程)
图3
【能力提升】
16.[2020·巴中] 向5.6 g含两种杂质的铁粉样品中加入足量稀盐酸,充分反应后共产生0.2 g氢气,则该样品中所含的杂质可能是 ( )
A.锌和铜 B.锌和镁 C.铝和镁 D.碳和铜
17.[2020·潍坊改编] 将质量相等的Mg、Al、Zn三种金属分别放入质量和浓度均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系不可能的是 ( )
图4
18.[2021·济宁改编] 一定质量M、N两种金属,分别与相同质量和相同浓度的稀硫酸反应,生成氢气的质量与反应时间的关系如图5所示。分析图像得到的以下结论中,不正确的是( )
图5
A.产生氢气的速率:M>N B.两种金属生成氢气的质量:M=N
C.两种金属消耗稀硫酸的质量:M=N D.充分反应后,得到溶液的质量:M=N
19.[2021·陕西节选] 金属的发现与使用历史体现了人们对其性质的认识和科技发展的水平。
(1)2021年3月,三星堆遗址再次出土的文物中,黄金面具残片最为引人瞩目,其历经三千年依旧金光灿灿,这是因为金的化学性质非常 。
(2)唐宋时期流行的“湿法炼铜”的原理是铁和硫酸铜溶液的反应,该反应的化学方程式为 。
答案
1.D
2.D [解析] 铜丝、铁丝在空气中不能燃烧;铜与稀硫酸不反应,故溶液颜色不变。
3.D [解析] 这种特殊的铜纳米颗粒具有与金、银极其相似的反应惰性,则其不能与盐酸反应,在空气中不容易锈蚀;在金属活动性顺序中,铜排在铁的后面,不能与硫酸亚铁发生置换反应;可替代黄金制作精密电子元器件,说明该铜纳米颗粒具有良好的导电性。
4.A
5.A [解析] 手机的某些部件中含有Mg、Al、Cu等金属,将废旧手机的部件粉碎并浸入足量稀硫酸中充分反应,Cu不能与稀硫酸反应,Mg、Al能与稀硫酸反应,生成硫酸镁和氢气、硫酸铝和氢气,则所得溶液中含有的金属离子是镁离子和铝离子,其离子符号为Mg2+、Al3+。
6.C
7.D [解析] 反应的化学方程式及其质量关系:
Zn+2HClZnCl2+H2↑
65 73
Mg+2HClMgCl2+H2↑
24 73
2Al+6HCl2AlCl3+3H2↑
54 219
由以上质量关系可知,等质量的Zn、Mg、Al分别与足量稀盐酸反应,消耗酸的质量关系是Al>Mg>Zn。
8.D [解析] 铁与硫酸铜反应生成硫酸亚铁和铜,每56份质量的铁可置换出64份质量的铜,溶液的质量会减少;铁与硫酸铜反应生成硫酸亚铁和铜,溶液由蓝色变成浅绿色;铁与硫酸铜反应生成硫酸亚铁和铜,溶液中不会产生大量气泡;铁与硫酸铜反应生成硫酸亚铁和铜,铁丝表面有紫红色物质生成。
9.B [解析] 镁、铁与稀硫酸反应时,加入稀硫酸的质量相等,生成氢气的质量也相等,最终镁和稀硫酸反应生成的氢气多。
10.B
11.A [解析] 铁和稀盐酸反应生成的是FeCl2,不是FeCl3。
12.D [解析] 由于在金属活动性顺序中,铁的活动性比铜强,比镁弱,因此铁可以和铜的化合物溶液反应,但不能和镁的化合物溶液反应;由于铁和氯化铜溶液反应生成金属铜和氯化亚铁,因此得到的固体是生成的金属铜和过量的铁。
13.废酸液会腐蚀铁制管道
Fe+CuSO4FeSO4+Cu 置换反应
14.(1)漏斗、玻璃棒、烧杯
(2)Fe+CuSO4FeSO4+Cu
(3)Al2(SO4)3、FeSO4 Cu、Fe
(4)使铁完全反应,回收金属铜(合理即可)
15.(1)0.8
(2)解:设32.5 g锌粉中锌的质量为x。
Zn+H2SO4ZnSO4+H2↑
65 2
x 0.8 g
= x=26 g
锌粉中锌的质量分数为×100%=80%。
答:锌粉中锌的质量分数为80%。
16.B [解析] 设5.6 g纯铁与盐酸反应生成氢气的质量为x。
Fe+2HClFeCl2+H2↑
56 2
5.6 g x
= x=0.2 g
铜与稀盐酸不反应,等质量的锌和铁分别与足量的稀盐酸反应时,锌产生的氢气少于铁产生的氢气,若向5.6 g含铜、锌两种杂质的铁粉样品中加入足量稀盐酸,充分反应后产生氢气的质量小于0.2 g;等质量的镁和铁中分别加入足量稀盐酸,镁产生的氢气多于铁产生的氢气,若向5.6 g含镁、锌两种杂质的铁粉样品中加入足量稀盐酸,充分反应后产生氢气的质量可能为0.2 g;等质量的镁和铝分别与足量的稀盐酸反应时,产生的氢气均比等质量的铁与稀盐酸反应产生的氢气多,若向5.6 g含镁、铝两种杂质的铁粉样品中加入足量稀盐酸,充分反应后产生氢气的质量大于0.2 g;碳和铜均不与稀盐酸反应,若向5.6 g含铜、碳两种杂质的铁粉样品中加入足量的稀盐酸,充分反应后产生氢气的质量小于0.2 g。
17.C [解析] 如果稀硫酸量不足,则生成氢气的质量取决于硫酸,即稀硫酸不足时生成氢气质量相等;如果稀硫酸都过量,生成氢气质量决定于金属单质,镁、铝、锌与稀硫酸反应的化学方程式及其质量关系:
Mg+H2SO4MgSO4+H2↑
24 98 2
2Al+3H2SO4Al2(SO4)3+3H2↑
54 294 6
Zn+H2SO4ZnSO4+H2↑
65 98 2
由以上质量关系可知,等质量的金属单质完全反应时,铝反应生成氢气质量最大,锌反应生成氢气质量最小;无论金属单质质量、稀硫酸质量是多少,不会出现铝反应生成氢气质量最多,镁和锌反应生成氢气质量相等的情况。
18.D [解析] 由于两种金属的相对原子质量大小不能确定,充分反应后,得到溶液的质量也无法比较。
19.(1)稳定
(2)Fe+CuSO4FeSO4+Cu
一、选择题
1.黄金是一种贵重金属,它不仅被视为美好和富有的象征,还可以利用其特有的价值造福于人类。“真金不怕火炼”主要是指金 ( )
A.熔点高 B.延展性好
C.有金属光泽 D.化学性质稳定
2.下列关于金属的化学性质的探究中,叙述与事实相符的是 ( )
A.铜丝在空气中燃烧,生成黑色固体
B.细铁丝在空气中剧烈燃烧、火星四射
C.铜丝插入稀硫酸中,溶液由无色变为蓝色
D.分别向盛有镁条和铁钉的试管中滴加稀硫酸,均有气泡产生,且镁条反应剧烈
3.[2021·福建] 据文献报道:一种特殊的铜纳米颗粒具有与金、银极其相似的反应惰性,可替代黄金制作精密电子元器件。下列对该铜纳米颗粒的判断,正确的是 ( )
A.能与盐酸反应产生氢气 B.在空气中容易锈蚀
C.能与硫酸亚铁发生置换反应 D.具有良好的导电性
4.[2020·北京] 下列不能与稀盐酸反应的金属是( )
A.Cu B.Zn
C.Al D.Mg
5.[2020·淄博改编] 手机的某些部件中含有Mg、Al、Cu等金属,将废旧手机的部件粉碎并浸入足量稀硫酸中充分反应,反应后所得溶液中含有的金属离子是 ( )
A.Mg2+、Al3+ B.Mg2+、Cu2+
C.Al3+、Cu2+ D.Mg2+、Al3+、Cu2+
6.芯片是电脑、“智能”家电等的核心部件,它是用高纯度硅制成的。下面是生产单质硅的过程中的一个重要反应:SiO2+2CSi+2CO↑,该反应的基本类型是( )
A.化合反应 B.分解反应
C.置换反应 D.都不是
7.等质量的Zn、Mg、Al分别与足量稀盐酸反应,消耗酸的质量的关系是 ( )
A.Zn=Mg=Al B.Zn>Mg>Al
C.Al>Zn>Mg D.Al>Mg>Zn
8.[2020·永州改编] 将用砂纸打磨后的铁丝插入CuSO4溶液中,一段时间后,观察现象。下列叙述正确的是 ( )
A.溶液质量增加
B.溶液由蓝色变成无色
C.溶液中产生大量气泡
D.铁丝表面有紫红色物质生成
9.向质量相等的镁粉和铁粉中分别加入等质量、等浓度的稀硫酸,所得H2与稀硫酸的质量关系图像正确的是 ( )
图1
10.下列化学方程式中属于置换反应的是 ( )
A.S+O2SO2
B.Zn+H2SO4ZnSO4+H2↑
C.CaCO3+2HClCaCl2+CO2↑+H2O
D.2KMnO4K2MnO4+MnO2+O2↑
11.下列物质不能由金属直接与稀盐酸反应制得的是 ( )
A.FeCl3 B.MgCl2 C.FeCl2 D.ZnCl2
12.在CuCl2和MgCl2的混合溶液中,加入过量的铁粉,充分反应后过滤,所得固体为 ( )
A.Mg B.Cu C.Fe和Mg D.Fe和Cu
二、填空题
13.实验室的废酸液不能直接倒入铁制下水道,是因为 ;工厂师傅在切割钢板时,常用硫酸铜溶液画线,所画之处显红色,其化学原理为
(用化学方程式表示),该反应的基本类型为 。
14.某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计的流程如图2所示。
图2
(1)过滤操作中用到的所有玻璃仪器为 。
(2)Ⅰ中有关反应的化学方程式为 。
(3)溶液B中所含的溶质是 ;固体A的成分是 。(均填化学式)
(4)Ⅱ中加入过量的稀硫酸的目的是 。
三、计算题
15.[2020·湘西州改编] 向一定量的稀硫酸中加入锌粉(仅含不溶于酸的杂质),所加锌粉的质量与产生气体的质量的关系如图3所示。求:
(1)最终产生氢气的质量是 g。
(2)锌粉中锌的质量分数。(请写出计算过程)
图3
【能力提升】
16.[2020·巴中] 向5.6 g含两种杂质的铁粉样品中加入足量稀盐酸,充分反应后共产生0.2 g氢气,则该样品中所含的杂质可能是 ( )
A.锌和铜 B.锌和镁 C.铝和镁 D.碳和铜
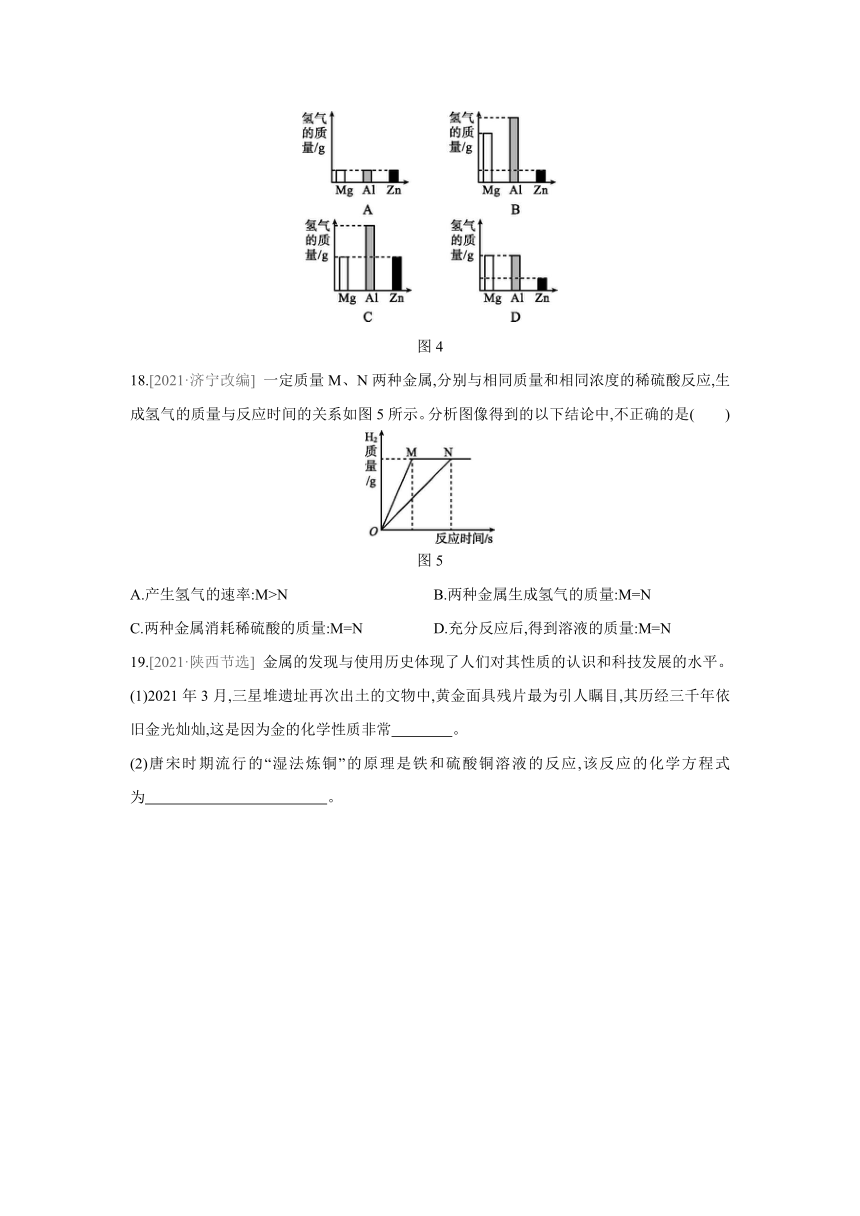
17.[2020·潍坊改编] 将质量相等的Mg、Al、Zn三种金属分别放入质量和浓度均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系不可能的是 ( )
图4
18.[2021·济宁改编] 一定质量M、N两种金属,分别与相同质量和相同浓度的稀硫酸反应,生成氢气的质量与反应时间的关系如图5所示。分析图像得到的以下结论中,不正确的是( )
图5
A.产生氢气的速率:M>N B.两种金属生成氢气的质量:M=N
C.两种金属消耗稀硫酸的质量:M=N D.充分反应后,得到溶液的质量:M=N
19.[2021·陕西节选] 金属的发现与使用历史体现了人们对其性质的认识和科技发展的水平。
(1)2021年3月,三星堆遗址再次出土的文物中,黄金面具残片最为引人瞩目,其历经三千年依旧金光灿灿,这是因为金的化学性质非常 。
(2)唐宋时期流行的“湿法炼铜”的原理是铁和硫酸铜溶液的反应,该反应的化学方程式为 。
答案
1.D
2.D [解析] 铜丝、铁丝在空气中不能燃烧;铜与稀硫酸不反应,故溶液颜色不变。
3.D [解析] 这种特殊的铜纳米颗粒具有与金、银极其相似的反应惰性,则其不能与盐酸反应,在空气中不容易锈蚀;在金属活动性顺序中,铜排在铁的后面,不能与硫酸亚铁发生置换反应;可替代黄金制作精密电子元器件,说明该铜纳米颗粒具有良好的导电性。
4.A
5.A [解析] 手机的某些部件中含有Mg、Al、Cu等金属,将废旧手机的部件粉碎并浸入足量稀硫酸中充分反应,Cu不能与稀硫酸反应,Mg、Al能与稀硫酸反应,生成硫酸镁和氢气、硫酸铝和氢气,则所得溶液中含有的金属离子是镁离子和铝离子,其离子符号为Mg2+、Al3+。
6.C
7.D [解析] 反应的化学方程式及其质量关系:
Zn+2HClZnCl2+H2↑
65 73
Mg+2HClMgCl2+H2↑
24 73
2Al+6HCl2AlCl3+3H2↑
54 219
由以上质量关系可知,等质量的Zn、Mg、Al分别与足量稀盐酸反应,消耗酸的质量关系是Al>Mg>Zn。
8.D [解析] 铁与硫酸铜反应生成硫酸亚铁和铜,每56份质量的铁可置换出64份质量的铜,溶液的质量会减少;铁与硫酸铜反应生成硫酸亚铁和铜,溶液由蓝色变成浅绿色;铁与硫酸铜反应生成硫酸亚铁和铜,溶液中不会产生大量气泡;铁与硫酸铜反应生成硫酸亚铁和铜,铁丝表面有紫红色物质生成。
9.B [解析] 镁、铁与稀硫酸反应时,加入稀硫酸的质量相等,生成氢气的质量也相等,最终镁和稀硫酸反应生成的氢气多。
10.B
11.A [解析] 铁和稀盐酸反应生成的是FeCl2,不是FeCl3。
12.D [解析] 由于在金属活动性顺序中,铁的活动性比铜强,比镁弱,因此铁可以和铜的化合物溶液反应,但不能和镁的化合物溶液反应;由于铁和氯化铜溶液反应生成金属铜和氯化亚铁,因此得到的固体是生成的金属铜和过量的铁。
13.废酸液会腐蚀铁制管道
Fe+CuSO4FeSO4+Cu 置换反应
14.(1)漏斗、玻璃棒、烧杯
(2)Fe+CuSO4FeSO4+Cu
(3)Al2(SO4)3、FeSO4 Cu、Fe
(4)使铁完全反应,回收金属铜(合理即可)
15.(1)0.8
(2)解:设32.5 g锌粉中锌的质量为x。
Zn+H2SO4ZnSO4+H2↑
65 2
x 0.8 g
= x=26 g
锌粉中锌的质量分数为×100%=80%。
答:锌粉中锌的质量分数为80%。
16.B [解析] 设5.6 g纯铁与盐酸反应生成氢气的质量为x。
Fe+2HClFeCl2+H2↑
56 2
5.6 g x
= x=0.2 g
铜与稀盐酸不反应,等质量的锌和铁分别与足量的稀盐酸反应时,锌产生的氢气少于铁产生的氢气,若向5.6 g含铜、锌两种杂质的铁粉样品中加入足量稀盐酸,充分反应后产生氢气的质量小于0.2 g;等质量的镁和铁中分别加入足量稀盐酸,镁产生的氢气多于铁产生的氢气,若向5.6 g含镁、锌两种杂质的铁粉样品中加入足量稀盐酸,充分反应后产生氢气的质量可能为0.2 g;等质量的镁和铝分别与足量的稀盐酸反应时,产生的氢气均比等质量的铁与稀盐酸反应产生的氢气多,若向5.6 g含镁、铝两种杂质的铁粉样品中加入足量稀盐酸,充分反应后产生氢气的质量大于0.2 g;碳和铜均不与稀盐酸反应,若向5.6 g含铜、碳两种杂质的铁粉样品中加入足量的稀盐酸,充分反应后产生氢气的质量小于0.2 g。
17.C [解析] 如果稀硫酸量不足,则生成氢气的质量取决于硫酸,即稀硫酸不足时生成氢气质量相等;如果稀硫酸都过量,生成氢气质量决定于金属单质,镁、铝、锌与稀硫酸反应的化学方程式及其质量关系:
Mg+H2SO4MgSO4+H2↑
24 98 2
2Al+3H2SO4Al2(SO4)3+3H2↑
54 294 6
Zn+H2SO4ZnSO4+H2↑
65 98 2
由以上质量关系可知,等质量的金属单质完全反应时,铝反应生成氢气质量最大,锌反应生成氢气质量最小;无论金属单质质量、稀硫酸质量是多少,不会出现铝反应生成氢气质量最多,镁和锌反应生成氢气质量相等的情况。
18.D [解析] 由于两种金属的相对原子质量大小不能确定,充分反应后,得到溶液的质量也无法比较。
19.(1)稳定
(2)Fe+CuSO4FeSO4+Cu
