内蒙古巴彦淖尔市临河区第三中学2021-2022学年高二上学期期中考试化学试卷(含答案)
文档属性
| 名称 | 内蒙古巴彦淖尔市临河区第三中学2021-2022学年高二上学期期中考试化学试卷(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 732.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-24 21:21:11 | ||
图片预览


文档简介
临河三中2021~2022学年第一学期期中考试
高二(化学)试卷
试卷总分:100分 考试时间:70分钟
姓名 班级 考号
注意事项:1.答卷前,务必将自己的姓名、准考证号等填写在试卷和答题卡上,并正确粘贴条形码。
2.选择题答案用2B铅笔把答题卡对应题目的答案标号涂黑。非选择题用0.5毫米黑色字迹笔将答案写在答题卡指定位置。在试卷上答题无效。
3.考试结束后,只交答题卡,试卷自己保留,以备讲评使用。
可能用到的相对原子量Cu :64 S: 32 O :16
第Ⅰ卷(共50分)
一、选择题:本题共20小题,每小题2.5分,共50分。在每小题给出的四个选项中,只有一项是符合题目要求的。
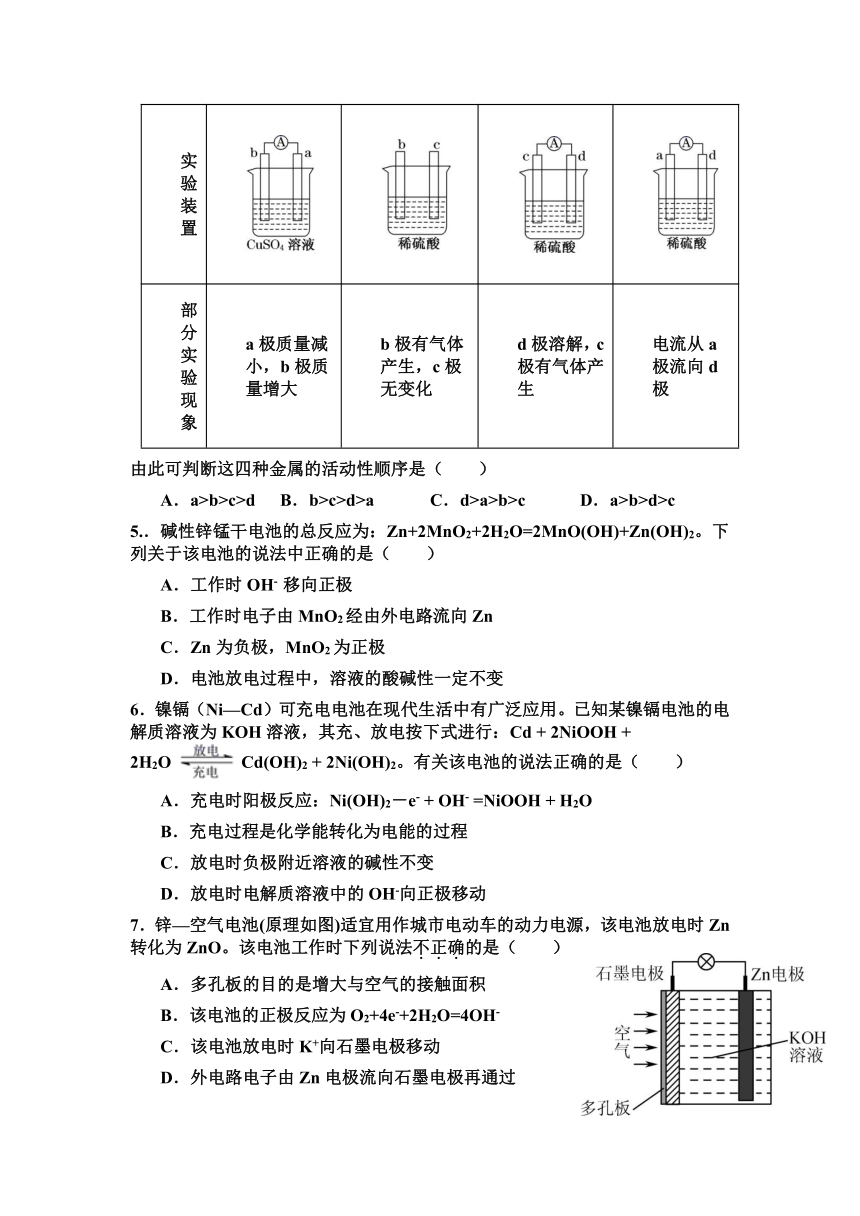
1.下列装置中能组成原电池的是( )
A. B. C. D.
2.下列关于原电池的叙述中错误的是( )
A.原电池内部的阳离子向正极移动
B.原电池是将化学能转变为电能的装置
C.在原电池中,电子流入的一极是正极,发生还原反应
D.构成原电池的正极和负极必须是两种不同的金属
3.右图所示的原电池工作时,下列说法错误的是( )
A.Zn为负极
B.负极反应式为Zn―2e-=Zn2+
C.溶液的PH逐渐变小
D.外电路中电子从Zn流向Cu
4.有a、b、c、d四种金属电极,有关的实验装置及部分实验现象如下:
实验装置
部分实验现象 a极质量减小,b极质量增大 b极有气体产生,c极无变化 d极溶解,c极有气体产生 电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
5..碱性锌锰干电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。下列关于该电池的说法中正确的是( )
A.工作时OH- 移向正极
B.工作时电子由MnO2经由外电路流向Zn
C.Zn为负极,MnO2为正极
D.电池放电过程中,溶液的酸碱性一定不变
6.镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2OCd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2-e- + OH- =NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
7.锌—空气电池(原理如图)适宜用作城市电动车的动力电源,该电池放电时Zn转化为ZnO。该电池工作时下列说法不正确的是( )
A.多孔板的目的是增大与空气的接触面积
B.该电池的正极反应为O2+4e-+2H2O=4OH-
C.该电池放电时K+向石墨电极移动
D.外电路电子由Zn电极流向石墨电极再通过
电解质溶液流回Zn电极
8.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极),下列叙述正确的是( )
A.a电极是负极,OH-移向正极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.燃料电池中电解质溶液的pH保持不变
D.d电极有气体放出
9.下列有关电解的说法错误的是( )
A.与电源正极相连的是阳极
B.与电源负极相连的是阴极
C.在阴极上发生氧化反应
D.阴离子向阳极方向移动
10.如图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列判断正确的是( )
A.a为负极、b为正极
B.电解过程中,c电极上发生氧化反应
C.d为阳极,电极反应为:2Cl-―2e-=Cl2↑
D.电解过程中,化学能转化为电能
11.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的负极反应式:Fe-3e-=Fe3+
12.粗铜中含有Fe、Zn、Ni等杂质,用下图装置精炼铜。下列有关说法正确的是( )
A.a是粗铜、b是纯铜
B.反应前后CuSO4电解液的浓度保持不变
C.阴极电极反应为:Cu2++2e-=Cu
D.电解过程中,a、b两极质量的变化量一直相等
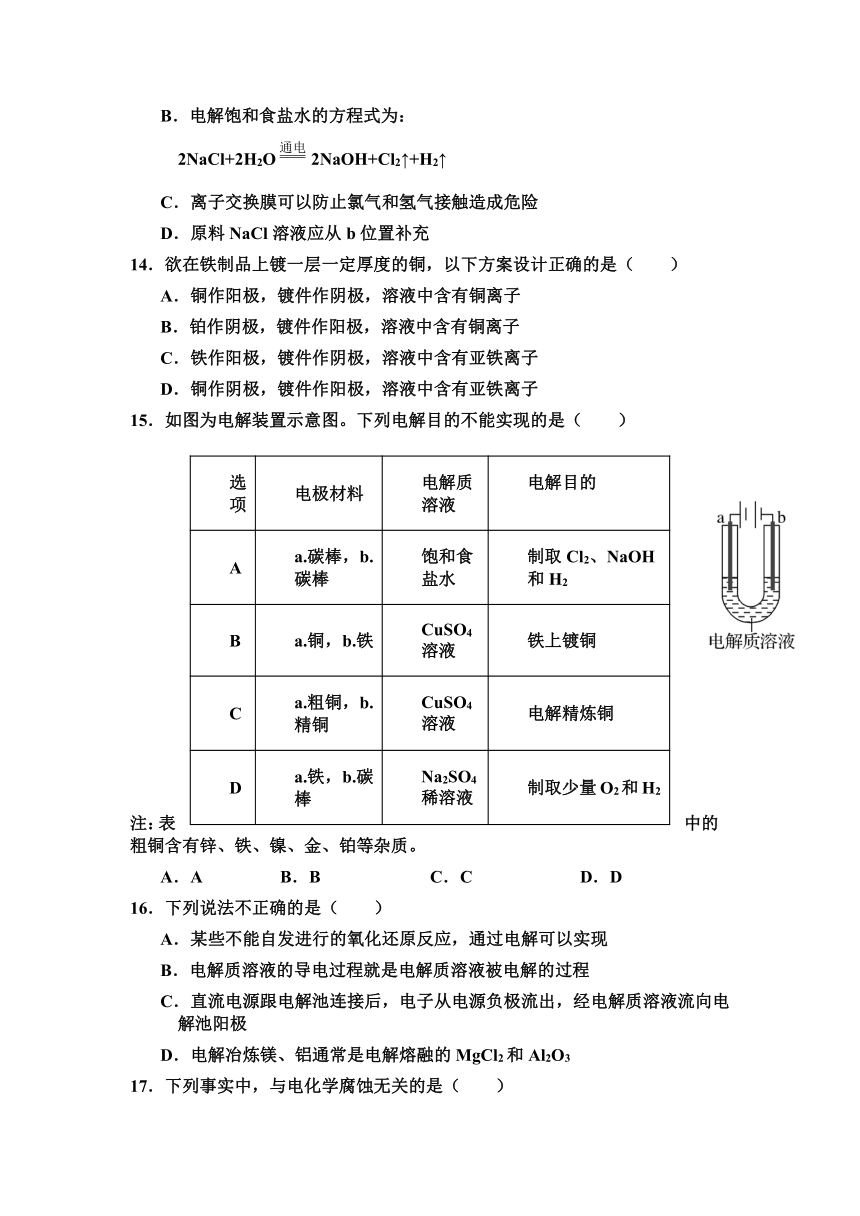
13.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。下列说法错误的是( )
A.产生氢气的一极为阴极
B.电解饱和食盐水的方程式为:
2NaCl+2H2O2NaOH+Cl2↑+H2↑
C.离子交换膜可以防止氯气和氢气接触造成危险
D.原料NaCl溶液应从b位置补充
14.欲在铁制品上镀一层一定厚度的铜,以下方案设计正确的是( )
A.铜作阳极,镀件作阴极,溶液中含有铜离子
B.铂作阴极,镀件作阳极,溶液中含有铜离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.铜作阴极,镀件作阳极,溶液中含有亚铁离子
15.如图为电解装置示意图。下列电解目的不能实现的是( )
选项 电极材料 电解质溶液 电解目的
A a.碳棒,b.碳棒 饱和食盐水 制取Cl2、NaOH和H2
B a.铜,b.铁 CuSO4溶液 铁上镀铜
C a.粗铜,b.精铜 CuSO4溶液 电解精炼铜
D a.铁,b.碳棒 Na2SO4稀溶液 制取少量O2和H2
注:表中的粗铜含有锌、铁、镍、金、铂等杂质。
A.A B.B C.C D.D
16.下列说法不正确的是( )
A.某些不能自发进行的氧化还原反应,通过电解可以实现
B.电解质溶液的导电过程就是电解质溶液被电解的过程
C.直流电源跟电解池连接后,电子从电源负极流出,经电解质溶液流向电解池阳极
D.电解冶炼镁、铝通常是电解熔融的MgCl2和Al2O3
17.下列事实中,与电化学腐蚀无关的是( )
A.用铜质铆钉铆接铁板,铁板易被腐蚀
B.在空气中,银器表面会生成一层黑色的物质
C.在远洋海轮的船体吃水线以下焊上一定数量的锌板
D.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更容易被腐蚀
18.下列关于钢铁腐蚀的说法错误的是( )
A.在钢铁制品中加入一些铬或镍制成合金,可有效防止金属腐蚀
B.自然界中,生铁比纯铁更易腐蚀
C.钢铁设备上连接铜块可以防止钢铁腐蚀
D.钢铁设备与外加直流电源的负极相连可以防止钢铁腐蚀
19.某小组为研究电化学原理,设计如图装置。下列叙述错误的是( )
A.a和b不连接时,铁片质量会增加
B.a和b用导线连接时,正极发生的电极反应为:
Cu2++2e-===Cu
C.无论a和b是否连接,铁片均被腐蚀
D.a和b分别连接电源正、负极时,Fe电极发生的电极反应为:
4OH--4e-===2H2O+O2↑
20.如图所示,甲池的总反应式为2CH3OH+3O2+4KOH= =2K2CO3+6H2O。下列说法正确的是( )
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应为CH3OH- 6e-+ 2H2O=CO32-+ 8H+
C.甲池中消耗560 mL(标准状况下) O2,此时乙池中银极增重3.2g
D.反应一段时间后,向丙池中加入一定量盐酸,一定能使MgCl2溶液恢复到原浓度
第Ⅱ卷(共50分)
二、非选择题:本题共3道题,共50分。
21.(16分,每空2分)某学生利用下面实验装置探究盐桥式原电池的工作原理。
按照实验步骤依次回答下列问题:
(1)锌电极为电池的 极,电极上发生的是 反应(“氧化”或“还原”),电极反应式为 。
(2)导线中电子流向为 (用a、b 表示)。
(3)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+,Cl-的移动方向描述正确的是 。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向右侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B.Zn C.Fe D.H2SO4
(6)反应一段时间后右侧烧杯中Cu2+浓度是 (填增大, 减小或不变)
22.(20分,每空2分)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4(甲烷)和O2 ,电解质为KOH溶液。已知燃料电池总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
回答下列问题:
(1)闭合K开关后图中甲、乙两池的名称(请填原电池或电解池)。
甲池是: 装置,丙池是: 装置。
(2)闭合K开关后通入甲烷(CH4)的电极名称是 ,丙池中a电极的名称是 ,甲烷燃料电池中正极的电极反应式为 ,负极的电极反应式为 。
(3)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电极反应式为 ;
a电极电极反应式为 ,检验该电极反应产物的方法是 。
23.(14分,每空2分)铅蓄电池的总反应式为Pb+PbO2+2H2SO42PbSO4+2H2O,请回答下列问题:
放电时,正极的材料是 ;电解液中H2SO4浓度将变 (填“大”或“小”);电流方向从 (填“正”或“负”,下同)极流向 极。当外电路通过1mol电子时,理论上负极板的质量增加 g。
(2)充电时Pb为 极,Pb电极上的电极反应式为 。
高二期中化学答案
一、选择题共50分:
A 2.D 3.C 4.C 5.C 6.A 7.D 8.B 9.C 10.B
11.A 12.C 13.D 14.A 15.D 16.C 17.B 18.C 19.D 20.C
二、非选择题:本题共4道题,共50分。
21.(16分)(1)负 氧化 Zn-2e-=Zn2+ (2)a到b(3) 1.204×1022 或0.02NA (4)B (5) B (6) 减小
22.(20分)
(1)原电池 电解池
(2)负极 阳极 2H2O+O2+4e-=4OH-
CH4+10OH--8e—=CO32-+ 7H2O
(3)H2 2H2O+2e-=2OH-+H2↑ 2Cl-―2e-=Cl2↑
用湿润的淀粉KI试纸放在a极附近,试纸变蓝
23(14分)
(1) PbO2 小 正 负 48
(2) 阴极 PbSO4+2e-=Pb+SO42-
高二(化学)试卷
试卷总分:100分 考试时间:70分钟
姓名 班级 考号
注意事项:1.答卷前,务必将自己的姓名、准考证号等填写在试卷和答题卡上,并正确粘贴条形码。
2.选择题答案用2B铅笔把答题卡对应题目的答案标号涂黑。非选择题用0.5毫米黑色字迹笔将答案写在答题卡指定位置。在试卷上答题无效。
3.考试结束后,只交答题卡,试卷自己保留,以备讲评使用。
可能用到的相对原子量Cu :64 S: 32 O :16
第Ⅰ卷(共50分)
一、选择题:本题共20小题,每小题2.5分,共50分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列装置中能组成原电池的是( )
A. B. C. D.
2.下列关于原电池的叙述中错误的是( )
A.原电池内部的阳离子向正极移动
B.原电池是将化学能转变为电能的装置
C.在原电池中,电子流入的一极是正极,发生还原反应
D.构成原电池的正极和负极必须是两种不同的金属
3.右图所示的原电池工作时,下列说法错误的是( )
A.Zn为负极
B.负极反应式为Zn―2e-=Zn2+
C.溶液的PH逐渐变小
D.外电路中电子从Zn流向Cu
4.有a、b、c、d四种金属电极,有关的实验装置及部分实验现象如下:
实验装置
部分实验现象 a极质量减小,b极质量增大 b极有气体产生,c极无变化 d极溶解,c极有气体产生 电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
5..碱性锌锰干电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。下列关于该电池的说法中正确的是( )
A.工作时OH- 移向正极
B.工作时电子由MnO2经由外电路流向Zn
C.Zn为负极,MnO2为正极
D.电池放电过程中,溶液的酸碱性一定不变
6.镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2OCd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2-e- + OH- =NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
7.锌—空气电池(原理如图)适宜用作城市电动车的动力电源,该电池放电时Zn转化为ZnO。该电池工作时下列说法不正确的是( )
A.多孔板的目的是增大与空气的接触面积
B.该电池的正极反应为O2+4e-+2H2O=4OH-
C.该电池放电时K+向石墨电极移动
D.外电路电子由Zn电极流向石墨电极再通过
电解质溶液流回Zn电极
8.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极),下列叙述正确的是( )
A.a电极是负极,OH-移向正极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.燃料电池中电解质溶液的pH保持不变
D.d电极有气体放出
9.下列有关电解的说法错误的是( )
A.与电源正极相连的是阳极
B.与电源负极相连的是阴极
C.在阴极上发生氧化反应
D.阴离子向阳极方向移动
10.如图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列判断正确的是( )
A.a为负极、b为正极
B.电解过程中,c电极上发生氧化反应
C.d为阳极,电极反应为:2Cl-―2e-=Cl2↑
D.电解过程中,化学能转化为电能
11.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的负极反应式:Fe-3e-=Fe3+
12.粗铜中含有Fe、Zn、Ni等杂质,用下图装置精炼铜。下列有关说法正确的是( )
A.a是粗铜、b是纯铜
B.反应前后CuSO4电解液的浓度保持不变
C.阴极电极反应为:Cu2++2e-=Cu
D.电解过程中,a、b两极质量的变化量一直相等
13.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。下列说法错误的是( )
A.产生氢气的一极为阴极
B.电解饱和食盐水的方程式为:
2NaCl+2H2O2NaOH+Cl2↑+H2↑
C.离子交换膜可以防止氯气和氢气接触造成危险
D.原料NaCl溶液应从b位置补充
14.欲在铁制品上镀一层一定厚度的铜,以下方案设计正确的是( )
A.铜作阳极,镀件作阴极,溶液中含有铜离子
B.铂作阴极,镀件作阳极,溶液中含有铜离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.铜作阴极,镀件作阳极,溶液中含有亚铁离子
15.如图为电解装置示意图。下列电解目的不能实现的是( )
选项 电极材料 电解质溶液 电解目的
A a.碳棒,b.碳棒 饱和食盐水 制取Cl2、NaOH和H2
B a.铜,b.铁 CuSO4溶液 铁上镀铜
C a.粗铜,b.精铜 CuSO4溶液 电解精炼铜
D a.铁,b.碳棒 Na2SO4稀溶液 制取少量O2和H2
注:表中的粗铜含有锌、铁、镍、金、铂等杂质。
A.A B.B C.C D.D
16.下列说法不正确的是( )
A.某些不能自发进行的氧化还原反应,通过电解可以实现
B.电解质溶液的导电过程就是电解质溶液被电解的过程
C.直流电源跟电解池连接后,电子从电源负极流出,经电解质溶液流向电解池阳极
D.电解冶炼镁、铝通常是电解熔融的MgCl2和Al2O3
17.下列事实中,与电化学腐蚀无关的是( )
A.用铜质铆钉铆接铁板,铁板易被腐蚀
B.在空气中,银器表面会生成一层黑色的物质
C.在远洋海轮的船体吃水线以下焊上一定数量的锌板
D.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更容易被腐蚀
18.下列关于钢铁腐蚀的说法错误的是( )
A.在钢铁制品中加入一些铬或镍制成合金,可有效防止金属腐蚀
B.自然界中,生铁比纯铁更易腐蚀
C.钢铁设备上连接铜块可以防止钢铁腐蚀
D.钢铁设备与外加直流电源的负极相连可以防止钢铁腐蚀
19.某小组为研究电化学原理,设计如图装置。下列叙述错误的是( )
A.a和b不连接时,铁片质量会增加
B.a和b用导线连接时,正极发生的电极反应为:
Cu2++2e-===Cu
C.无论a和b是否连接,铁片均被腐蚀
D.a和b分别连接电源正、负极时,Fe电极发生的电极反应为:
4OH--4e-===2H2O+O2↑
20.如图所示,甲池的总反应式为2CH3OH+3O2+4KOH= =2K2CO3+6H2O。下列说法正确的是( )
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应为CH3OH- 6e-+ 2H2O=CO32-+ 8H+
C.甲池中消耗560 mL(标准状况下) O2,此时乙池中银极增重3.2g
D.反应一段时间后,向丙池中加入一定量盐酸,一定能使MgCl2溶液恢复到原浓度
第Ⅱ卷(共50分)
二、非选择题:本题共3道题,共50分。
21.(16分,每空2分)某学生利用下面实验装置探究盐桥式原电池的工作原理。
按照实验步骤依次回答下列问题:
(1)锌电极为电池的 极,电极上发生的是 反应(“氧化”或“还原”),电极反应式为 。
(2)导线中电子流向为 (用a、b 表示)。
(3)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+,Cl-的移动方向描述正确的是 。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向右侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B.Zn C.Fe D.H2SO4
(6)反应一段时间后右侧烧杯中Cu2+浓度是 (填增大, 减小或不变)
22.(20分,每空2分)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4(甲烷)和O2 ,电解质为KOH溶液。已知燃料电池总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
回答下列问题:
(1)闭合K开关后图中甲、乙两池的名称(请填原电池或电解池)。
甲池是: 装置,丙池是: 装置。
(2)闭合K开关后通入甲烷(CH4)的电极名称是 ,丙池中a电极的名称是 ,甲烷燃料电池中正极的电极反应式为 ,负极的电极反应式为 。
(3)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电极反应式为 ;
a电极电极反应式为 ,检验该电极反应产物的方法是 。
23.(14分,每空2分)铅蓄电池的总反应式为Pb+PbO2+2H2SO42PbSO4+2H2O,请回答下列问题:
放电时,正极的材料是 ;电解液中H2SO4浓度将变 (填“大”或“小”);电流方向从 (填“正”或“负”,下同)极流向 极。当外电路通过1mol电子时,理论上负极板的质量增加 g。
(2)充电时Pb为 极,Pb电极上的电极反应式为 。
高二期中化学答案
一、选择题共50分:
A 2.D 3.C 4.C 5.C 6.A 7.D 8.B 9.C 10.B
11.A 12.C 13.D 14.A 15.D 16.C 17.B 18.C 19.D 20.C
二、非选择题:本题共4道题,共50分。
21.(16分)(1)负 氧化 Zn-2e-=Zn2+ (2)a到b(3) 1.204×1022 或0.02NA (4)B (5) B (6) 减小
22.(20分)
(1)原电池 电解池
(2)负极 阳极 2H2O+O2+4e-=4OH-
CH4+10OH--8e—=CO32-+ 7H2O
(3)H2 2H2O+2e-=2OH-+H2↑ 2Cl-―2e-=Cl2↑
用湿润的淀粉KI试纸放在a极附近,试纸变蓝
23(14分)
(1) PbO2 小 正 负 48
(2) 阴极 PbSO4+2e-=Pb+SO42-
同课章节目录
