7.3溶液浓稀的表示(第2课时)同步练习--2020-2021学年九年级化学科粤版(2012)下册(word版 含解析)
文档属性
| 名称 | 7.3溶液浓稀的表示(第2课时)同步练习--2020-2021学年九年级化学科粤版(2012)下册(word版 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 179.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-23 09:05:48 | ||
图片预览

文档简介
7.3 第2课时 配制一定溶质质量分数的溶液
一、选择题
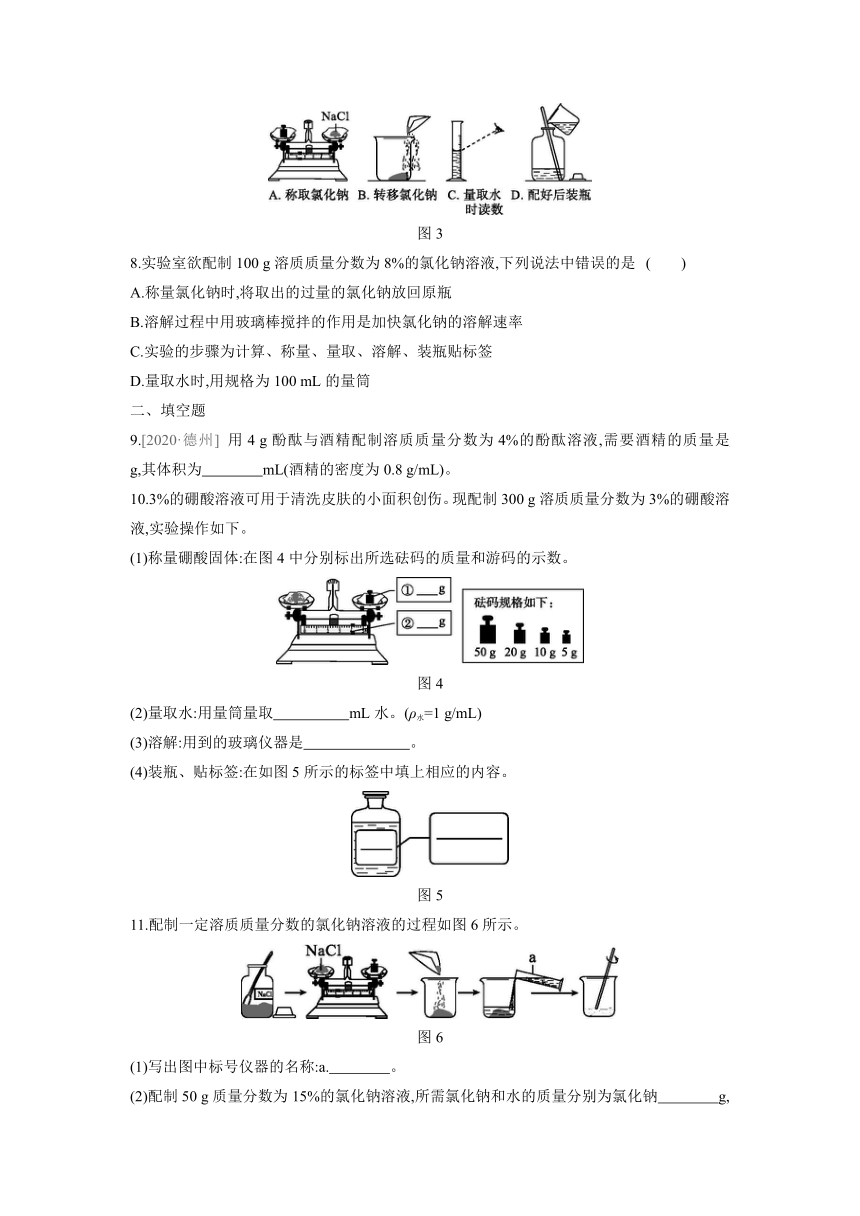
1.[2020·德州] 用氯化钠固体配制一定溶质质量分数的氯化钠溶液。下列仪器中不需要的是( )
图1
2.用浓盐酸配制一定溶质质量分数的稀盐酸,实验时必不可少的一组仪器是 ( )
A.量筒、烧杯、漏斗、玻璃棒 B.托盘天平、玻璃棒、药匙、烧杯
C.托盘天平、玻璃棒、量筒、烧杯 D.玻璃棒、量筒、烧杯、胶头滴管
3.下列配制溶液的操作顺序正确的是 ( )
图2
A.①②③④⑤⑥ B.⑤④②①③⑥
C.②①⑤④③⑥ D.⑤④③②①⑥
4.无土栽培所用的某种营养液中,硝酸钾的质量分数为7%,欲配制该营养液300 kg,需要硝酸钾的质量是 ( )
A.7 kg B.21 kg C.70 kg D.140 kg
5.在配制一定溶质质量分数的氯化钠溶液时,下列误差分析错误的是 ( )
A.称量氯化钠时,左盘放了纸片右盘没放纸片,溶质质量分数偏小
B.量取水时,俯视量筒内液面读数,溶质质量分数偏小
C.向烧杯内转移称量好的氯化钠时,有少量晶体撒落,溶质质量分数偏小
D.向试剂瓶内转移配制好的溶液时,有少量液体洒出,溶质质量分数不变
6.[2021·邵阳] 在2021年邵阳市化学实验操作考查中,小阳同学抽到的考题是“配制50 g质量分数为6%的氯化钠溶液”,小阳的实验操作与目的分析均正确的一组是 ( )
选项 实验操作 目的分析
A 称取氯化钠时,在两边托盘上各放一张相同的纸张 整洁美观
B 称取氯化钠时,将剩余的氯化钠放回原瓶 节约药品
C 量取水时,视线与量筒内凹液面的最低处保持水平 准确读数
D 溶解氯化钠时,用玻璃棒搅拌 增大氯化钠的溶解度
7.配制70 g 16%的NaCl溶液,下列操作会使所配制溶液的溶质质量分数大于16%的是( )
图3
8.实验室欲配制100 g溶质质量分数为8%的氯化钠溶液,下列说法中错误的是 ( )
A.称量氯化钠时,将取出的过量的氯化钠放回原瓶
B.溶解过程中用玻璃棒搅拌的作用是加快氯化钠的溶解速率
C.实验的步骤为计算、称量、量取、溶解、装瓶贴标签
D.量取水时,用规格为100 mL的量筒
二、填空题
9.[2020·德州] 用4 g酚酞与酒精配制溶质质量分数为4%的酚酞溶液,需要酒精的质量是 g,其体积为 mL(酒精的密度为0.8 g/mL)。
10.3%的硼酸溶液可用于清洗皮肤的小面积创伤。现配制300 g溶质质量分数为3%的硼酸溶液,实验操作如下。
(1)称量硼酸固体:在图4中分别标出所选砝码的质量和游码的示数。
图4
(2)量取水:用量筒量取 mL水。(ρ水=1 g/mL)
(3)溶解:用到的玻璃仪器是 。
(4)装瓶、贴标签:在如图5所示的标签中填上相应的内容。
图5
11.配制一定溶质质量分数的氯化钠溶液的过程如图6所示。
图6
(1)写出图中标号仪器的名称:a. 。
(2)配制50 g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为氯化钠 g,水 g。
(3)称量氯化钠时,氯化钠应放在托盘天平的 (填“左”或“右”)盘。
(4)溶解过程中玻璃棒的作用是 。
(5)对配制的溶液进行检测,发现其溶质质量分数偏小,原因可能有 (填字母)。
A.称量时,药品与砝码放反了
B.量取水时,仰视读数
C.装瓶时,有少量溶液洒出
(6)把50 g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是 g。
三、计算题
12.某同学在实验室进行有关浓硫酸的实验,观察到瓶上的标签如下表所示。他从瓶中倒出100 mL用于配制稀硫酸。求:
浓硫酸(H2SO4)500 mL
溶质的质量分数 98%
密度 1.84 g/cm3
相对分子质量 98
强腐蚀性,阴冷、密封储藏
(1)这100 mL浓硫酸的质量是多少克 其中含溶质多少克
(2)欲配制1000 g质量分数为19.6%的稀硫酸,需要多少毫升这种浓硫酸 多少毫升水
【能力提升】
13.[2020·岳阳] 某同学需要配制50 g质量分数为15%的氯化钠溶液,步骤如图7所示。下列分析正确的是 ( )
图7
A.配制过程中出现了两处操作错误
B.实验操作步骤为计算、称量、量取、蒸发
C.若所有操作都正确,完全溶解后有液滴溅出,会导致溶质的质量分数偏小
D.配制时应称量氯化钠固体的质量为7.0 g
14.如图8是甲、乙、丙三种固体物质的溶解度曲线,请根据图填空。
图8
(1)t3 ℃时,甲、乙、丙三种物质的溶解度由大到小的关系是 。
(2)t2 ℃时,乙物质的饱和溶液中溶质和溶剂的质量之比为 (填最简整数比)。
(3)欲配制相同质量分数的乙、丙的饱和溶液,应保持温度在 ℃。
(4)将t3 ℃时甲、乙、丙三种物质的饱和溶液各100 g,分别降温至t1 ℃,所得溶液质量由大到小的关系是 。
答案
1.A 2.D 3.D 4.B 5.B 6.C 7.C 8.A
9.96 120
10.(1)①5 ②4.0
(2)291
(3)烧杯、玻璃棒
(4)
11.(1)量筒 (2)7.5 42.5
(3)左
(4)搅拌,加快氯化钠溶解的速率
(5)AB (6)100
12.解:(1)100 mL=100 cm3。
由m=ρV,得100 mL浓硫酸的质量为1.84 g/cm3×100 cm3=184 g。其溶质的质量为184 g×98%=180.32 g。
(2)设需要这种浓硫酸的体积为v。
1000 g×19.6%=v×1.84 g/cm3×98%
v=108.7 cm3=108.7 mL
需要水的质量为1000 g-108.7 cm3×1.84 g/cm3=800 g,体积为800 mL。
答:(1)这100 mL浓硫酸的质量为184 g,其中含溶质180.32 g;(2)需要108.7 mL这种浓硫酸,800 mL水。
A
14.(1)甲>乙>丙
(2)1∶2 (3)t1
(4)丙>乙>甲
一、选择题
1.[2020·德州] 用氯化钠固体配制一定溶质质量分数的氯化钠溶液。下列仪器中不需要的是( )
图1
2.用浓盐酸配制一定溶质质量分数的稀盐酸,实验时必不可少的一组仪器是 ( )
A.量筒、烧杯、漏斗、玻璃棒 B.托盘天平、玻璃棒、药匙、烧杯
C.托盘天平、玻璃棒、量筒、烧杯 D.玻璃棒、量筒、烧杯、胶头滴管
3.下列配制溶液的操作顺序正确的是 ( )
图2
A.①②③④⑤⑥ B.⑤④②①③⑥
C.②①⑤④③⑥ D.⑤④③②①⑥
4.无土栽培所用的某种营养液中,硝酸钾的质量分数为7%,欲配制该营养液300 kg,需要硝酸钾的质量是 ( )
A.7 kg B.21 kg C.70 kg D.140 kg
5.在配制一定溶质质量分数的氯化钠溶液时,下列误差分析错误的是 ( )
A.称量氯化钠时,左盘放了纸片右盘没放纸片,溶质质量分数偏小
B.量取水时,俯视量筒内液面读数,溶质质量分数偏小
C.向烧杯内转移称量好的氯化钠时,有少量晶体撒落,溶质质量分数偏小
D.向试剂瓶内转移配制好的溶液时,有少量液体洒出,溶质质量分数不变
6.[2021·邵阳] 在2021年邵阳市化学实验操作考查中,小阳同学抽到的考题是“配制50 g质量分数为6%的氯化钠溶液”,小阳的实验操作与目的分析均正确的一组是 ( )
选项 实验操作 目的分析
A 称取氯化钠时,在两边托盘上各放一张相同的纸张 整洁美观
B 称取氯化钠时,将剩余的氯化钠放回原瓶 节约药品
C 量取水时,视线与量筒内凹液面的最低处保持水平 准确读数
D 溶解氯化钠时,用玻璃棒搅拌 增大氯化钠的溶解度
7.配制70 g 16%的NaCl溶液,下列操作会使所配制溶液的溶质质量分数大于16%的是( )
图3
8.实验室欲配制100 g溶质质量分数为8%的氯化钠溶液,下列说法中错误的是 ( )
A.称量氯化钠时,将取出的过量的氯化钠放回原瓶
B.溶解过程中用玻璃棒搅拌的作用是加快氯化钠的溶解速率
C.实验的步骤为计算、称量、量取、溶解、装瓶贴标签
D.量取水时,用规格为100 mL的量筒
二、填空题
9.[2020·德州] 用4 g酚酞与酒精配制溶质质量分数为4%的酚酞溶液,需要酒精的质量是 g,其体积为 mL(酒精的密度为0.8 g/mL)。
10.3%的硼酸溶液可用于清洗皮肤的小面积创伤。现配制300 g溶质质量分数为3%的硼酸溶液,实验操作如下。
(1)称量硼酸固体:在图4中分别标出所选砝码的质量和游码的示数。
图4
(2)量取水:用量筒量取 mL水。(ρ水=1 g/mL)
(3)溶解:用到的玻璃仪器是 。
(4)装瓶、贴标签:在如图5所示的标签中填上相应的内容。
图5
11.配制一定溶质质量分数的氯化钠溶液的过程如图6所示。
图6
(1)写出图中标号仪器的名称:a. 。
(2)配制50 g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为氯化钠 g,水 g。
(3)称量氯化钠时,氯化钠应放在托盘天平的 (填“左”或“右”)盘。
(4)溶解过程中玻璃棒的作用是 。
(5)对配制的溶液进行检测,发现其溶质质量分数偏小,原因可能有 (填字母)。
A.称量时,药品与砝码放反了
B.量取水时,仰视读数
C.装瓶时,有少量溶液洒出
(6)把50 g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是 g。
三、计算题
12.某同学在实验室进行有关浓硫酸的实验,观察到瓶上的标签如下表所示。他从瓶中倒出100 mL用于配制稀硫酸。求:
浓硫酸(H2SO4)500 mL
溶质的质量分数 98%
密度 1.84 g/cm3
相对分子质量 98
强腐蚀性,阴冷、密封储藏
(1)这100 mL浓硫酸的质量是多少克 其中含溶质多少克
(2)欲配制1000 g质量分数为19.6%的稀硫酸,需要多少毫升这种浓硫酸 多少毫升水
【能力提升】
13.[2020·岳阳] 某同学需要配制50 g质量分数为15%的氯化钠溶液,步骤如图7所示。下列分析正确的是 ( )
图7
A.配制过程中出现了两处操作错误
B.实验操作步骤为计算、称量、量取、蒸发
C.若所有操作都正确,完全溶解后有液滴溅出,会导致溶质的质量分数偏小
D.配制时应称量氯化钠固体的质量为7.0 g
14.如图8是甲、乙、丙三种固体物质的溶解度曲线,请根据图填空。
图8
(1)t3 ℃时,甲、乙、丙三种物质的溶解度由大到小的关系是 。
(2)t2 ℃时,乙物质的饱和溶液中溶质和溶剂的质量之比为 (填最简整数比)。
(3)欲配制相同质量分数的乙、丙的饱和溶液,应保持温度在 ℃。
(4)将t3 ℃时甲、乙、丙三种物质的饱和溶液各100 g,分别降温至t1 ℃,所得溶液质量由大到小的关系是 。
答案
1.A 2.D 3.D 4.B 5.B 6.C 7.C 8.A
9.96 120
10.(1)①5 ②4.0
(2)291
(3)烧杯、玻璃棒
(4)
11.(1)量筒 (2)7.5 42.5
(3)左
(4)搅拌,加快氯化钠溶解的速率
(5)AB (6)100
12.解:(1)100 mL=100 cm3。
由m=ρV,得100 mL浓硫酸的质量为1.84 g/cm3×100 cm3=184 g。其溶质的质量为184 g×98%=180.32 g。
(2)设需要这种浓硫酸的体积为v。
1000 g×19.6%=v×1.84 g/cm3×98%
v=108.7 cm3=108.7 mL
需要水的质量为1000 g-108.7 cm3×1.84 g/cm3=800 g,体积为800 mL。
答:(1)这100 mL浓硫酸的质量为184 g,其中含溶质180.32 g;(2)需要108.7 mL这种浓硫酸,800 mL水。
A
14.(1)甲>乙>丙
(2)1∶2 (3)t1
(4)丙>乙>甲
