第三单元物质构成的奥秘--微观示意图(广东省专练)--2021-2022学年九年级化学人教版上册(word版 含解析)
文档属性
| 名称 | 第三单元物质构成的奥秘--微观示意图(广东省专练)--2021-2022学年九年级化学人教版上册(word版 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 300.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-23 09:45:11 | ||
图片预览




文档简介
九年级化学原子结构示意图(填空题)专项练习
一、填空题
1.图中的①、②分别是氮元素、钾元素在元素周期表中的部分信息,A、B、C、D 是四种粒子的结构示意图,请回答。
(1)氮元素的相对原子质量为___________,钾原子的核电荷数为___________。
(2)A、B、C、D 属于同种元素的粒子是___________(填序号);在 D 中 X=___________。
(3)A 粒子的化学性质与 B、C、D 中哪一种粒子的化学性质相似___________(填序号);
(4)C 元素在元素周期表中属于第___________周期;
(5)元素②与 B 组成的化合物的化学式是___________。
2.下表图1是元素周期表的一部分,请回答有关问题:
(1)某物质经分析只含有①号元素,则该物质___________(填序号)。
A.一定是单质 B.一定是化合物 C.可能是混合物
(2)写出④处元素的原子形成的离子的符号___________。
(3)①、②、③处3种元素形成常见化合物的化学式为___________。
(4)我国古代典籍中有“银针验毒”的记载,“银针验毒”的反应原理之一为: ,其中X为___________。
3.在宏观、微观和符号之间建立联系是化学特有的思维方式。
I.根据如图所示回答问题。
(1)钒原子的核外电子数是_______;
(2)B~F中共有_______种元素;
(3)B~F中属于稳定结构的原子是 _______(填字母序号);
(4)F表示的微粒_________(填符号)。
II.元素周期表是学习和研究化学的重要工具。如图是元素周期表的一部分,请分析图中信息回答相关问题:
(5)铝元素的相对原子质量为________,该元素属于__________(填“金属”或“非金属”)元素;根据元素周期表的信息,_______(填“能”或“不能”)直接找出铝原子的中子数;
(6)在元素周期表中,氪元素排在氩元素的正下方,推测氪气的化学性质比较_______(填“活泼”或“稳定”),从原子结构上分析,其原因是_________。
III.请回答下列问题。
(7)科学家在积极寻找洁净的新能源过程中,发现了氨气燃烧能释放出大量的热且产物对环境没有污染,其反应的微观示意图如图,该反应的表达式为_________。
4.建立宏观、微观和符号之间的相互联系是化学学科的特点。
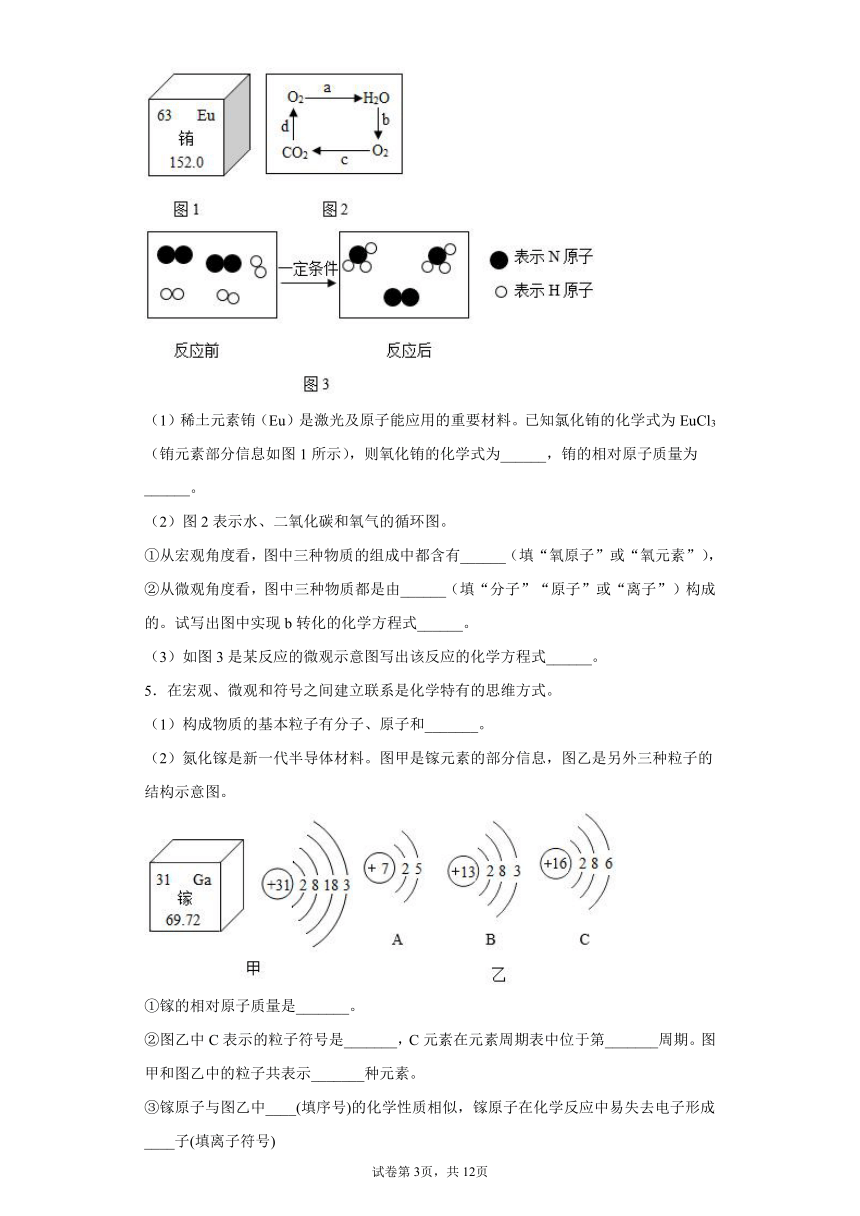
(1)稀土元素铕(Eu)是激光及原子能应用的重要材料。已知氯化铕的化学式为EuCl3(铕元素部分信息如图1所示),则氧化铕的化学式为______,铕的相对原子质量为______。
(2)图2表示水、二氧化碳和氧气的循环图。
①从宏观角度看,图中三种物质的组成中都含有______(填“氧原子”或“氧元素”),
②从微观角度看,图中三种物质都是由______(填“分子”“原子”或“离子”)构成的。试写出图中实现b转化的化学方程式______。
(3)如图3是某反应的微观示意图写出该反应的化学方程式______。
5.在宏观、微观和符号之间建立联系是化学特有的思维方式。
(1)构成物质的基本粒子有分子、原子和_______。
(2)氮化镓是新一代半导体材料。图甲是镓元素的部分信息,图乙是另外三种粒子的结构示意图。
①镓的相对原子质量是_______。
②图乙中C表示的粒子符号是_______,C元素在元素周期表中位于第_______周期。图甲和图乙中的粒子共表示_______种元素。
③镓原子与图乙中____(填序号)的化学性质相似,镓原子在化学反应中易失去电子形成____子(填离子符号)
6.2020年6月23日,北斗卫星导航系统部署成功。
(1)运输卫星用的火箭外壳主要材料为铝合金和钛合金。如图为钛元素在元素周期表中的信息及其原子结构示意图。
①钛原子核外有______个电子层,钛元素属于______元素(填“金属”或“非金属”)。
②对图中钛原子的信息解读不正确的是______。
A.图中x的数值为10
B.核电荷数为22
C.在化学反应中,钛原子容易得到电子
D.相对原子质量为47.87g
(2)、、分别表示氢元素的三种原子,火箭推进剂中的液氢含,制造氢弹要用、,如图是氢弹爆炸原理过程,其中甲、乙、丙是三种原子,“”“”“”分别表示原子中的质子、中子和核外电子。请根据相关信息回答下列问题:
①、、三种原子均属于氢元素的原因是______。
②图中粒子“”所带电性为______(填“正电”、“负电”或“不带电”)。
③氢弹爆炸______化学变化(填“属于”或“不属于”)。
7.嫦娥五号月壤样品首篇研究成果于2021年10月8日发布,证明月球在19.6亿年前仍存在岩浆活动。嫦娥五号登月着陆器使用砷化镓太阳能电池。图甲是砷元素在元素周期表中的部分信息以及原子结构示意图。回答下列问题。
(1)图甲中x为______。
(2)已知电子层数等于周期数,所以砷元素位于第______周期,属于______(填“金属”或“非金属”)元素。
(3)写出图乙中A的离子符号:______。
(4)图乙所示的四种粒子结构示意图中,与砷原子化学性质相似的是______(填字母序号)。
(5)图乙中表示的粒子中具有稳定结构的原子是______(填字母序号)。
8.如图是钠元素和氯元素在元素周期表中的信息和有关的4种粒子结构示意图,请回答下列问题:
(1)氯元素原子的质子数是_______;钠元素与氯元素的最本质区别是_______。
(2)上图四种粒子中,属于同种元素的是____(选填序号);元素的化学性质由____决定。
(3)若⑤表示Mg2+,则x=____,那么④和⑤相互作用形成的化合物的化学式是_____。
9.如图是硒(Se)原子结构示意图,请回答下列问题。
(1)P的值为_________ 。
(2)硒元素在元素周期表中位于第_________周期。
(3)硒原子在化学反应中容易_________(填“得”或“失”)电子,形成的离子符号____。
(4)硒元素的化学性质与下列哪种元素的化学性质相似 (填字母编号);
A. B. C.
(5)已知硒酸根是,写出硒酸钠的化学式____。
10.“宏观辨识与微观探析”是化学的核心素养之一
(1)根据图1所给信息,铝元素位于元素周期表中的第_______周期;请你画出氮原子结构示意图_______,该原子的中子数为_______。
(2)如图2是某个化学反应的微观模拟示意图。请根据图中的信息回答:
①反应前后,没有发生变化的微粒是_______(填微粒符号)。
②该反应的文字表达式为_______。
(3)下图为五种粒子的结构示意图。
①A~D四种粒子中属于同种元素的是_______(填字母),具有相对稳定结构的原子是_______(填字母)。
②若E为某原子得到一个电子形成的离子,则x的数值是_______。
11.如图是几种元素的粒子结构示意图及元素周期表的一部分。
(1)2021年2月27日,嫦娥五号采集的月壤样品在中国国家博物馆正式展出。月壤中存在着大量的氦﹣3(氦﹣3是含有2个质子和1个中子的氦原子),其原子结构示意图为图甲中的______(填序号)。
(2)硒是人体必需微量元素,具有防癌、抗癌作用,其原子结构示意图如图甲中的E,x为______,该元素处于元素周期表中第______周期。
(3)甲图中属于同种元素的是______(填字母序号,下同),具有相对稳定结构的微粒是______。
(4)请写出粒子C的符号______。
(5)图乙中Y元素名称是______,属于______(填“金属”、“非金属”或“稀有气体”)元素。
12.元素周期表是学习和研究化学的重要工具。溴元素的相关信息如图甲所示,请回答下列问题。
(1)溴的相对原子质量是_____________,溴属于______________(填“金属”或“非金属”)元素。
(2)溴元素的化学性质与图乙中______________(填字母)元素的化学性质相似。
(3)溴元素与图乙中A元素,形成化合物的化学式为______________________。
(4)若图乙中C表示离子,则x的值是_________________,表示该离子的符号为_________________。
13.“宏观辨识与微观探析”是化学学科的核心素养之一。请回答下列问题:
(1)从上图中可知,硼元素的原子序数是_______,相对原子质量是_______。
(2)氟元素属于_______(选填:金属、非金属、稀有气体)元素。
(3)钠元素位于元素周期表第________周期,该元素在反应中易______(填“得到”或“失去”)电子,形成的离子符号为___________。
(4)当镁原子形成镁离子时,镁离子的核外共有_______个电子层。镁元素和氟元素组成的化合物化学式为________。
(5)溴(Br)原子的原子结构示意图如上所示,数值X =_________,A-D四种元素中,与溴元素化学性质相似的是______(填写元素符号)。
14.化学为宏观物质、微观粒子与符号之间构筑了联系的桥梁。请回答下列问题:
(1)硫元素的相对原子质量是______。
(2)原子结构示意图B中x的数值为_______,它与C粒子构成的物质_____(填化学式)。
(3)A和B两种粒子的化学性质相似,从原子结构上看是因______相同。
(4)1H、2H、3H分别表示氢元素的三种原子,可简写成1H、2H、3H。制造燃料电池常用1H,制造氢弹要用2H、3H。请据图回答:
①1H、2H、3H,三种原子中_______,数目不等(填“质子”或“中子”或“电子”)
②2H2与O2反应生成的重水可表示为2H2O,写出3H2在O2中燃烧的化学方程式_______,在“上图的小方框中,把3H2与O2恰好完全反应的反应物微观粒子补画齐全_______。
15.完成下列各题:
(1)如图为锶元素的结构示意图,该元素原子的核电荷数为___________,该元素的相对原子质量为___________,该元素对应的离子为___________。(填离子符号)
(2)下表为元素周期表的部分元素的相关信息,利用下表回答问题:
①请画出16号元素原子结构示意图_____________,图中17号元素的单质的化学式是_____________。
②X3+与O2-的核外电子排布相同,则X的元素符号是_____________。
(3)用“”和“”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如图所示,下列说法不正确的是 。(填标号)
A.该反应是分解反应 B.参加反应的“”和“”分子的个数比是3:1
C.每个生成物分子由3个原子构成 D.该反应有2种生成物
(4)在一个密闭容器中放入W、G、H、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
物质 W G H P
反应前质量/g 18 1 2 32
反应后质量/g 待测 26 2 12
反应后待测W的质量为______________g,该反应的基本反应类型___________。
16.“北斗三号”是我国自主研发的全球卫星导航系统,它标志着我国导航系统进入世界先进行列。其核心技术授时精度由铷原子钟来控制完成,授时精度达百亿分之三秒。根据下图铷元素在元素周期表中的信息和铷原子的结构示意图,回答问题。
(1)铷的原子序数是___________。
(2)写出铷离子的符号___________。
(3)铷元素位于元素周期表的第___________周期。
17.钒被誉为“合金中的维生素”。钒的化学性质与镁元素的化学性质相似,钒元素的部分信息如图所示。请回答下列问题:
(1)上图中b的值为b =______。
(2)钒属于_____(填“金属”或“非金属”)元素;钒的相对原子质量为____。
(3)某反应的微观示意图如图所示:
①该反应所属的基本反应类型为________。
②丙物质中氟元素的化合价为:________。
③该反应中乙丙两种物质的质量比为:________。
18.如图中的①、②分别是钠元素、;氯元素在元素周期表中的信息,A、B、C是三种粒子的结构示意图.
试回答下列问题:
(1)钠元素的原子序数为____(填序号,下同)
(2)A、B、C中属于同种元素的粒子是____;
(3)A和B两种粒子的____相同,所以它们具有相似的化学性质;
(4)钠原子和氯原子反应所形成的化合物是由___(填“分子”、“原子”、“离子”)构成的。
(5)A、B、C属于阴离子的是____(填离子符号),B粒子在化学变化中容易____(选填“得到”或“失去”)电子。
19.图中A、B、C、D是四种粒子的结构示意图,E是银元素在元素周期表中的信息。
请回答下列问题:
(1)图中A、B、C、D粒子共表示_________种元素;
(2)A、B、C、D中表示的阴离子符号为_____。
(3)D中x=_________。
(4)E中决定银元素种类的数值是_________,一个银原子质量约是一个碳12原子质量的_________倍(结果保留整数)。
(5)已知原子或离子的电子层数越少,半径越小;若电子层数相同,则核电荷数越小,半径越大。则F-、Na+、C1-的离子半径由小到大的顺序为___________。
20.如图是氯元素在元素周期表中的信息以及A、B、C、D四种粒子的结构示意图,请根据图示回答。
(1)氯元素的相对原子质量是______;
(2)D是某原子的原子结构示意图,其中x=______;
(3)A、B、C、D四种粒子中,具有相对稳定结构的是______(填字母序号,下同);属于同种元素的是______。
(4)C的符号表示是______。
(5)根据元素原子结构示意图,不能直接获得的信息是______(填编号)。
①核电荷数②相对原子质量③电子层数④最外层电子数
试卷第2页,共2页
试卷第1页,共1页
九年级化学原子结构示意图(填空题)专项练习
参考答案
1.
(1) 14.01 19
(2) BC 8
(3)B
(4)3
(5)KCl
【分析】
(1)
在元素周期表中,元素名称下方的数字表示相对原子质量,故氮元素的相对原子质量为14.01;
在元素周期 表中,元素名称左上角的数字表示原子序数,在原子中,质子数=原子序数=核电荷数=19;
(2)
元素是质子数相同的一类原子的总称,B、C质子数相同,属于同种元素;
质子数=原子序数,18号元素是氩元素,属于稀有气体元素,其原子最外层电子数为8,达到了相对稳定结构,不易得失电子,故X=8;
(3)
A与B的最外层电子数相同,化学性质相似;
(4)
质子数=原子序数,17号元素是氯元素,在该粒子中,质子数小于核外电子数,表示阴离子,该粒子是其原子得到1个电子后形成的,其原子核外有3个电子层,位于第三周期;
(5)
元素②为钾元素, B为17号元素,为氯元素,钾元素与氯元素组成的化合物为氯化钾,化学式为:KCl。
2.
(1)C
(2)Cl-
(3)Al2(SO4)3
(4)Ag2S
【解析】
(1)
①号元素为8号元素氧元素,氧元素可以形成氧气或臭氧单质,故某物质经分析只含有①号元素,则该物质可能是氧气或臭氧或两者混合物;
故选C。
(2)
④处元素为17号元素氯元素,氯原子最外层有7个电子,容易得到1个电子形成氯离子,Cl-。
(3)
①、②、③处3种元素分别为氧、铝、硫,三者形成常见化合物为硫酸铝,铝元素化合价为+3,硫酸根化合价为-2,故化学式为Al2(SO4)3。
(4)
化学反应前后原子数目种类不变;反应前银、氢、硫、氧原子数目分别为4、4、2、2,反应后银、氢、硫、氧原子数目分别为0、4、0、2,则X为Ag2S。
3.
(1)23
(2)四(或4)
(3)D
(4)Mg2+
(5) 26.98 金属 不能
(6) 稳定 原子最外层电子数是8
(7)NH3 + O2N2 + H2O(或氨气+氧气氮气+水)
【解析】
(1)
核外电子数=原子序数,所以钒原子的核外电子数是23;
故填:23
(2)
B~F中共有四种不同的质子数,所以有四种元素。
(3)
稳定结构:只有一层电子的,最外层2个电子即稳定结构;超过一层的,最外层8个电子才能是稳定结构,F为离子。所以B~F中属于稳定结构的原子是D。
故填:D
(4)
F表示的微粒Mg2+
(5)
铝元素的相对原子质量为26.98,该元素属于金属元素;根据元素周期表的信息,相对原子质量 质子数+中子数,所以铝原子的中子数不能找出来,但可以利用公式算出来;
故填:26.98,金属,不能
(6)
在元素周期表中,氪元素排在氩元素的正下方,推测氪气的化学性质比较稳定,因为原子最外层电子数是8。
故填:稳定,原子最外层电子数是8
(7)
由反应的微观示意图可知,该反应的表达式为NH3 + O2N2 + H2O(或氨气+氧气氮气+水)
4.
(1) Eu2O3 152.0
(2) 氧元素 分子
(3)
【解析】
(1)
氯化铕中,氯元素化合价是 1,根据化合物中元素化合价代数和为零可知,铕元素的化合价是+3,氧化铕中氧元素化合价是 2,根据化合物中元素化合价代数和为零可知,氧化铕的化学式为Eu2O3;图中152.0表示的是铕元素的相对原子质量。
(2)
①从宏观角度看,图中三种物质的组成中都含有氧元素,
②从微观角度看,图中三种物质都是由分子构成的,图中通过电解水可以实现b转化,电解水生成氢气和氧气,反应的化学方程式为。
(3)
根据图中给出的微观示意图可知,反应后依然存在一个N2分子,说明反应前多了一个N2分子,则反应物为N2和H2,生成物为NH3,由此可判断其化学方程式 。
5.
(1)离子
(2) 69.72 S 三 4 B Ga3+
【分析】
(1)
构成物质的粒子有分子、原子和离子,故答案为:离子。
(2)
①由图甲可以得知镓的相对原子质量是69.72,故填:69.72。
②图乙中C表示的粒子符号是S,C元素原子核外电子层数是3,在元素周期表中位于第三周期,图甲和图乙中的粒子质子数分别为31、7、13、16共表示4种元素,故填:S;三;4。
③最外层电子数相同,化学性质相似,镓原子与图乙中B的化学性质相似,因为它们最外层的电子数相等,最外层电子数是3,它们在化学反应中易失去电子形成离子,故填:B;Ga3+。
6.
(1) 4 金属 CD
(2) 质子数相同 不带电 不属于
【分析】
(1)根据原子结构示意图的信息、元素的分类、元素周期表的信息来分析;
(2)根据元素的概念、粒子所带电荷、原子结构来分析。
(1)
①由钛原子结构示意图可知,钛原子的核外有4个电子层,由元素名称的偏旁“钅”字可知,钛元素属于金属元素;故答案为:4;金属。
②A、在原子中,质子数=核外电子数,因此图中x的数值为22﹣2﹣8﹣2=10,故正确;
B、由钛原子结构示意图可知,钛原子的质子数为22,则其核电荷数为22,故正确;
C、由钛原子结构示意图可知,钛原子的最外层有2个电子,少于4个,因此在化学反应中,钛原子容易失去电子,故错误;
D、相对原子质量的单位不是“g”而是“1”,通常省略不写,钛原子的相对原子质量为47.87,故错误。
故选:CD。
(2)
①元素是具有相同质子数的一类原子的总称,、、三种原子均属于氢元素的原因是质子数相同;故答案为:质子数相同;
②图中粒子“”是中子,不显电性;故答案为:不带电;
③氢弹爆炸不为化学变化,因为化学变化中原子是最小粒子,原子没有破裂,而氢弹爆炸中原子破裂了;故答案为:不属于。
7.
(1)18
(2) 四 非金属
(3)O2-
(4)C
(5)D
【分析】
(1)
原子中,核电荷数=质子数=核外电子数,根据砷原子结构示意图可知:33=2+8+x+5,解得x=18,故填:18。
(2)
砷元素原子核外由四个电子层,所以砷元素位于第四周期,砷的汉字是“石”字旁,属于非金属元素,故填:四(或4);非金属。
(3)
图乙中A中质子数为8,核外电子的数目是6,在化学反应中易得到2个电子达到稳定结构,形成带有2个单位电荷的氧离子,该粒子的符号为O2-,故填:O2-。
(4)
原子的最外层电子数相同,元素原子的化学性质相似,砷原子的最外层电子数为5,图乙所示的四种粒子结构示意图中,粒子A最外层电子数为6,粒子B最外层电子数为1,粒子C最外层电子数为5,粒子D最外层电子数为8,所以与砷原子化学性质相似的是C粒子,故填:C。
(5)
最外层电子数达到8个电子(若只有一层,则最外层电子数为2),具有稳定的结构,由微观的结构示意图可知,D的质子数等于电子数,最外层电子数是8,是具有稳定结构的原子。
8.
(1) 17 质子数不同
(2) ①②,③④ 最外层电子数
(3) 12 MgCl2
【分析】
(1)
元素周期表中每一格表示的意义:左上角的数字表示原子序数,在原子中,原子序数=核电荷数=质子数=核外电子数,则氯元素原子的质子数为17;元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),氯元素和钠元素的最本质区别是核内质子数不同,故填:17;质子数不同。
(2)
元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),①②粒子的质子数均为11,属于同一种元素,③④粒子的质子数均为17,也属于同一种元素,故填:①②,③④;最外层电子数。
(3)
若⑤表示Mg2+,镁元素原子的核内质子数是12,则x= 12;④是氯离子,在化合物中化合价是-1,⑤是镁离子,在化合物中化合价是+2,根据化合物中元素化合价代数和为零可知,镁元素和氯元素形成的氯化镁的化学式是MgCl2,故填:12;MgCl2。
9.
(1)34
(2)四
(3) 得
Se2-
(4)C
(5)Na2SeO4
【分析】
(1)
原子中,质子数=核外电子数,所以P的值为2+8+18+6=34;
(2)
原子中,原子核外电子层数等于其元素所在周期数,硒原子核外有四个电子层,所以硒元素位于第四周期;
(3)
硒原子最外层有6个电子,在化学反应中容易得到2个电子形成带两个单位负电荷的硒离子,离子符号为:Se2-;
(4)
最外层电子数决定元素化学性质,硒元素的原子最外层电子数为6,所以选C;
(5)
硒酸根带两个单位负电荷,在化合物中显示-2价,钠元素为+1价,故硒酸钠的化学式为Na2SeO4。
10.
(1) 三 7
(2) C和O 一氧化碳+氧气二氧化碳
(3) BD AC 17
【解析】
(1)
由图可知,铝原子核外有三个电子层,则铝元素位于元素周期表中的第三周期,故填三;
由图可知,氮原子的原子序数为7,则氮原子的质子数与核外电子数也为7,故氮原子的结构示意图画为;
相对原子质量=质子数+中子数,由图可知,氮原子的相对原子质量的近似值为14,质子数为7,则氮原子的中子数=14 7=7,故填7。
(2)
①由图可知,反应是一氧化碳与氧气在点燃的条件下反应生成二氧化碳,化学反应中原子保持不变,则反应前后,没有发生变化的微粒是碳原子与氧原子,其符号依次为C、O,故填C和O;
②由图可知,该反应是一氧化碳与氧气在点燃的条件下反应生成二氧化碳,故反应的文字表达式写为:一氧化碳+氧气二氧化碳。
(3)
①由元素概念可知,具有相同质子数的原子属于同一种元素,A~D四种粒子中,微粒B、D的质子数均为11,属于同种元素,故填BD;
多电子层的原子,其最外层电子数为8的结构属于稳定结构,A~D四种微粒中,B、C的最外层电子数均为8,属于稳定结构,微粒A只有1个电子层,且该电子层上的电子数为2,也属于稳定结构,即A~D四种微粒中,具有相对稳定结构的微粒有A、B、C三种,其中微粒A、C的质子数与核外电子数相同,属于原子,所以A~D四种微粒中具有相对稳定结构的原子是A、C,故填AC。
②由图可知,微粒E的核外电子数为18,若E为某原子得到一个电子形成的离子,则E原子的核外电子数为17,原子中质子数等于核外电子数,则微粒E中x的值为17,故填17。
11.
(1)A
(2) 6 四
(3) DF ACF
(4)O2-
(5) 硅元素 非金属
【解析】
(1)
氦﹣3(氦﹣3是含有2个质子和1个中子的氦原子),在原子中,质子数=核外电子数,则核外有1个电子层,核外电子数为2,故填:A。
(2)
在原子中,质子数=核外电子数,则,原子的核外电子层数等于周期数,核外有4个电子层,则该元素处于元素周期表中第四周期。
(3)
质子数相同的元素属于同种元素,DF的质子数均为17,则甲图中属于同种元素的是DF,最外层电子数为8(氦元素最外层电子数为2),是相对稳定结构,则具有相对稳定结构的微粒是ACF。
(4)
C的质子数为8,质子数小于核外电子数,是氧离子,则粒子C的符号为O2-。
(5)
图乙中Y元素的原子序数为14,在原子中,质子数=原子序数,则质子数为14,故名称是硅元素,硅是石字旁,则属于非金属元素。
12.
(1) 79.90 非金属
(2)B
(3)KBr
(4) 8
【解析】
(1)
元素周期表中,元素名称正下方的数值是该元素的相对原子质量,故溴的相对原子质量是79.90,溴的偏旁是“氵”,故属于非金属元素。
(2)
最外层电子数决定元素的化学性质,溴元素的原子最外层电子数是7,故与图乙中B元素的化学性质相似。
(3)
溴元素的最外层电子数是7,在化学反应中易得到1个电子,A元素的最外层电子数是1,在化学反应中易失去1个电子,故两种元素形成的化合物中原子的个数比为1:1,书写化学式时,金属元素在左边,非金属元素在右边,故其化合物的化学式为KBr。
(4)
若图乙中C表示离子,则说明该微粒是稳定结构,即最外层电子数是8,x的值是8。该微粒的核电核数是16,为硫元素,分析该微粒的离子结构示意图可知,一个硫离子带2个单位的负电荷,故其离子符号为:。
13.
(1) 5 10.81
(2)非金属
(3) 3##三 失去 Na+
(4) 2 MgF2
(5) 18 F
【分析】
(1)
根据元素周期表中的一格可知,左上角是原子序数,汉字下方是相对原子质量,所以硼元素的原子序数是5,相对原子质量是10.81,故填:5;10.81。
(2)
氟带“气”字头,该元素属于非金属元素,故填:非金属。
(3)
钠元素原子有3个电子层,所以钠元素位于元素周期表第三周期;钠原子的最外层电子数是1,该元素在化学反应中容易失去电子,形成的钠离子,故填:3(或三);失去;Na+。
(4)
当镁原子最外层电子数是2 ,在化学反应中容易失去电子形成镁离子时,镁离子的核外共有2个电子层。镁元素和氟元素组成的化合物中镁元素的化合价为+2价,氟元素的化合价为-1价,其化学式为MgF2,故填:2(或二);MgF2。
(5)
在原子中,质子数=核外电子数,根据溴原子的原子结构示意图可知X+2+8+7 =35,解得X=18,;在外层电子数相等,则元素的化学性质相似,溴原子的最外层电子数为7,氟原子的最外层电子数也为7 ,所以与溴元素化学性质相似的是氟元素,故填:18;F。
14.
(1)32.06
(2) 8 Na2S
(3)最外层电子数
(4) 中子
【分析】
(1)
根据元素周期表可知,硫元素的相对原子质量是32.06或32;
(2)
在原子中,质子数=核外电子数,即2+x+1=11,x=8,B是质子数为11的钠元素,其化合价为+1价,C的质子数为16,是硫元素,在化合物中显-2价,二者形成的化合物的化学式为Na2S;
(3)
A和B两种微粒的最外层电子数相同,所以两种粒子的化学性质相似;
(4)
①1H、2H、3H三种原子中,左上角的数值表示的是质子数和中子数的总和,质子数和电子数相同,中子数=质量数一质子数,因此中子数目不等,故填:中子;
②由题意可知,3H2在O2中燃烧生成了3H2O,反应的化学方程式是:,由质量守恒定律可知,每2个3H2与1个O2恰好反应,所以在小方框应补充2个3H2分子,如图 。
【点睛】
15.
(1) 38 87.62 Sr2+
(2) Cl2 Al
(3)ACD
(4) 13 化合反应
【分析】
(1)
根据在原子结构中:原子序数=核电荷数=质子数=核外电子数,由锶元素的粒子结构示意图,锶原子的原子序数为38,因此一个锶原子核电荷数为38;从元素周期表一格中,正下方数字可知锶原子的相对原子质量为87.62;锶原子的原子结构示意图,最外层电子数为2,容易失去,形成锶离子,化学符号为:Sr2+。
(2)
①16号元素原子为硫原子,根据核外电子的分层排布规律,可画出硫原子的原子结构示意图为:;17号元素为氯元素,所形成的单质为氯气,氯气有氯气分子构成,每个氯气分子由两个氯原子构成,化学式为:Cl2。
②X3+与O2-核外电子排布相同,所以X3+核外有10个电子,X失去3个电子形成X3+,所以X核外有13个电子;根据在原子结构中:原子序数=核电荷数=质子数=核外电子数,所以X为13号元素,铝元素(Al)。
(3)
A、反应生成的四个分子构成相同,为同种物质的分子,即反应生成一种物质;反应物为两种单质;该反应为两种物质生成一种物质的化合反应,此选项表述不正确;
B、对比反应前后的分子,其中反应前的3个分子有1个未参加反应,因此,参加反应该分子有2个;图中的6个分子全部参加反应;所以,参加反应的“”和“”分子个数比为6:2=3:1,此选项表述正确;
C、由反应的模拟模型图可得知,反应的生成物的分子由四个原子构成,此选项表述不正确;
D、反应生成的四个分子构成相同,为同种物质的分子,而反应后的分子为未参加反应的分子、不是反应所生成的分子;因此反应的生成物只有一种,此选项表述不正确。故选ACD。
(4)
由表格信息可知反应后G质量增加了25克,是生成物;P质量减少了20克,是反应物;H质量不变,可能做催化剂,反应物还少5克,所以W是反应物,所以反应后物质W的质量为18g-5g=13g,反应物是G和P,生成物是W,所以是化合反应。
16.
(1)37
(2)Rb+
(3)5
【分析】
(1)
由题中信息可知,铷的原子序数是37;
(2)
由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。铷离子的符号表示为Rb+;
(3)
原子核外有几个电子层,元素就位于第几周期,铷原子核外有5个电子层,元素位于元素周期表的第5周期。
17.
(1)2
(2) 金属 50.94
(3) 置换反应 -1 9:20
【分析】
(1)
原子核核外电子的第一层不超过2个,故a=2,在原子中,质子数=核外电子数=核电荷数,钒原子的质子数为23,b=23-2-8-11=2;
(2)
钒属于金属元素,钒的相对原子质量为50.94;
(3)
①根据微观示意图可知,该反应为一种单质与一种化合物生成一种单质和一种化合物的反应,属于置换反应;
②根据微观示意图可知,该反应的化学方程式为:2F2+2H2O=4HF+O2,丙物质中氢元素的化合价为+1甲,氟元素的化合价为-1价;
③根据化学方程式可知,乙丙两种物质的质量比为2×(16+2):4×(19+1)=9:20。
【点睛】
18.
(1)11
(2)BC
(3)最外层电子数
(4)离子
(5) Cl- 得到
【分析】
(1)
由元素周期表中的信息可知,左上角的数字表示原子序数,则钠元素的原子序数为11。
(2)
元素是质子数相同的一类原子的总称,B、C的质子数均为17,则A、B、C中属于同种元素的粒子是BC。
(3)
由结构示意图可知,A和B两种粒子的最外层电子数为7,则A和B两种粒子的最外层电子数相同,所以它们具有相似的化学性质。
(4)
钠原子和氯原子反应所形成的化合物是氯化钠,由氯离子和钠离子构成,故钠原子和氯原子反应所形成的化合物是由离子构成的。
(5)
质子数小于核外电子数,为阴离子,A的质子数等于核外电子数,为氟原子,B的质子数等于核外电子数,为氯原子,C的质子数小于核外电子数,为氯离子,则A、B、C属于阴离子的是C,离子符号为Cl-,B粒子最外层电子数为7,大于4,则在化学变化中容易得到电子。
19.
(1)三
(2)Cl-
(3)8
(4) 47
9
(5)Na+、F-、C1-
【解析】
(1)
质子数决定元素种类,图中分别表示13号、17号和18号元素,故填:三;
(2)
阴离子的质子数少于核外电子数,所以C为阴离子,符号为Cl-;
(3)
D中核内质子数为18,所以x的值为8;
(4)
质子数决定元素种类,质子数等于原子序数,所以E中决定银元素种类的数值是47;碳原子的相对原子质量为12,银原子的相对原子质量近似为107.9,,所以,一个银原子质量约是一个碳12原子质量的9倍;
(5)
氟离子核电荷数为9,电子层数为2,钠离子的核电荷数为11,电子层数为2,氯离子的电子层数为3, 因为原子或离子的电子层数越少,半径越小;若电子层数相同,则核电荷数越小,半径越大,所以钠离子半径最小,氯离子半径最大,故三种离子半径由小到大的顺序为:Na+、F-、C1-。
20.
(1)35.45
(2)8
(3) A、C、D B和C
(4)F-
(5)②
【分析】
(1)
由题目给出的图片信息可以得知,氯元素的相对原子质量为:35.45
(2)
D是某原子的原子结构示意图,其中
(3)
A、B、C、D四种原子钟,相对稳定的是ACD,因为A中只有一个电子层,所以在达到2个电子时是稳定的结构,CD两种粒子的最外层电子数为8,达到了稳定的结构;观察核内质子数,B和C的核内质子数相同,所以属于同种元素
(4)
C中的粒子,核内质子数为9,在元素周期表中,核内质子数为9的元素是氟元素,此时其核外电子数比核内质子数多一个,所以该粒子带一个负电荷,符号即为:
(5)
原子结构示意图可以获取的信息有:核电荷数、电子层数、最外层电子数等,但无法直接看出其相对原子质量
【点睛】
本题重点在于掌握原子结构示意图,了解示意图中各个部分的表示含义答案第1页,共2页
答案第1页,共2页
一、填空题
1.图中的①、②分别是氮元素、钾元素在元素周期表中的部分信息,A、B、C、D 是四种粒子的结构示意图,请回答。
(1)氮元素的相对原子质量为___________,钾原子的核电荷数为___________。
(2)A、B、C、D 属于同种元素的粒子是___________(填序号);在 D 中 X=___________。
(3)A 粒子的化学性质与 B、C、D 中哪一种粒子的化学性质相似___________(填序号);
(4)C 元素在元素周期表中属于第___________周期;
(5)元素②与 B 组成的化合物的化学式是___________。
2.下表图1是元素周期表的一部分,请回答有关问题:
(1)某物质经分析只含有①号元素,则该物质___________(填序号)。
A.一定是单质 B.一定是化合物 C.可能是混合物
(2)写出④处元素的原子形成的离子的符号___________。
(3)①、②、③处3种元素形成常见化合物的化学式为___________。
(4)我国古代典籍中有“银针验毒”的记载,“银针验毒”的反应原理之一为: ,其中X为___________。
3.在宏观、微观和符号之间建立联系是化学特有的思维方式。
I.根据如图所示回答问题。
(1)钒原子的核外电子数是_______;
(2)B~F中共有_______种元素;
(3)B~F中属于稳定结构的原子是 _______(填字母序号);
(4)F表示的微粒_________(填符号)。
II.元素周期表是学习和研究化学的重要工具。如图是元素周期表的一部分,请分析图中信息回答相关问题:
(5)铝元素的相对原子质量为________,该元素属于__________(填“金属”或“非金属”)元素;根据元素周期表的信息,_______(填“能”或“不能”)直接找出铝原子的中子数;
(6)在元素周期表中,氪元素排在氩元素的正下方,推测氪气的化学性质比较_______(填“活泼”或“稳定”),从原子结构上分析,其原因是_________。
III.请回答下列问题。
(7)科学家在积极寻找洁净的新能源过程中,发现了氨气燃烧能释放出大量的热且产物对环境没有污染,其反应的微观示意图如图,该反应的表达式为_________。
4.建立宏观、微观和符号之间的相互联系是化学学科的特点。
(1)稀土元素铕(Eu)是激光及原子能应用的重要材料。已知氯化铕的化学式为EuCl3(铕元素部分信息如图1所示),则氧化铕的化学式为______,铕的相对原子质量为______。
(2)图2表示水、二氧化碳和氧气的循环图。
①从宏观角度看,图中三种物质的组成中都含有______(填“氧原子”或“氧元素”),
②从微观角度看,图中三种物质都是由______(填“分子”“原子”或“离子”)构成的。试写出图中实现b转化的化学方程式______。
(3)如图3是某反应的微观示意图写出该反应的化学方程式______。
5.在宏观、微观和符号之间建立联系是化学特有的思维方式。
(1)构成物质的基本粒子有分子、原子和_______。
(2)氮化镓是新一代半导体材料。图甲是镓元素的部分信息,图乙是另外三种粒子的结构示意图。
①镓的相对原子质量是_______。
②图乙中C表示的粒子符号是_______,C元素在元素周期表中位于第_______周期。图甲和图乙中的粒子共表示_______种元素。
③镓原子与图乙中____(填序号)的化学性质相似,镓原子在化学反应中易失去电子形成____子(填离子符号)
6.2020年6月23日,北斗卫星导航系统部署成功。
(1)运输卫星用的火箭外壳主要材料为铝合金和钛合金。如图为钛元素在元素周期表中的信息及其原子结构示意图。
①钛原子核外有______个电子层,钛元素属于______元素(填“金属”或“非金属”)。
②对图中钛原子的信息解读不正确的是______。
A.图中x的数值为10
B.核电荷数为22
C.在化学反应中,钛原子容易得到电子
D.相对原子质量为47.87g
(2)、、分别表示氢元素的三种原子,火箭推进剂中的液氢含,制造氢弹要用、,如图是氢弹爆炸原理过程,其中甲、乙、丙是三种原子,“”“”“”分别表示原子中的质子、中子和核外电子。请根据相关信息回答下列问题:
①、、三种原子均属于氢元素的原因是______。
②图中粒子“”所带电性为______(填“正电”、“负电”或“不带电”)。
③氢弹爆炸______化学变化(填“属于”或“不属于”)。
7.嫦娥五号月壤样品首篇研究成果于2021年10月8日发布,证明月球在19.6亿年前仍存在岩浆活动。嫦娥五号登月着陆器使用砷化镓太阳能电池。图甲是砷元素在元素周期表中的部分信息以及原子结构示意图。回答下列问题。
(1)图甲中x为______。
(2)已知电子层数等于周期数,所以砷元素位于第______周期,属于______(填“金属”或“非金属”)元素。
(3)写出图乙中A的离子符号:______。
(4)图乙所示的四种粒子结构示意图中,与砷原子化学性质相似的是______(填字母序号)。
(5)图乙中表示的粒子中具有稳定结构的原子是______(填字母序号)。
8.如图是钠元素和氯元素在元素周期表中的信息和有关的4种粒子结构示意图,请回答下列问题:
(1)氯元素原子的质子数是_______;钠元素与氯元素的最本质区别是_______。
(2)上图四种粒子中,属于同种元素的是____(选填序号);元素的化学性质由____决定。
(3)若⑤表示Mg2+,则x=____,那么④和⑤相互作用形成的化合物的化学式是_____。
9.如图是硒(Se)原子结构示意图,请回答下列问题。
(1)P的值为_________ 。
(2)硒元素在元素周期表中位于第_________周期。
(3)硒原子在化学反应中容易_________(填“得”或“失”)电子,形成的离子符号____。
(4)硒元素的化学性质与下列哪种元素的化学性质相似 (填字母编号);
A. B. C.
(5)已知硒酸根是,写出硒酸钠的化学式____。
10.“宏观辨识与微观探析”是化学的核心素养之一
(1)根据图1所给信息,铝元素位于元素周期表中的第_______周期;请你画出氮原子结构示意图_______,该原子的中子数为_______。
(2)如图2是某个化学反应的微观模拟示意图。请根据图中的信息回答:
①反应前后,没有发生变化的微粒是_______(填微粒符号)。
②该反应的文字表达式为_______。
(3)下图为五种粒子的结构示意图。
①A~D四种粒子中属于同种元素的是_______(填字母),具有相对稳定结构的原子是_______(填字母)。
②若E为某原子得到一个电子形成的离子,则x的数值是_______。
11.如图是几种元素的粒子结构示意图及元素周期表的一部分。
(1)2021年2月27日,嫦娥五号采集的月壤样品在中国国家博物馆正式展出。月壤中存在着大量的氦﹣3(氦﹣3是含有2个质子和1个中子的氦原子),其原子结构示意图为图甲中的______(填序号)。
(2)硒是人体必需微量元素,具有防癌、抗癌作用,其原子结构示意图如图甲中的E,x为______,该元素处于元素周期表中第______周期。
(3)甲图中属于同种元素的是______(填字母序号,下同),具有相对稳定结构的微粒是______。
(4)请写出粒子C的符号______。
(5)图乙中Y元素名称是______,属于______(填“金属”、“非金属”或“稀有气体”)元素。
12.元素周期表是学习和研究化学的重要工具。溴元素的相关信息如图甲所示,请回答下列问题。
(1)溴的相对原子质量是_____________,溴属于______________(填“金属”或“非金属”)元素。
(2)溴元素的化学性质与图乙中______________(填字母)元素的化学性质相似。
(3)溴元素与图乙中A元素,形成化合物的化学式为______________________。
(4)若图乙中C表示离子,则x的值是_________________,表示该离子的符号为_________________。
13.“宏观辨识与微观探析”是化学学科的核心素养之一。请回答下列问题:
(1)从上图中可知,硼元素的原子序数是_______,相对原子质量是_______。
(2)氟元素属于_______(选填:金属、非金属、稀有气体)元素。
(3)钠元素位于元素周期表第________周期,该元素在反应中易______(填“得到”或“失去”)电子,形成的离子符号为___________。
(4)当镁原子形成镁离子时,镁离子的核外共有_______个电子层。镁元素和氟元素组成的化合物化学式为________。
(5)溴(Br)原子的原子结构示意图如上所示,数值X =_________,A-D四种元素中,与溴元素化学性质相似的是______(填写元素符号)。
14.化学为宏观物质、微观粒子与符号之间构筑了联系的桥梁。请回答下列问题:
(1)硫元素的相对原子质量是______。
(2)原子结构示意图B中x的数值为_______,它与C粒子构成的物质_____(填化学式)。
(3)A和B两种粒子的化学性质相似,从原子结构上看是因______相同。
(4)1H、2H、3H分别表示氢元素的三种原子,可简写成1H、2H、3H。制造燃料电池常用1H,制造氢弹要用2H、3H。请据图回答:
①1H、2H、3H,三种原子中_______,数目不等(填“质子”或“中子”或“电子”)
②2H2与O2反应生成的重水可表示为2H2O,写出3H2在O2中燃烧的化学方程式_______,在“上图的小方框中,把3H2与O2恰好完全反应的反应物微观粒子补画齐全_______。
15.完成下列各题:
(1)如图为锶元素的结构示意图,该元素原子的核电荷数为___________,该元素的相对原子质量为___________,该元素对应的离子为___________。(填离子符号)
(2)下表为元素周期表的部分元素的相关信息,利用下表回答问题:
①请画出16号元素原子结构示意图_____________,图中17号元素的单质的化学式是_____________。
②X3+与O2-的核外电子排布相同,则X的元素符号是_____________。
(3)用“”和“”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如图所示,下列说法不正确的是 。(填标号)
A.该反应是分解反应 B.参加反应的“”和“”分子的个数比是3:1
C.每个生成物分子由3个原子构成 D.该反应有2种生成物
(4)在一个密闭容器中放入W、G、H、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
物质 W G H P
反应前质量/g 18 1 2 32
反应后质量/g 待测 26 2 12
反应后待测W的质量为______________g,该反应的基本反应类型___________。
16.“北斗三号”是我国自主研发的全球卫星导航系统,它标志着我国导航系统进入世界先进行列。其核心技术授时精度由铷原子钟来控制完成,授时精度达百亿分之三秒。根据下图铷元素在元素周期表中的信息和铷原子的结构示意图,回答问题。
(1)铷的原子序数是___________。
(2)写出铷离子的符号___________。
(3)铷元素位于元素周期表的第___________周期。
17.钒被誉为“合金中的维生素”。钒的化学性质与镁元素的化学性质相似,钒元素的部分信息如图所示。请回答下列问题:
(1)上图中b的值为b =______。
(2)钒属于_____(填“金属”或“非金属”)元素;钒的相对原子质量为____。
(3)某反应的微观示意图如图所示:
①该反应所属的基本反应类型为________。
②丙物质中氟元素的化合价为:________。
③该反应中乙丙两种物质的质量比为:________。
18.如图中的①、②分别是钠元素、;氯元素在元素周期表中的信息,A、B、C是三种粒子的结构示意图.
试回答下列问题:
(1)钠元素的原子序数为____(填序号,下同)
(2)A、B、C中属于同种元素的粒子是____;
(3)A和B两种粒子的____相同,所以它们具有相似的化学性质;
(4)钠原子和氯原子反应所形成的化合物是由___(填“分子”、“原子”、“离子”)构成的。
(5)A、B、C属于阴离子的是____(填离子符号),B粒子在化学变化中容易____(选填“得到”或“失去”)电子。
19.图中A、B、C、D是四种粒子的结构示意图,E是银元素在元素周期表中的信息。
请回答下列问题:
(1)图中A、B、C、D粒子共表示_________种元素;
(2)A、B、C、D中表示的阴离子符号为_____。
(3)D中x=_________。
(4)E中决定银元素种类的数值是_________,一个银原子质量约是一个碳12原子质量的_________倍(结果保留整数)。
(5)已知原子或离子的电子层数越少,半径越小;若电子层数相同,则核电荷数越小,半径越大。则F-、Na+、C1-的离子半径由小到大的顺序为___________。
20.如图是氯元素在元素周期表中的信息以及A、B、C、D四种粒子的结构示意图,请根据图示回答。
(1)氯元素的相对原子质量是______;
(2)D是某原子的原子结构示意图,其中x=______;
(3)A、B、C、D四种粒子中,具有相对稳定结构的是______(填字母序号,下同);属于同种元素的是______。
(4)C的符号表示是______。
(5)根据元素原子结构示意图,不能直接获得的信息是______(填编号)。
①核电荷数②相对原子质量③电子层数④最外层电子数
试卷第2页,共2页
试卷第1页,共1页
九年级化学原子结构示意图(填空题)专项练习
参考答案
1.
(1) 14.01 19
(2) BC 8
(3)B
(4)3
(5)KCl
【分析】
(1)
在元素周期表中,元素名称下方的数字表示相对原子质量,故氮元素的相对原子质量为14.01;
在元素周期 表中,元素名称左上角的数字表示原子序数,在原子中,质子数=原子序数=核电荷数=19;
(2)
元素是质子数相同的一类原子的总称,B、C质子数相同,属于同种元素;
质子数=原子序数,18号元素是氩元素,属于稀有气体元素,其原子最外层电子数为8,达到了相对稳定结构,不易得失电子,故X=8;
(3)
A与B的最外层电子数相同,化学性质相似;
(4)
质子数=原子序数,17号元素是氯元素,在该粒子中,质子数小于核外电子数,表示阴离子,该粒子是其原子得到1个电子后形成的,其原子核外有3个电子层,位于第三周期;
(5)
元素②为钾元素, B为17号元素,为氯元素,钾元素与氯元素组成的化合物为氯化钾,化学式为:KCl。
2.
(1)C
(2)Cl-
(3)Al2(SO4)3
(4)Ag2S
【解析】
(1)
①号元素为8号元素氧元素,氧元素可以形成氧气或臭氧单质,故某物质经分析只含有①号元素,则该物质可能是氧气或臭氧或两者混合物;
故选C。
(2)
④处元素为17号元素氯元素,氯原子最外层有7个电子,容易得到1个电子形成氯离子,Cl-。
(3)
①、②、③处3种元素分别为氧、铝、硫,三者形成常见化合物为硫酸铝,铝元素化合价为+3,硫酸根化合价为-2,故化学式为Al2(SO4)3。
(4)
化学反应前后原子数目种类不变;反应前银、氢、硫、氧原子数目分别为4、4、2、2,反应后银、氢、硫、氧原子数目分别为0、4、0、2,则X为Ag2S。
3.
(1)23
(2)四(或4)
(3)D
(4)Mg2+
(5) 26.98 金属 不能
(6) 稳定 原子最外层电子数是8
(7)NH3 + O2N2 + H2O(或氨气+氧气氮气+水)
【解析】
(1)
核外电子数=原子序数,所以钒原子的核外电子数是23;
故填:23
(2)
B~F中共有四种不同的质子数,所以有四种元素。
(3)
稳定结构:只有一层电子的,最外层2个电子即稳定结构;超过一层的,最外层8个电子才能是稳定结构,F为离子。所以B~F中属于稳定结构的原子是D。
故填:D
(4)
F表示的微粒Mg2+
(5)
铝元素的相对原子质量为26.98,该元素属于金属元素;根据元素周期表的信息,相对原子质量 质子数+中子数,所以铝原子的中子数不能找出来,但可以利用公式算出来;
故填:26.98,金属,不能
(6)
在元素周期表中,氪元素排在氩元素的正下方,推测氪气的化学性质比较稳定,因为原子最外层电子数是8。
故填:稳定,原子最外层电子数是8
(7)
由反应的微观示意图可知,该反应的表达式为NH3 + O2N2 + H2O(或氨气+氧气氮气+水)
4.
(1) Eu2O3 152.0
(2) 氧元素 分子
(3)
【解析】
(1)
氯化铕中,氯元素化合价是 1,根据化合物中元素化合价代数和为零可知,铕元素的化合价是+3,氧化铕中氧元素化合价是 2,根据化合物中元素化合价代数和为零可知,氧化铕的化学式为Eu2O3;图中152.0表示的是铕元素的相对原子质量。
(2)
①从宏观角度看,图中三种物质的组成中都含有氧元素,
②从微观角度看,图中三种物质都是由分子构成的,图中通过电解水可以实现b转化,电解水生成氢气和氧气,反应的化学方程式为。
(3)
根据图中给出的微观示意图可知,反应后依然存在一个N2分子,说明反应前多了一个N2分子,则反应物为N2和H2,生成物为NH3,由此可判断其化学方程式 。
5.
(1)离子
(2) 69.72 S 三 4 B Ga3+
【分析】
(1)
构成物质的粒子有分子、原子和离子,故答案为:离子。
(2)
①由图甲可以得知镓的相对原子质量是69.72,故填:69.72。
②图乙中C表示的粒子符号是S,C元素原子核外电子层数是3,在元素周期表中位于第三周期,图甲和图乙中的粒子质子数分别为31、7、13、16共表示4种元素,故填:S;三;4。
③最外层电子数相同,化学性质相似,镓原子与图乙中B的化学性质相似,因为它们最外层的电子数相等,最外层电子数是3,它们在化学反应中易失去电子形成离子,故填:B;Ga3+。
6.
(1) 4 金属 CD
(2) 质子数相同 不带电 不属于
【分析】
(1)根据原子结构示意图的信息、元素的分类、元素周期表的信息来分析;
(2)根据元素的概念、粒子所带电荷、原子结构来分析。
(1)
①由钛原子结构示意图可知,钛原子的核外有4个电子层,由元素名称的偏旁“钅”字可知,钛元素属于金属元素;故答案为:4;金属。
②A、在原子中,质子数=核外电子数,因此图中x的数值为22﹣2﹣8﹣2=10,故正确;
B、由钛原子结构示意图可知,钛原子的质子数为22,则其核电荷数为22,故正确;
C、由钛原子结构示意图可知,钛原子的最外层有2个电子,少于4个,因此在化学反应中,钛原子容易失去电子,故错误;
D、相对原子质量的单位不是“g”而是“1”,通常省略不写,钛原子的相对原子质量为47.87,故错误。
故选:CD。
(2)
①元素是具有相同质子数的一类原子的总称,、、三种原子均属于氢元素的原因是质子数相同;故答案为:质子数相同;
②图中粒子“”是中子,不显电性;故答案为:不带电;
③氢弹爆炸不为化学变化,因为化学变化中原子是最小粒子,原子没有破裂,而氢弹爆炸中原子破裂了;故答案为:不属于。
7.
(1)18
(2) 四 非金属
(3)O2-
(4)C
(5)D
【分析】
(1)
原子中,核电荷数=质子数=核外电子数,根据砷原子结构示意图可知:33=2+8+x+5,解得x=18,故填:18。
(2)
砷元素原子核外由四个电子层,所以砷元素位于第四周期,砷的汉字是“石”字旁,属于非金属元素,故填:四(或4);非金属。
(3)
图乙中A中质子数为8,核外电子的数目是6,在化学反应中易得到2个电子达到稳定结构,形成带有2个单位电荷的氧离子,该粒子的符号为O2-,故填:O2-。
(4)
原子的最外层电子数相同,元素原子的化学性质相似,砷原子的最外层电子数为5,图乙所示的四种粒子结构示意图中,粒子A最外层电子数为6,粒子B最外层电子数为1,粒子C最外层电子数为5,粒子D最外层电子数为8,所以与砷原子化学性质相似的是C粒子,故填:C。
(5)
最外层电子数达到8个电子(若只有一层,则最外层电子数为2),具有稳定的结构,由微观的结构示意图可知,D的质子数等于电子数,最外层电子数是8,是具有稳定结构的原子。
8.
(1) 17 质子数不同
(2) ①②,③④ 最外层电子数
(3) 12 MgCl2
【分析】
(1)
元素周期表中每一格表示的意义:左上角的数字表示原子序数,在原子中,原子序数=核电荷数=质子数=核外电子数,则氯元素原子的质子数为17;元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),氯元素和钠元素的最本质区别是核内质子数不同,故填:17;质子数不同。
(2)
元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),①②粒子的质子数均为11,属于同一种元素,③④粒子的质子数均为17,也属于同一种元素,故填:①②,③④;最外层电子数。
(3)
若⑤表示Mg2+,镁元素原子的核内质子数是12,则x= 12;④是氯离子,在化合物中化合价是-1,⑤是镁离子,在化合物中化合价是+2,根据化合物中元素化合价代数和为零可知,镁元素和氯元素形成的氯化镁的化学式是MgCl2,故填:12;MgCl2。
9.
(1)34
(2)四
(3) 得
Se2-
(4)C
(5)Na2SeO4
【分析】
(1)
原子中,质子数=核外电子数,所以P的值为2+8+18+6=34;
(2)
原子中,原子核外电子层数等于其元素所在周期数,硒原子核外有四个电子层,所以硒元素位于第四周期;
(3)
硒原子最外层有6个电子,在化学反应中容易得到2个电子形成带两个单位负电荷的硒离子,离子符号为:Se2-;
(4)
最外层电子数决定元素化学性质,硒元素的原子最外层电子数为6,所以选C;
(5)
硒酸根带两个单位负电荷,在化合物中显示-2价,钠元素为+1价,故硒酸钠的化学式为Na2SeO4。
10.
(1) 三 7
(2) C和O 一氧化碳+氧气二氧化碳
(3) BD AC 17
【解析】
(1)
由图可知,铝原子核外有三个电子层,则铝元素位于元素周期表中的第三周期,故填三;
由图可知,氮原子的原子序数为7,则氮原子的质子数与核外电子数也为7,故氮原子的结构示意图画为;
相对原子质量=质子数+中子数,由图可知,氮原子的相对原子质量的近似值为14,质子数为7,则氮原子的中子数=14 7=7,故填7。
(2)
①由图可知,反应是一氧化碳与氧气在点燃的条件下反应生成二氧化碳,化学反应中原子保持不变,则反应前后,没有发生变化的微粒是碳原子与氧原子,其符号依次为C、O,故填C和O;
②由图可知,该反应是一氧化碳与氧气在点燃的条件下反应生成二氧化碳,故反应的文字表达式写为:一氧化碳+氧气二氧化碳。
(3)
①由元素概念可知,具有相同质子数的原子属于同一种元素,A~D四种粒子中,微粒B、D的质子数均为11,属于同种元素,故填BD;
多电子层的原子,其最外层电子数为8的结构属于稳定结构,A~D四种微粒中,B、C的最外层电子数均为8,属于稳定结构,微粒A只有1个电子层,且该电子层上的电子数为2,也属于稳定结构,即A~D四种微粒中,具有相对稳定结构的微粒有A、B、C三种,其中微粒A、C的质子数与核外电子数相同,属于原子,所以A~D四种微粒中具有相对稳定结构的原子是A、C,故填AC。
②由图可知,微粒E的核外电子数为18,若E为某原子得到一个电子形成的离子,则E原子的核外电子数为17,原子中质子数等于核外电子数,则微粒E中x的值为17,故填17。
11.
(1)A
(2) 6 四
(3) DF ACF
(4)O2-
(5) 硅元素 非金属
【解析】
(1)
氦﹣3(氦﹣3是含有2个质子和1个中子的氦原子),在原子中,质子数=核外电子数,则核外有1个电子层,核外电子数为2,故填:A。
(2)
在原子中,质子数=核外电子数,则,原子的核外电子层数等于周期数,核外有4个电子层,则该元素处于元素周期表中第四周期。
(3)
质子数相同的元素属于同种元素,DF的质子数均为17,则甲图中属于同种元素的是DF,最外层电子数为8(氦元素最外层电子数为2),是相对稳定结构,则具有相对稳定结构的微粒是ACF。
(4)
C的质子数为8,质子数小于核外电子数,是氧离子,则粒子C的符号为O2-。
(5)
图乙中Y元素的原子序数为14,在原子中,质子数=原子序数,则质子数为14,故名称是硅元素,硅是石字旁,则属于非金属元素。
12.
(1) 79.90 非金属
(2)B
(3)KBr
(4) 8
【解析】
(1)
元素周期表中,元素名称正下方的数值是该元素的相对原子质量,故溴的相对原子质量是79.90,溴的偏旁是“氵”,故属于非金属元素。
(2)
最外层电子数决定元素的化学性质,溴元素的原子最外层电子数是7,故与图乙中B元素的化学性质相似。
(3)
溴元素的最外层电子数是7,在化学反应中易得到1个电子,A元素的最外层电子数是1,在化学反应中易失去1个电子,故两种元素形成的化合物中原子的个数比为1:1,书写化学式时,金属元素在左边,非金属元素在右边,故其化合物的化学式为KBr。
(4)
若图乙中C表示离子,则说明该微粒是稳定结构,即最外层电子数是8,x的值是8。该微粒的核电核数是16,为硫元素,分析该微粒的离子结构示意图可知,一个硫离子带2个单位的负电荷,故其离子符号为:。
13.
(1) 5 10.81
(2)非金属
(3) 3##三 失去 Na+
(4) 2 MgF2
(5) 18 F
【分析】
(1)
根据元素周期表中的一格可知,左上角是原子序数,汉字下方是相对原子质量,所以硼元素的原子序数是5,相对原子质量是10.81,故填:5;10.81。
(2)
氟带“气”字头,该元素属于非金属元素,故填:非金属。
(3)
钠元素原子有3个电子层,所以钠元素位于元素周期表第三周期;钠原子的最外层电子数是1,该元素在化学反应中容易失去电子,形成的钠离子,故填:3(或三);失去;Na+。
(4)
当镁原子最外层电子数是2 ,在化学反应中容易失去电子形成镁离子时,镁离子的核外共有2个电子层。镁元素和氟元素组成的化合物中镁元素的化合价为+2价,氟元素的化合价为-1价,其化学式为MgF2,故填:2(或二);MgF2。
(5)
在原子中,质子数=核外电子数,根据溴原子的原子结构示意图可知X+2+8+7 =35,解得X=18,;在外层电子数相等,则元素的化学性质相似,溴原子的最外层电子数为7,氟原子的最外层电子数也为7 ,所以与溴元素化学性质相似的是氟元素,故填:18;F。
14.
(1)32.06
(2) 8 Na2S
(3)最外层电子数
(4) 中子
【分析】
(1)
根据元素周期表可知,硫元素的相对原子质量是32.06或32;
(2)
在原子中,质子数=核外电子数,即2+x+1=11,x=8,B是质子数为11的钠元素,其化合价为+1价,C的质子数为16,是硫元素,在化合物中显-2价,二者形成的化合物的化学式为Na2S;
(3)
A和B两种微粒的最外层电子数相同,所以两种粒子的化学性质相似;
(4)
①1H、2H、3H三种原子中,左上角的数值表示的是质子数和中子数的总和,质子数和电子数相同,中子数=质量数一质子数,因此中子数目不等,故填:中子;
②由题意可知,3H2在O2中燃烧生成了3H2O,反应的化学方程式是:,由质量守恒定律可知,每2个3H2与1个O2恰好反应,所以在小方框应补充2个3H2分子,如图 。
【点睛】
15.
(1) 38 87.62 Sr2+
(2) Cl2 Al
(3)ACD
(4) 13 化合反应
【分析】
(1)
根据在原子结构中:原子序数=核电荷数=质子数=核外电子数,由锶元素的粒子结构示意图,锶原子的原子序数为38,因此一个锶原子核电荷数为38;从元素周期表一格中,正下方数字可知锶原子的相对原子质量为87.62;锶原子的原子结构示意图,最外层电子数为2,容易失去,形成锶离子,化学符号为:Sr2+。
(2)
①16号元素原子为硫原子,根据核外电子的分层排布规律,可画出硫原子的原子结构示意图为:;17号元素为氯元素,所形成的单质为氯气,氯气有氯气分子构成,每个氯气分子由两个氯原子构成,化学式为:Cl2。
②X3+与O2-核外电子排布相同,所以X3+核外有10个电子,X失去3个电子形成X3+,所以X核外有13个电子;根据在原子结构中:原子序数=核电荷数=质子数=核外电子数,所以X为13号元素,铝元素(Al)。
(3)
A、反应生成的四个分子构成相同,为同种物质的分子,即反应生成一种物质;反应物为两种单质;该反应为两种物质生成一种物质的化合反应,此选项表述不正确;
B、对比反应前后的分子,其中反应前的3个分子有1个未参加反应,因此,参加反应该分子有2个;图中的6个分子全部参加反应;所以,参加反应的“”和“”分子个数比为6:2=3:1,此选项表述正确;
C、由反应的模拟模型图可得知,反应的生成物的分子由四个原子构成,此选项表述不正确;
D、反应生成的四个分子构成相同,为同种物质的分子,而反应后的分子为未参加反应的分子、不是反应所生成的分子;因此反应的生成物只有一种,此选项表述不正确。故选ACD。
(4)
由表格信息可知反应后G质量增加了25克,是生成物;P质量减少了20克,是反应物;H质量不变,可能做催化剂,反应物还少5克,所以W是反应物,所以反应后物质W的质量为18g-5g=13g,反应物是G和P,生成物是W,所以是化合反应。
16.
(1)37
(2)Rb+
(3)5
【分析】
(1)
由题中信息可知,铷的原子序数是37;
(2)
由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。铷离子的符号表示为Rb+;
(3)
原子核外有几个电子层,元素就位于第几周期,铷原子核外有5个电子层,元素位于元素周期表的第5周期。
17.
(1)2
(2) 金属 50.94
(3) 置换反应 -1 9:20
【分析】
(1)
原子核核外电子的第一层不超过2个,故a=2,在原子中,质子数=核外电子数=核电荷数,钒原子的质子数为23,b=23-2-8-11=2;
(2)
钒属于金属元素,钒的相对原子质量为50.94;
(3)
①根据微观示意图可知,该反应为一种单质与一种化合物生成一种单质和一种化合物的反应,属于置换反应;
②根据微观示意图可知,该反应的化学方程式为:2F2+2H2O=4HF+O2,丙物质中氢元素的化合价为+1甲,氟元素的化合价为-1价;
③根据化学方程式可知,乙丙两种物质的质量比为2×(16+2):4×(19+1)=9:20。
【点睛】
18.
(1)11
(2)BC
(3)最外层电子数
(4)离子
(5) Cl- 得到
【分析】
(1)
由元素周期表中的信息可知,左上角的数字表示原子序数,则钠元素的原子序数为11。
(2)
元素是质子数相同的一类原子的总称,B、C的质子数均为17,则A、B、C中属于同种元素的粒子是BC。
(3)
由结构示意图可知,A和B两种粒子的最外层电子数为7,则A和B两种粒子的最外层电子数相同,所以它们具有相似的化学性质。
(4)
钠原子和氯原子反应所形成的化合物是氯化钠,由氯离子和钠离子构成,故钠原子和氯原子反应所形成的化合物是由离子构成的。
(5)
质子数小于核外电子数,为阴离子,A的质子数等于核外电子数,为氟原子,B的质子数等于核外电子数,为氯原子,C的质子数小于核外电子数,为氯离子,则A、B、C属于阴离子的是C,离子符号为Cl-,B粒子最外层电子数为7,大于4,则在化学变化中容易得到电子。
19.
(1)三
(2)Cl-
(3)8
(4) 47
9
(5)Na+、F-、C1-
【解析】
(1)
质子数决定元素种类,图中分别表示13号、17号和18号元素,故填:三;
(2)
阴离子的质子数少于核外电子数,所以C为阴离子,符号为Cl-;
(3)
D中核内质子数为18,所以x的值为8;
(4)
质子数决定元素种类,质子数等于原子序数,所以E中决定银元素种类的数值是47;碳原子的相对原子质量为12,银原子的相对原子质量近似为107.9,,所以,一个银原子质量约是一个碳12原子质量的9倍;
(5)
氟离子核电荷数为9,电子层数为2,钠离子的核电荷数为11,电子层数为2,氯离子的电子层数为3, 因为原子或离子的电子层数越少,半径越小;若电子层数相同,则核电荷数越小,半径越大,所以钠离子半径最小,氯离子半径最大,故三种离子半径由小到大的顺序为:Na+、F-、C1-。
20.
(1)35.45
(2)8
(3) A、C、D B和C
(4)F-
(5)②
【分析】
(1)
由题目给出的图片信息可以得知,氯元素的相对原子质量为:35.45
(2)
D是某原子的原子结构示意图,其中
(3)
A、B、C、D四种原子钟,相对稳定的是ACD,因为A中只有一个电子层,所以在达到2个电子时是稳定的结构,CD两种粒子的最外层电子数为8,达到了稳定的结构;观察核内质子数,B和C的核内质子数相同,所以属于同种元素
(4)
C中的粒子,核内质子数为9,在元素周期表中,核内质子数为9的元素是氟元素,此时其核外电子数比核内质子数多一个,所以该粒子带一个负电荷,符号即为:
(5)
原子结构示意图可以获取的信息有:核电荷数、电子层数、最外层电子数等,但无法直接看出其相对原子质量
【点睛】
本题重点在于掌握原子结构示意图,了解示意图中各个部分的表示含义答案第1页,共2页
答案第1页,共2页
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
