8.4常见的盐 (第2课时盐的化学性质 复分解反应发生的条件)同步练习 --2020-2021学年九年级化学科粤版(2012)下册(含解析)
文档属性
| 名称 | 8.4常见的盐 (第2课时盐的化学性质 复分解反应发生的条件)同步练习 --2020-2021学年九年级化学科粤版(2012)下册(含解析) |
|
|
| 格式 | zip | ||
| 文件大小 | 179.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-23 11:48:06 | ||
图片预览

文档简介
8.4 第2课时 盐的化学性质 复分解反应发生的条件
一、选择题
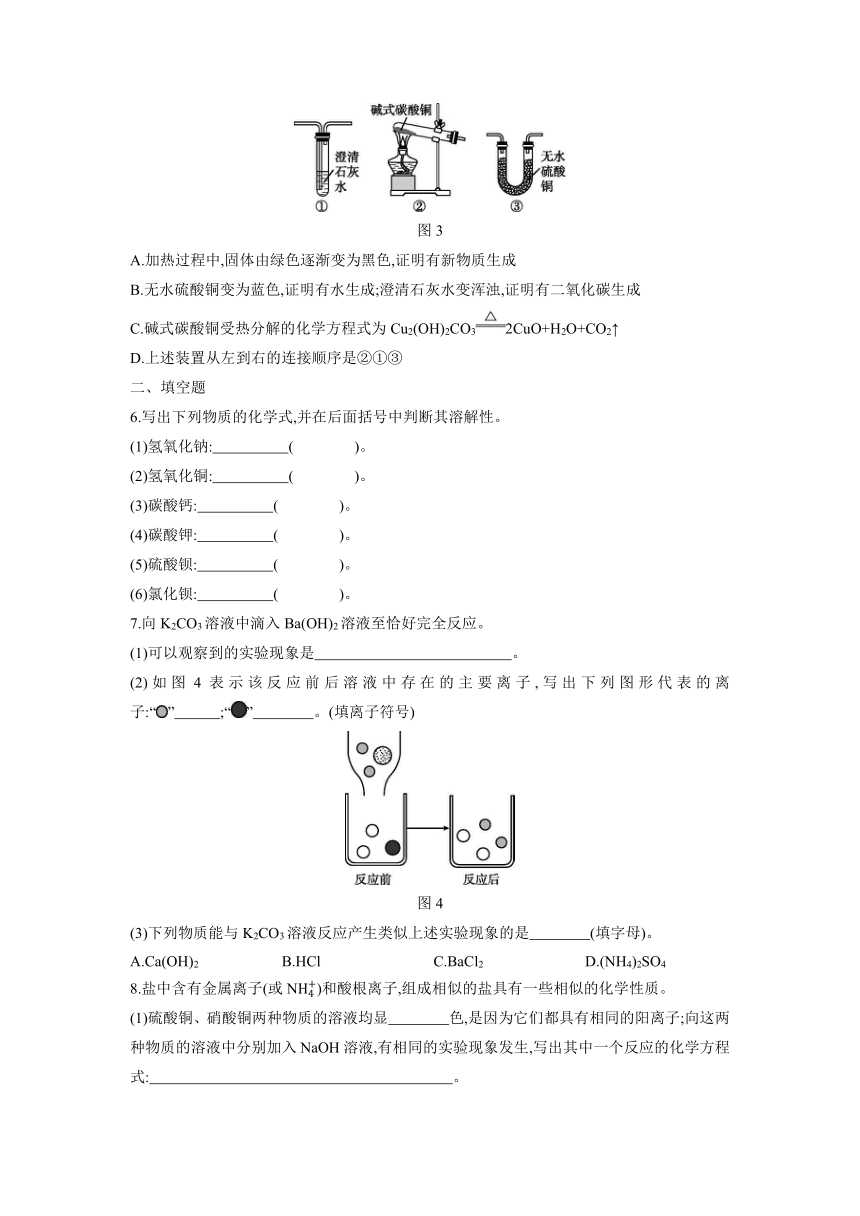
1.[2020·深圳] 小深同学用思维导图梳理了Na2CO3的相关知识,其中描述错误的是 ( )
图1
2.过氧化氢被称为“绿色氧化剂”,为了便于贮存和运输,工业上常将其转化为过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是( )
A.氯化钠 B.石灰水
C.盐酸 D.二氧化锰
3.下列有关复分解反应的说法正确的是 ( )
A.一定有沉淀生成 B.反应物为两种盐
C.元素化合价不变 D.生成物一定有水
4.向碳酸钠溶液中逐滴滴加稀盐酸至过量,该溶液中依次发生的反应如下:①Na2CO3+HClNaHCO3+NaCl;②NaHCO3+HClNaCl+H2O+CO2↑;向碳酸钠和碳酸氢钠的混合溶液中逐滴滴加稀盐酸,所产生二氧化碳的质量与所加稀盐酸的质量关系图像正确的是 ( )
图2
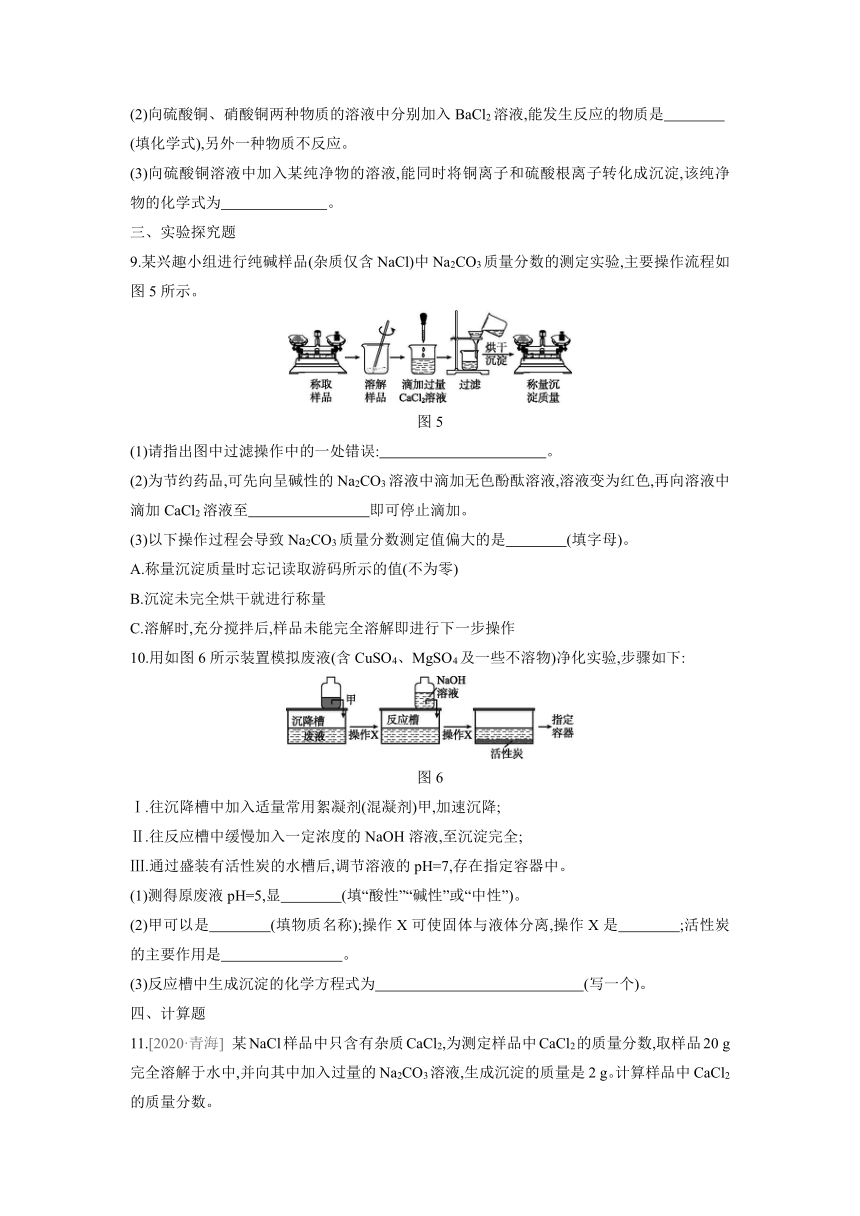
5.[2020·日照改编] 利用如图3所示装置设计实验,证明碱式碳酸铜[Cu2(OH)2CO3]受热分解有新物质生成。已知:碱式碳酸铜是绿色固体,白色无水硫酸铜遇水变为蓝色。下列说法不正确的是 ( )
图3
A.加热过程中,固体由绿色逐渐变为黑色,证明有新物质生成
B.无水硫酸铜变为蓝色,证明有水生成;澄清石灰水变浑浊,证明有二氧化碳生成
C.碱式碳酸铜受热分解的化学方程式为Cu2(OH)2CO32CuO+H2O+CO2↑
D.上述装置从左到右的连接顺序是②①③
二、填空题
6.写出下列物质的化学式,并在后面括号中判断其溶解性。
(1)氢氧化钠: ( )。
(2)氢氧化铜: ( )。
(3)碳酸钙: ( )。
(4)碳酸钾: ( )。
(5)硫酸钡: ( )。
(6)氯化钡: ( )。
7.向K2CO3溶液中滴入Ba(OH)2溶液至恰好完全反应。
(1)可以观察到的实验现象是 。
(2)如图4表示该反应前后溶液中存在的主要离子,写出下列图形代表的离子:“” ;“” 。(填离子符号)
图4
(3)下列物质能与K2CO3溶液反应产生类似上述实验现象的是 (填字母)。
A.Ca(OH)2 B.HCl C.BaCl2 D.(NH4)2SO4
8.盐中含有金属离子(或N)和酸根离子,组成相似的盐具有一些相似的化学性质。
(1)硫酸铜、硝酸铜两种物质的溶液均显 色,是因为它们都具有相同的阳离子;向这两种物质的溶液中分别加入NaOH溶液,有相同的实验现象发生,写出其中一个反应的化学方程式: 。
(2)向硫酸铜、硝酸铜两种物质的溶液中分别加入BaCl2溶液,能发生反应的物质是
(填化学式),另外一种物质不反应。
(3)向硫酸铜溶液中加入某纯净物的溶液,能同时将铜离子和硫酸根离子转化成沉淀,该纯净物的化学式为 。
三、实验探究题
9.某兴趣小组进行纯碱样品(杂质仅含NaCl)中Na2CO3质量分数的测定实验,主要操作流程如图5所示。
图5
(1)请指出图中过滤操作中的一处错误: 。
(2)为节约药品,可先向呈碱性的Na2CO3溶液中滴加无色酚酞溶液,溶液变为红色,再向溶液中滴加CaCl2溶液至 即可停止滴加。
(3)以下操作过程会导致Na2CO3质量分数测定值偏大的是 (填字母)。
A.称量沉淀质量时忘记读取游码所示的值(不为零)
B.沉淀未完全烘干就进行称量
C.溶解时,充分搅拌后,样品未能完全溶解即进行下一步操作
10.用如图6所示装置模拟废液(含CuSO4、MgSO4及一些不溶物)净化实验,步骤如下:
图6
Ⅰ.往沉降槽中加入适量常用絮凝剂(混凝剂)甲,加速沉降;
Ⅱ.往反应槽中缓慢加入一定浓度的NaOH溶液,至沉淀完全;
Ⅲ.通过盛装有活性炭的水槽后,调节溶液的pH=7,存在指定容器中。
(1)测得原废液pH=5,显 (填“酸性”“碱性”或“中性”)。
(2)甲可以是 (填物质名称);操作X可使固体与液体分离,操作X是 ;活性炭的主要作用是 。
(3)反应槽中生成沉淀的化学方程式为 (写一个)。
四、计算题
11.[2020·青海] 某NaCl样品中只含有杂质CaCl2,为测定样品中CaCl2的质量分数,取样品20 g完全溶解于水中,并向其中加入过量的Na2CO3溶液,生成沉淀的质量是2 g。计算样品中CaCl2的质量分数。
【附加题】
12.[2021·福建] 某兴趣小组为探究影响化学反应速率的因素,使用等量的同种钙片和白醋开展四组实验,分别测得产生的二氧化碳浓度随时间变化曲线如图7所示。选取CO2的浓度从0~8%为研究对象,下列对实验结果的分析,错误的是 ( )
图7
A.对比①③,温度越高,反应速率越快
B.对比②③,反应物接触面积越小,反应速率越慢
C.对比③④,反应物接触面积越大,反应速率越快
D.对比①②③④,④的反应速率最慢
答案
1.A [解析] 碳酸钠俗称纯碱或苏打,烧碱是氢氧化钠的俗称。
2.A [解析] 过碳酸钠(2Na2CO3·3H2O2)晶体具有碳酸钠和过氧化氢的双重性质,能与过氧化氢或碳酸钠反应的物质均能与过碳酸钠反应使之失效。氯化钠不与碳酸钠、过氧化氢反应,不会导致过碳酸钠晶体失效。
3.C 4.C
5.D [解析] 要先证明水的存在,再证明二氧化碳的存在,题中装置从左到右的连接顺序是②③①。
6.(1)NaOH 易溶
(2)Cu(OH)2 难溶
(3)CaCO3 难溶
(4)K2CO3 易溶
(5)BaSO4 难溶
(6)BaCl2 易溶
7.(1)有白色沉淀生成
(2)OH- C
(3)AC
8.(1)蓝
CuSO4+2NaOHCu(OH)2↓+Na2SO4[或Cu(NO3)2+2NaOHCu(OH)2↓+2NaNO3]
(2)CuSO4 (3)Ba(OH)2
[解析] (2)复分解反应发生的条件是生成物中有气体、沉淀或水,硫酸根离子和钡离子反应生成硫酸钡沉淀,所以向硫酸铜、硝酸铜两种物质的溶液中分别加入BaCl2溶液,能发生反应的物质是CuSO4,另外一种物质不反应。(3)氢氧根离子和铜离子反应生成氢氧化铜沉淀,硫酸根离子和钡离子反应生成硫酸钡沉淀,所以能同时将铜离子和硫酸根离子转化成沉淀的纯净物的化学式为Ba(OH)2。
9.(1)未用玻璃棒引流
(2)红色恰好褪去 (3)B
[解析] (2)碳酸钠溶液显碱性,能使酚酞溶液变红,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,氯化钠溶液呈中性,不能使酚酞溶液变色,所以为节约药品,可先向呈碱性的Na2CO3溶液中滴加无色酚酞溶液,溶液变为红色,再向溶液中滴加CaCl2溶液至红色恰好褪去即可停止滴加。(3)称量沉淀质量时忘记读取游码所示的值(不为零),会使读数偏小,导致测得碳酸钠的质量分数偏小;沉淀未完全烘干就进行称量,会使称得的沉淀质量偏大,导致所求碳酸钠的质量分数偏大;样品虽未完全溶解,但氯化钙溶液过量,依然能保证碳酸钠完全反应,所以测得碳酸钠的质量分数不受影响。
10.(1)酸性
(2)明矾 过滤 吸附
(3)CuSO4+2NaOHCu(OH)2↓+Na2SO4[或MgSO4+2NaOHMg(OH)2↓+Na2SO4]
11.解:设生成2 g CaCO3需要CaCl2的质量为x。
Na2CO3+CaCl22NaCl+CaCO3↓
111 100
x 2 g
= x=2.22 g
样品中CaCl2的质量分数为×100%=11.1%。
答:样品中CaCl2的质量分数为11.1%。
[解析] 根据碳酸钠与氯化钙反应的化学方程式,由碳酸钙的质量可以计算氯化钙的质量,从而可以计算样品中氯化钙的质量分数。
12.B [解析] 对比①③可看出,①③其他条件相同,只有温度不同,在相同时间内,①生成二氧化碳的浓度大于③生成二氧化碳的浓度,由此说明温度越高,反应速率越快;对比②③可看出,钙片的形状不同,温度不同,因此无法比较;对比③④可看出,③④其他条件相同,只有钙片的形状不同,在相同时间内,③生成二氧化碳的浓度大于④生成二氧化碳的浓度,由此说明反应物接触面积越大,反应速率越快;从整个图像可看出,在相同时间内④生成二氧化碳的浓度最小,反应速率最慢。
一、选择题
1.[2020·深圳] 小深同学用思维导图梳理了Na2CO3的相关知识,其中描述错误的是 ( )
图1
2.过氧化氢被称为“绿色氧化剂”,为了便于贮存和运输,工业上常将其转化为过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是( )
A.氯化钠 B.石灰水
C.盐酸 D.二氧化锰
3.下列有关复分解反应的说法正确的是 ( )
A.一定有沉淀生成 B.反应物为两种盐
C.元素化合价不变 D.生成物一定有水
4.向碳酸钠溶液中逐滴滴加稀盐酸至过量,该溶液中依次发生的反应如下:①Na2CO3+HClNaHCO3+NaCl;②NaHCO3+HClNaCl+H2O+CO2↑;向碳酸钠和碳酸氢钠的混合溶液中逐滴滴加稀盐酸,所产生二氧化碳的质量与所加稀盐酸的质量关系图像正确的是 ( )
图2
5.[2020·日照改编] 利用如图3所示装置设计实验,证明碱式碳酸铜[Cu2(OH)2CO3]受热分解有新物质生成。已知:碱式碳酸铜是绿色固体,白色无水硫酸铜遇水变为蓝色。下列说法不正确的是 ( )
图3
A.加热过程中,固体由绿色逐渐变为黑色,证明有新物质生成
B.无水硫酸铜变为蓝色,证明有水生成;澄清石灰水变浑浊,证明有二氧化碳生成
C.碱式碳酸铜受热分解的化学方程式为Cu2(OH)2CO32CuO+H2O+CO2↑
D.上述装置从左到右的连接顺序是②①③
二、填空题
6.写出下列物质的化学式,并在后面括号中判断其溶解性。
(1)氢氧化钠: ( )。
(2)氢氧化铜: ( )。
(3)碳酸钙: ( )。
(4)碳酸钾: ( )。
(5)硫酸钡: ( )。
(6)氯化钡: ( )。
7.向K2CO3溶液中滴入Ba(OH)2溶液至恰好完全反应。
(1)可以观察到的实验现象是 。
(2)如图4表示该反应前后溶液中存在的主要离子,写出下列图形代表的离子:“” ;“” 。(填离子符号)
图4
(3)下列物质能与K2CO3溶液反应产生类似上述实验现象的是 (填字母)。
A.Ca(OH)2 B.HCl C.BaCl2 D.(NH4)2SO4
8.盐中含有金属离子(或N)和酸根离子,组成相似的盐具有一些相似的化学性质。
(1)硫酸铜、硝酸铜两种物质的溶液均显 色,是因为它们都具有相同的阳离子;向这两种物质的溶液中分别加入NaOH溶液,有相同的实验现象发生,写出其中一个反应的化学方程式: 。
(2)向硫酸铜、硝酸铜两种物质的溶液中分别加入BaCl2溶液,能发生反应的物质是
(填化学式),另外一种物质不反应。
(3)向硫酸铜溶液中加入某纯净物的溶液,能同时将铜离子和硫酸根离子转化成沉淀,该纯净物的化学式为 。
三、实验探究题
9.某兴趣小组进行纯碱样品(杂质仅含NaCl)中Na2CO3质量分数的测定实验,主要操作流程如图5所示。
图5
(1)请指出图中过滤操作中的一处错误: 。
(2)为节约药品,可先向呈碱性的Na2CO3溶液中滴加无色酚酞溶液,溶液变为红色,再向溶液中滴加CaCl2溶液至 即可停止滴加。
(3)以下操作过程会导致Na2CO3质量分数测定值偏大的是 (填字母)。
A.称量沉淀质量时忘记读取游码所示的值(不为零)
B.沉淀未完全烘干就进行称量
C.溶解时,充分搅拌后,样品未能完全溶解即进行下一步操作
10.用如图6所示装置模拟废液(含CuSO4、MgSO4及一些不溶物)净化实验,步骤如下:
图6
Ⅰ.往沉降槽中加入适量常用絮凝剂(混凝剂)甲,加速沉降;
Ⅱ.往反应槽中缓慢加入一定浓度的NaOH溶液,至沉淀完全;
Ⅲ.通过盛装有活性炭的水槽后,调节溶液的pH=7,存在指定容器中。
(1)测得原废液pH=5,显 (填“酸性”“碱性”或“中性”)。
(2)甲可以是 (填物质名称);操作X可使固体与液体分离,操作X是 ;活性炭的主要作用是 。
(3)反应槽中生成沉淀的化学方程式为 (写一个)。
四、计算题
11.[2020·青海] 某NaCl样品中只含有杂质CaCl2,为测定样品中CaCl2的质量分数,取样品20 g完全溶解于水中,并向其中加入过量的Na2CO3溶液,生成沉淀的质量是2 g。计算样品中CaCl2的质量分数。
【附加题】
12.[2021·福建] 某兴趣小组为探究影响化学反应速率的因素,使用等量的同种钙片和白醋开展四组实验,分别测得产生的二氧化碳浓度随时间变化曲线如图7所示。选取CO2的浓度从0~8%为研究对象,下列对实验结果的分析,错误的是 ( )
图7
A.对比①③,温度越高,反应速率越快
B.对比②③,反应物接触面积越小,反应速率越慢
C.对比③④,反应物接触面积越大,反应速率越快
D.对比①②③④,④的反应速率最慢
答案
1.A [解析] 碳酸钠俗称纯碱或苏打,烧碱是氢氧化钠的俗称。
2.A [解析] 过碳酸钠(2Na2CO3·3H2O2)晶体具有碳酸钠和过氧化氢的双重性质,能与过氧化氢或碳酸钠反应的物质均能与过碳酸钠反应使之失效。氯化钠不与碳酸钠、过氧化氢反应,不会导致过碳酸钠晶体失效。
3.C 4.C
5.D [解析] 要先证明水的存在,再证明二氧化碳的存在,题中装置从左到右的连接顺序是②③①。
6.(1)NaOH 易溶
(2)Cu(OH)2 难溶
(3)CaCO3 难溶
(4)K2CO3 易溶
(5)BaSO4 难溶
(6)BaCl2 易溶
7.(1)有白色沉淀生成
(2)OH- C
(3)AC
8.(1)蓝
CuSO4+2NaOHCu(OH)2↓+Na2SO4[或Cu(NO3)2+2NaOHCu(OH)2↓+2NaNO3]
(2)CuSO4 (3)Ba(OH)2
[解析] (2)复分解反应发生的条件是生成物中有气体、沉淀或水,硫酸根离子和钡离子反应生成硫酸钡沉淀,所以向硫酸铜、硝酸铜两种物质的溶液中分别加入BaCl2溶液,能发生反应的物质是CuSO4,另外一种物质不反应。(3)氢氧根离子和铜离子反应生成氢氧化铜沉淀,硫酸根离子和钡离子反应生成硫酸钡沉淀,所以能同时将铜离子和硫酸根离子转化成沉淀的纯净物的化学式为Ba(OH)2。
9.(1)未用玻璃棒引流
(2)红色恰好褪去 (3)B
[解析] (2)碳酸钠溶液显碱性,能使酚酞溶液变红,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,氯化钠溶液呈中性,不能使酚酞溶液变色,所以为节约药品,可先向呈碱性的Na2CO3溶液中滴加无色酚酞溶液,溶液变为红色,再向溶液中滴加CaCl2溶液至红色恰好褪去即可停止滴加。(3)称量沉淀质量时忘记读取游码所示的值(不为零),会使读数偏小,导致测得碳酸钠的质量分数偏小;沉淀未完全烘干就进行称量,会使称得的沉淀质量偏大,导致所求碳酸钠的质量分数偏大;样品虽未完全溶解,但氯化钙溶液过量,依然能保证碳酸钠完全反应,所以测得碳酸钠的质量分数不受影响。
10.(1)酸性
(2)明矾 过滤 吸附
(3)CuSO4+2NaOHCu(OH)2↓+Na2SO4[或MgSO4+2NaOHMg(OH)2↓+Na2SO4]
11.解:设生成2 g CaCO3需要CaCl2的质量为x。
Na2CO3+CaCl22NaCl+CaCO3↓
111 100
x 2 g
= x=2.22 g
样品中CaCl2的质量分数为×100%=11.1%。
答:样品中CaCl2的质量分数为11.1%。
[解析] 根据碳酸钠与氯化钙反应的化学方程式,由碳酸钙的质量可以计算氯化钙的质量,从而可以计算样品中氯化钙的质量分数。
12.B [解析] 对比①③可看出,①③其他条件相同,只有温度不同,在相同时间内,①生成二氧化碳的浓度大于③生成二氧化碳的浓度,由此说明温度越高,反应速率越快;对比②③可看出,钙片的形状不同,温度不同,因此无法比较;对比③④可看出,③④其他条件相同,只有钙片的形状不同,在相同时间内,③生成二氧化碳的浓度大于④生成二氧化碳的浓度,由此说明反应物接触面积越大,反应速率越快;从整个图像可看出,在相同时间内④生成二氧化碳的浓度最小,反应速率最慢。
