从微观结构看物质的多样性
图片预览








文档简介
(共26张PPT)
一、同素异形现象
1、同素异形现象:
同一种元素能够形成几种不同的单质的现象
2、同素异形体:
同种元素形成的不同单质之间互称为同素异形体
金刚石、石墨、纳米碳管、足球烯……
⑴碳的同素异形体
⑵氧的同素异形体
氧气、臭氧
⑶磷的同素异形体
白磷、红磷
氧气和臭氧
颜色 气味 氧化性
氧气
臭氧
无色
无味
强
淡蓝色
鱼腥味
极强
性质的差异是由于分子中氧原子的个数和氧
原子的成键方式不同造成的
3O2===2O3
放电
臭氧层的作用:吸收紫外线
臭氧层上部:氧气吸收波长较短的紫外线
变成臭氧
臭氧层下部:臭氧吸收波长较长的紫外线
变成氧气
蜡状固体、剧毒、自燃
红棕色固体、稳定存在、加热或点燃时燃烧
隔绝空气加热到260℃
红磷 白磷
隔绝空气加热到416℃迅速冷却
二、同分异构现象
1、同分异构现象
化合物具有相同的分子式,但具有不同结构的现象
2、同分异构体
分子式相同而结构不同的化合物互称为同分异构体
同分异构体的广泛存在,是有机化合物种类
繁多的原因之一,那么,在有机化合物中,
主要是什么原子的结构不同出现了同分异构
现象?
碳原子最外层有4个电子,能形成四个共价键,
碳原子之间可有单键、双键、叁键
碳原子可形成链状或环状
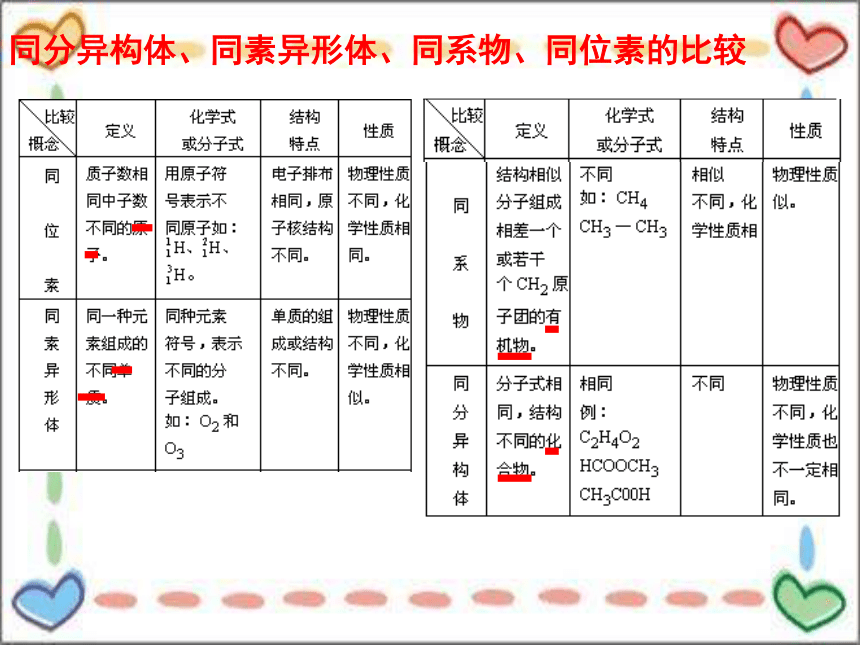
同分异构体、同素异形体、同系物、同位素的比较
烷烃同分异构体的书写
写出C5H12的同分异构体。
步骤:①写出碳原子依次相连(最长碳链)的分子结构简式。
②逐一缩短碳链(支链数依次增加)支链位置由边到心变化。
CH3-CH-CH2-CH3
CH3
CH3
CH3-C-CH3
CH3
书写规则:主链由长到短,支链由整到散,
位置由边到心,排列由邻到间、对
最后用氢原子饱和。
CH3-CH2-CH2-CH2-CH3
---像上述这些通过结晶过程形成规则的几何外形的固体物质,称为晶体。
晶体的概念
三、不同类型的晶体
[思考1]:NaCl晶体中存在哪些微粒?如何结合成晶体的?
Cl-
Na+
[小结]:在NaCl晶体中, (填存在或不存在)分子,存在许多 离子和 离子,以 键相结合,阴阳离子的个数比为 ,因此NaCl表示的含义是 。
不存在
Na+
Cl-
离子
1:1
离子化合物中的阴、阳离子(通过离子键)按一定的方式有规则地排列而形成的晶体。
1、离子晶体
晶体中钠离子与氯离子个数比为1:1
哪些物质可形成离子晶体?
强碱、部分金属氧化物、部分盐类
[思考2]:干冰晶体中存在哪些微粒?如何结合成晶体的?
2、分子晶体
——分子间通过分子间作用力按一定规则排列而成的晶体。
只有分子晶体才有真正的分子式
哪些物质可以形成分子晶体?
多数非金属单质(卤素、氧气、等 )
稀有气体(如氦,氖,氩)
非金属氢化物(如氨,氯化氢)
多数非金属氧化物(如CO2、SO2)等。
[思考3]:金刚石晶体中存在哪些微粒?如何结合成晶体的?
3、原子晶体
相邻原子通过共价键结合而形成空间网状结构的晶体。
晶
体
硅
180
109 28
Si
o
共价键
哪些物质可以形成原子晶体?
少数非金属单质(晶体硅、金刚石等 )
少数共价化合物(如SiC、SiO2)等。
晶体分类:
--根据构成晶体的粒子种类及粒子间的相互作用。晶体分为离子晶体、分子晶体、原子晶体、金属晶体。
离子晶体 分子晶体 原子晶体 *金属晶体
构成微粒
作用力类型
熔沸点
硬度
不同类型晶体
熔沸点高低顺序
晶体 > 晶体 > 晶体
阴、阳离子
离子键
分子
分子间作用力
原子
共价键
金属阳离子和自由电子
金属键
较高
较低
很高
变化范围大
较硬
硬度小
很硬
变化范围大
原子
离子
分子
归纳各类晶体的结构与性质的特点
晶体熔点的比较
1、分析晶体类型:一般情况下,
原子晶体>离子晶体>分子晶体
2、原子晶体、离子晶体、金属晶体与相应的化学键有关。
即:微粒半径越小,化学键越强,熔沸点越高。
3、分子晶体与分子间作用力成正比。
即:相对分子质量越大,分子间作用力越强,熔沸点越高。(HF、H2O、NH3?)
2、下列各组物质发生状态变化所克服的粒子间作用力属于同种类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
1、判断下列晶体所属的晶体类型?
蔗糖、 冰、 铁、 BaSO4、 金刚石、
冰醋酸、 尿素、 水晶、 Na2O
C
课 堂 练 习
3、分析物质的物理性质,判断其晶体类型:
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电;___________
B、溴化铝,无色晶体,熔点98 ℃,熔融态不导电;___________
C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中;_______________
D、物质A,无色晶体,熔融时或溶于水中都能导电_____________
原子晶体
分子晶体
分子晶体
离子晶体
一、同素异形现象
1、同素异形现象:
同一种元素能够形成几种不同的单质的现象
2、同素异形体:
同种元素形成的不同单质之间互称为同素异形体
金刚石、石墨、纳米碳管、足球烯……
⑴碳的同素异形体
⑵氧的同素异形体
氧气、臭氧
⑶磷的同素异形体
白磷、红磷
氧气和臭氧
颜色 气味 氧化性
氧气
臭氧
无色
无味
强
淡蓝色
鱼腥味
极强
性质的差异是由于分子中氧原子的个数和氧
原子的成键方式不同造成的
3O2===2O3
放电
臭氧层的作用:吸收紫外线
臭氧层上部:氧气吸收波长较短的紫外线
变成臭氧
臭氧层下部:臭氧吸收波长较长的紫外线
变成氧气
蜡状固体、剧毒、自燃
红棕色固体、稳定存在、加热或点燃时燃烧
隔绝空气加热到260℃
红磷 白磷
隔绝空气加热到416℃迅速冷却
二、同分异构现象
1、同分异构现象
化合物具有相同的分子式,但具有不同结构的现象
2、同分异构体
分子式相同而结构不同的化合物互称为同分异构体
同分异构体的广泛存在,是有机化合物种类
繁多的原因之一,那么,在有机化合物中,
主要是什么原子的结构不同出现了同分异构
现象?
碳原子最外层有4个电子,能形成四个共价键,
碳原子之间可有单键、双键、叁键
碳原子可形成链状或环状
同分异构体、同素异形体、同系物、同位素的比较
烷烃同分异构体的书写
写出C5H12的同分异构体。
步骤:①写出碳原子依次相连(最长碳链)的分子结构简式。
②逐一缩短碳链(支链数依次增加)支链位置由边到心变化。
CH3-CH-CH2-CH3
CH3
CH3
CH3-C-CH3
CH3
书写规则:主链由长到短,支链由整到散,
位置由边到心,排列由邻到间、对
最后用氢原子饱和。
CH3-CH2-CH2-CH2-CH3
---像上述这些通过结晶过程形成规则的几何外形的固体物质,称为晶体。
晶体的概念
三、不同类型的晶体
[思考1]:NaCl晶体中存在哪些微粒?如何结合成晶体的?
Cl-
Na+
[小结]:在NaCl晶体中, (填存在或不存在)分子,存在许多 离子和 离子,以 键相结合,阴阳离子的个数比为 ,因此NaCl表示的含义是 。
不存在
Na+
Cl-
离子
1:1
离子化合物中的阴、阳离子(通过离子键)按一定的方式有规则地排列而形成的晶体。
1、离子晶体
晶体中钠离子与氯离子个数比为1:1
哪些物质可形成离子晶体?
强碱、部分金属氧化物、部分盐类
[思考2]:干冰晶体中存在哪些微粒?如何结合成晶体的?
2、分子晶体
——分子间通过分子间作用力按一定规则排列而成的晶体。
只有分子晶体才有真正的分子式
哪些物质可以形成分子晶体?
多数非金属单质(卤素、氧气、等 )
稀有气体(如氦,氖,氩)
非金属氢化物(如氨,氯化氢)
多数非金属氧化物(如CO2、SO2)等。
[思考3]:金刚石晶体中存在哪些微粒?如何结合成晶体的?
3、原子晶体
相邻原子通过共价键结合而形成空间网状结构的晶体。
晶
体
硅
180
109 28
Si
o
共价键
哪些物质可以形成原子晶体?
少数非金属单质(晶体硅、金刚石等 )
少数共价化合物(如SiC、SiO2)等。
晶体分类:
--根据构成晶体的粒子种类及粒子间的相互作用。晶体分为离子晶体、分子晶体、原子晶体、金属晶体。
离子晶体 分子晶体 原子晶体 *金属晶体
构成微粒
作用力类型
熔沸点
硬度
不同类型晶体
熔沸点高低顺序
晶体 > 晶体 > 晶体
阴、阳离子
离子键
分子
分子间作用力
原子
共价键
金属阳离子和自由电子
金属键
较高
较低
很高
变化范围大
较硬
硬度小
很硬
变化范围大
原子
离子
分子
归纳各类晶体的结构与性质的特点
晶体熔点的比较
1、分析晶体类型:一般情况下,
原子晶体>离子晶体>分子晶体
2、原子晶体、离子晶体、金属晶体与相应的化学键有关。
即:微粒半径越小,化学键越强,熔沸点越高。
3、分子晶体与分子间作用力成正比。
即:相对分子质量越大,分子间作用力越强,熔沸点越高。(HF、H2O、NH3?)
2、下列各组物质发生状态变化所克服的粒子间作用力属于同种类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
1、判断下列晶体所属的晶体类型?
蔗糖、 冰、 铁、 BaSO4、 金刚石、
冰醋酸、 尿素、 水晶、 Na2O
C
课 堂 练 习
3、分析物质的物理性质,判断其晶体类型:
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电;___________
B、溴化铝,无色晶体,熔点98 ℃,熔融态不导电;___________
C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中;_______________
D、物质A,无色晶体,熔融时或溶于水中都能导电_____________
原子晶体
分子晶体
分子晶体
离子晶体
