6.3物质的溶解性(第3课时结晶)同步练习--2020-2021学年九年级化学沪教版(全国)下册(含解析)
文档属性
| 名称 | 6.3物质的溶解性(第3课时结晶)同步练习--2020-2021学年九年级化学沪教版(全国)下册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 182.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-23 16:51:29 | ||
图片预览


文档简介
第6章 第3节 第3课时 结晶
一、选择题
1.我国海水晒盐具有悠久的历史,所得“盐”的主要成分是 ( )
A.Na2SO4 B.NaCl C.CaCl2 D.Na2CO3
2.下列各组物质可按溶解、过滤、蒸发的操作顺序,将它们分离的是 ( )
A.酒精和水 B.氯化钾和二氧化锰
C.氯化钠和硝酸钾 D.铁粉和铜粉
3.大量硝酸钾固体中混有少量的氯化钠,常采用降温结晶的方式除杂,氯化钠不析出的原因是 ( )
A.氯化钠在降温时其溶解度反而增大
B.氯化钠量少,在降温时形成的仍是不饱和溶液
C.氯化钠的溶解度随温度的降低变化较大
D.硝酸钾的溶解度比氯化钠大
4.一杯70 ℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比 ( )
A.溶质的质量分数减小 B.溶质质量不变
C.溶液质量不变 D.由饱和溶液变为不饱和溶液
5.[2020·山西] 小明自制了一杯蔗糖水(无固体剩余),用于缓解运动后出现的低血糖症状,之后他结合下表蔗糖的溶解度数据,归纳出以下问题,其中正确的是 ( )
温度/℃ 0 10 20 40 60 80 100
溶解度/g 182 191 204 238 287 362 487
A.配制的蔗糖溶液下层比上层甜
B.降温,糖水中一定有晶体析出
C.20 ℃时,蔗糖饱和溶液质量一定为304 g
D.升温,糖水中蔗糖的质量分数不变
6.甲、乙的溶解度曲线如图1所示(不考虑水的变化)。下列说法正确的是( )
图1
A.依据溶解度曲线可判断,甲的溶解度比乙的大
B.t2 ℃时,甲的饱和溶液中溶质的质量分数为40%
C.t2 ℃时,将甲、乙的饱和溶液分别降温到t1 ℃,析出晶体甲的质量大
D.t1 ℃时,将甲、乙的饱和溶液分别升温到t2 ℃,两溶液中溶质的质量分数相等
7.甲、乙两种均不含结晶水的固体物质(设它们从溶液中析出时也都不含结晶水)的溶解度曲线如图2所示。下列说法正确的是 ( )
图2
A.t1 ℃时,将甲、乙各17 g分别加入50 g水中,所得两溶液的质量相等
B.将甲、乙两种溶液由t3 ℃降温至t2 ℃,所得两溶液中溶质的质量分数一定相等
C.若甲中混有少量的乙,可先配制较高温度下甲的饱和溶液,再采用降温结晶的方法提纯甲
D.将t3 ℃时甲的饱和溶液100 g降温至t1 ℃,析出甲的质量是59.4 g
8.在t ℃时,将某物质的水溶液分成3份,分别加热蒸发,然后再冷却至t ℃。已知3份溶液中蒸发掉的水分别为10 g、20 g、40 g,而析出的溶质分别为a g、b g、c g(a、b、c均不为0),则a、b、c三者的关系一定正确的是 ( )
A.c=3b-2a B.c=a+2b
C.c=2b D.c=2a+b
二、填空题
9.[2020·鄂州] A、B、C三种固体物质的溶解度曲线如图3所示,请回答下列问题。
(1)t3 ℃时,A、B、C三种物质的溶解度由大到小的顺序是 。
(2)t2 ℃时,配制140 g A物质的饱和溶液需要A物质的质量是 g。
图3
(3)现有t1 ℃接近饱和的C溶液,在不改变溶液中溶质质量分数的前提下,要使其变为饱和溶液,可采取的一种措施是 。
(4)若B中含有少量的A物质,可采用 的方法提纯B。
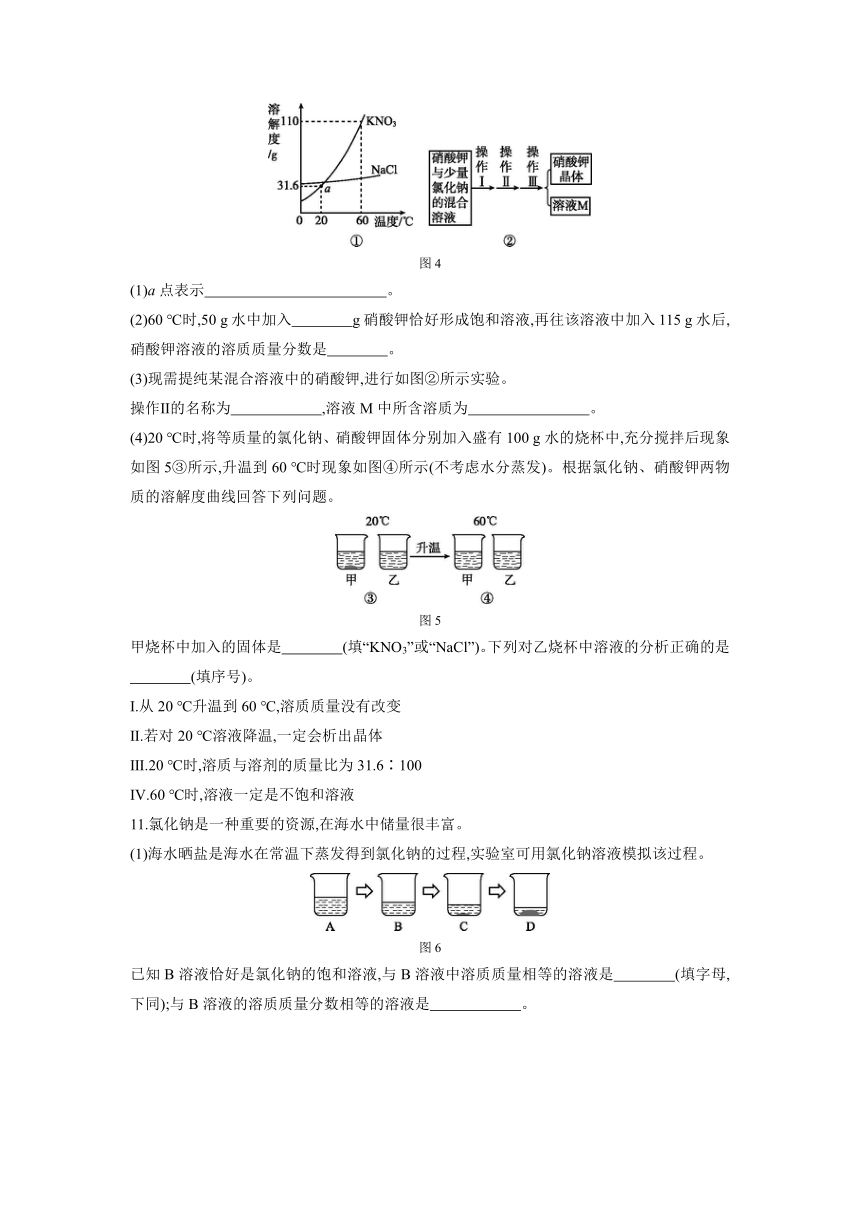
10.氯化钠、硝酸钾两物质的溶解度曲线如图4①所示。
图4
(1)a点表示 。
(2)60 ℃时,50 g水中加入 g硝酸钾恰好形成饱和溶液,再往该溶液中加入115 g水后,硝酸钾溶液的溶质质量分数是 。
(3)现需提纯某混合溶液中的硝酸钾,进行如图②所示实验。
操作Ⅱ的名称为 ,溶液M中所含溶质为 。
(4)20 ℃时,将等质量的氯化钠、硝酸钾固体分别加入盛有100 g水的烧杯中,充分搅拌后现象如图5③所示,升温到60 ℃时现象如图④所示(不考虑水分蒸发)。根据氯化钠、硝酸钾两物质的溶解度曲线回答下列问题。
图5
甲烧杯中加入的固体是 (填“KNO3”或“NaCl”)。下列对乙烧杯中溶液的分析正确的是
(填序号)。
Ⅰ.从20 ℃升温到60 ℃,溶质质量没有改变
Ⅱ.若对20 ℃溶液降温,一定会析出晶体
Ⅲ.20 ℃时,溶质与溶剂的质量比为31.6∶100
Ⅳ.60 ℃时,溶液一定是不饱和溶液
11.氯化钠是一种重要的资源,在海水中储量很丰富。
(1)海水晒盐是海水在常温下蒸发得到氯化钠的过程,实验室可用氯化钠溶液模拟该过程。
图6
已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质质量相等的溶液是 (填字母,下同);与B溶液的溶质质量分数相等的溶液是 。
图7
(2)氯化钠、硝酸钾、硒酸镉的溶解度曲线如图7所示。据图回答:溶解度受温度变化影响最大的是 ;溶解度受温度变化影响最小的是 。t ℃时,将25 g硒酸镉加入
g水中,完全溶解后,恰好得到饱和溶液。要进一步增大该溶液的溶质质量分数,可进行的操作是 。
(3)硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是 。
附加题
12.[2020·南通] 将200 g溶有物质M的溶液从95 ℃降低到10 ℃,不同温度时析出溶质M的质量如下表所示。下列说法正确的是 ( )
温度/℃ 95 90 80 30 10
析出M的质量/g 0 0 15 100 116
A.95 ℃时该溶液为饱和溶液
B.M的溶解度随温度的升高而减小
C.30 ℃时析出M后所得溶液中含100 g水
D.从M的不饱和溶液中析出M可采用先蒸发溶剂、再冷却结晶的方法
13.[2020·成都改编] 从含有硝酸钾、少量氯化钠和不溶性杂质(泥沙)的混合物中得到硝酸钾的流程如图8所示。
图8
(1)结合下表分析,趁热过滤的原因是 。
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
KNO3 13.3 31.6 63.9 110 169
(2)操作a的名称是 。
(3)滤液2的溶质是 。
答案
1.B 2.B 3.B 4.A
5.D [解析] 溶液具有均一性,配制的蔗糖溶液下层和上层一样甜;该蔗糖水(无固体剩余),可能是不饱和溶液,降温,糖水中不一定有晶体析出;20 ℃时,蔗糖的溶解度为204 g,含义是20 ℃时,100 g水中最多能溶解蔗糖204 g,形成饱和溶液304 g,但选项说法中没有指明溶剂的质量;蔗糖的溶解度随着温度的升高而增大,升温,蔗糖的溶解度增大,但溶液的组成没有发生改变,糖水中蔗糖的质量分数不变。
6.D [解析] 不指明温度,无法比较物质的溶解度大小;t2 ℃时,甲物质的溶解度是40 g,所以甲的饱和溶液中溶质的质量分数为×100%≠40%;t2 ℃时,甲、乙的饱和溶液的质量不确定,所以分别降温到t1 ℃,析出晶体的质量不能确定;t1 ℃时,将甲、乙的饱和溶液分别升温到t2 ℃,两物质的溶解度均增大,溶质、溶剂质量均不会改变,所以两溶液中溶质的质量分数相等。
7.C [解析] t1 ℃时,甲的溶解度为31.6 g,乙的溶解度比甲大,所以将甲、乙各17 g分别加入50 g水中,充分搅拌,溶解的乙物质比甲多,因此所得两溶液的质量不相等;甲、乙溶液的状态不能确定,所以由t3 ℃降温至t2 ℃,所得两溶液中溶质的质量分数不一定相等;甲的溶解度受温度影响大,乙的溶解度受温度影响不大,若甲中混有少量的乙,可先配制较高温度下甲的饱和溶液,再采用降温结晶的方法提纯甲;将t3 ℃时甲的饱和溶液191 g降温至t1 ℃,析出甲的质量是91 g-31.6 g=59.4 g。
8.A [解析] 蒸发10 g水析出晶体后一定是饱和溶液,则饱和溶液中,10 g水溶解b g-a g物质恰好饱和,30 g水溶解3(b g-a g)物质恰好饱和,根据题意有c g-a g=3(b g-a g),即c=3b-2a。
9.(1)A>B>C
(2)40
(3)升高温度
(4)蒸发结晶
[解析] (3)蒸发溶剂、增加溶质能使不饱和溶液转化为饱和溶液,但会增大溶液中溶质质量分数,在不改变溶液中溶质质量分数的前提下,应采取升高温度的方法。(4)A溶解度受温度变化影响较大,B溶解度受温度变化影响较小,若B中含有少量的A物质,可采用蒸发结晶的方法提纯B。
10.(1)20 ℃时,硝酸钾的溶解度是31.6 g
(2)55 25%
(3)降温结晶 硝酸钾和氯化钠
(4)KNO3 Ⅰ、Ⅳ
[解析] (4)20 ℃时,氯化钠的溶解度大于硝酸钾的溶解度,所以20 ℃时将等质量的氯化钠、硝酸钾固体分别加入盛有100 g水的烧杯中,充分搅拌后有剩余固体的是硝酸钾。由图示可知:20 ℃时乙烧杯中氯化钠完全溶解,而氯化钠的溶解度随温度升高而增大,所以从20 ℃升温到60 ℃,溶质质量没有改变;将溶液从20 ℃降温,由于不知所加溶质质量且未说明所降温度的多少,所以降温不一定会析出晶体;20 ℃时甲烧杯中硝酸钾有剩余,则加入固体的质量应大于31.6 g,乙烧杯中溶质与溶剂的质量比不确定;氯化钠的溶解度随温度升高而增大,所以升温到60 ℃时,乙烧杯中溶液一定是不饱和溶液。
11.(1)A CD
(2)硝酸钾 氯化钠 50 降低温度并加入硒酸镉(合理即可)
(3)降温结晶(或冷却热饱和溶液)
12.D [解析] 将200 g溶有物质M的溶液从95 ℃降低到90 ℃,没有晶体析出,说明95 ℃时该溶液为不饱和溶液;将200 g溶有物质M的溶液从95 ℃降低到10 ℃的过程中,逐渐析出晶体,说明M的溶解度随温度的升高而增大,随温度的降低而减小;30 ℃时析出100 g M,所得溶液的质量为100 g;M的溶解度随温度的降低而减小,从M的不饱和溶液中析出M可采用先蒸发溶剂、再冷却结晶的方法。
13.(1)防止溶液中的硝酸钾析出,减少硝酸钾的损失
(2)降温结晶 (3)氯化钠、硝酸钾
[解析] (1)硝酸钾的溶解度受温度的影响较大,随温度的升高而增大,趁热过滤的原因是使硝酸钾尽量完全溶解在溶液中,防止溶液中的硝酸钾析出,减少硝酸钾的损失。
一、选择题
1.我国海水晒盐具有悠久的历史,所得“盐”的主要成分是 ( )
A.Na2SO4 B.NaCl C.CaCl2 D.Na2CO3
2.下列各组物质可按溶解、过滤、蒸发的操作顺序,将它们分离的是 ( )
A.酒精和水 B.氯化钾和二氧化锰
C.氯化钠和硝酸钾 D.铁粉和铜粉
3.大量硝酸钾固体中混有少量的氯化钠,常采用降温结晶的方式除杂,氯化钠不析出的原因是 ( )
A.氯化钠在降温时其溶解度反而增大
B.氯化钠量少,在降温时形成的仍是不饱和溶液
C.氯化钠的溶解度随温度的降低变化较大
D.硝酸钾的溶解度比氯化钠大
4.一杯70 ℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比 ( )
A.溶质的质量分数减小 B.溶质质量不变
C.溶液质量不变 D.由饱和溶液变为不饱和溶液
5.[2020·山西] 小明自制了一杯蔗糖水(无固体剩余),用于缓解运动后出现的低血糖症状,之后他结合下表蔗糖的溶解度数据,归纳出以下问题,其中正确的是 ( )
温度/℃ 0 10 20 40 60 80 100
溶解度/g 182 191 204 238 287 362 487
A.配制的蔗糖溶液下层比上层甜
B.降温,糖水中一定有晶体析出
C.20 ℃时,蔗糖饱和溶液质量一定为304 g
D.升温,糖水中蔗糖的质量分数不变
6.甲、乙的溶解度曲线如图1所示(不考虑水的变化)。下列说法正确的是( )
图1
A.依据溶解度曲线可判断,甲的溶解度比乙的大
B.t2 ℃时,甲的饱和溶液中溶质的质量分数为40%
C.t2 ℃时,将甲、乙的饱和溶液分别降温到t1 ℃,析出晶体甲的质量大
D.t1 ℃时,将甲、乙的饱和溶液分别升温到t2 ℃,两溶液中溶质的质量分数相等
7.甲、乙两种均不含结晶水的固体物质(设它们从溶液中析出时也都不含结晶水)的溶解度曲线如图2所示。下列说法正确的是 ( )
图2
A.t1 ℃时,将甲、乙各17 g分别加入50 g水中,所得两溶液的质量相等
B.将甲、乙两种溶液由t3 ℃降温至t2 ℃,所得两溶液中溶质的质量分数一定相等
C.若甲中混有少量的乙,可先配制较高温度下甲的饱和溶液,再采用降温结晶的方法提纯甲
D.将t3 ℃时甲的饱和溶液100 g降温至t1 ℃,析出甲的质量是59.4 g
8.在t ℃时,将某物质的水溶液分成3份,分别加热蒸发,然后再冷却至t ℃。已知3份溶液中蒸发掉的水分别为10 g、20 g、40 g,而析出的溶质分别为a g、b g、c g(a、b、c均不为0),则a、b、c三者的关系一定正确的是 ( )
A.c=3b-2a B.c=a+2b
C.c=2b D.c=2a+b
二、填空题
9.[2020·鄂州] A、B、C三种固体物质的溶解度曲线如图3所示,请回答下列问题。
(1)t3 ℃时,A、B、C三种物质的溶解度由大到小的顺序是 。
(2)t2 ℃时,配制140 g A物质的饱和溶液需要A物质的质量是 g。
图3
(3)现有t1 ℃接近饱和的C溶液,在不改变溶液中溶质质量分数的前提下,要使其变为饱和溶液,可采取的一种措施是 。
(4)若B中含有少量的A物质,可采用 的方法提纯B。
10.氯化钠、硝酸钾两物质的溶解度曲线如图4①所示。
图4
(1)a点表示 。
(2)60 ℃时,50 g水中加入 g硝酸钾恰好形成饱和溶液,再往该溶液中加入115 g水后,硝酸钾溶液的溶质质量分数是 。
(3)现需提纯某混合溶液中的硝酸钾,进行如图②所示实验。
操作Ⅱ的名称为 ,溶液M中所含溶质为 。
(4)20 ℃时,将等质量的氯化钠、硝酸钾固体分别加入盛有100 g水的烧杯中,充分搅拌后现象如图5③所示,升温到60 ℃时现象如图④所示(不考虑水分蒸发)。根据氯化钠、硝酸钾两物质的溶解度曲线回答下列问题。
图5
甲烧杯中加入的固体是 (填“KNO3”或“NaCl”)。下列对乙烧杯中溶液的分析正确的是
(填序号)。
Ⅰ.从20 ℃升温到60 ℃,溶质质量没有改变
Ⅱ.若对20 ℃溶液降温,一定会析出晶体
Ⅲ.20 ℃时,溶质与溶剂的质量比为31.6∶100
Ⅳ.60 ℃时,溶液一定是不饱和溶液
11.氯化钠是一种重要的资源,在海水中储量很丰富。
(1)海水晒盐是海水在常温下蒸发得到氯化钠的过程,实验室可用氯化钠溶液模拟该过程。
图6
已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质质量相等的溶液是 (填字母,下同);与B溶液的溶质质量分数相等的溶液是 。
图7
(2)氯化钠、硝酸钾、硒酸镉的溶解度曲线如图7所示。据图回答:溶解度受温度变化影响最大的是 ;溶解度受温度变化影响最小的是 。t ℃时,将25 g硒酸镉加入
g水中,完全溶解后,恰好得到饱和溶液。要进一步增大该溶液的溶质质量分数,可进行的操作是 。
(3)硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是 。
附加题
12.[2020·南通] 将200 g溶有物质M的溶液从95 ℃降低到10 ℃,不同温度时析出溶质M的质量如下表所示。下列说法正确的是 ( )
温度/℃ 95 90 80 30 10
析出M的质量/g 0 0 15 100 116
A.95 ℃时该溶液为饱和溶液
B.M的溶解度随温度的升高而减小
C.30 ℃时析出M后所得溶液中含100 g水
D.从M的不饱和溶液中析出M可采用先蒸发溶剂、再冷却结晶的方法
13.[2020·成都改编] 从含有硝酸钾、少量氯化钠和不溶性杂质(泥沙)的混合物中得到硝酸钾的流程如图8所示。
图8
(1)结合下表分析,趁热过滤的原因是 。
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
KNO3 13.3 31.6 63.9 110 169
(2)操作a的名称是 。
(3)滤液2的溶质是 。
答案
1.B 2.B 3.B 4.A
5.D [解析] 溶液具有均一性,配制的蔗糖溶液下层和上层一样甜;该蔗糖水(无固体剩余),可能是不饱和溶液,降温,糖水中不一定有晶体析出;20 ℃时,蔗糖的溶解度为204 g,含义是20 ℃时,100 g水中最多能溶解蔗糖204 g,形成饱和溶液304 g,但选项说法中没有指明溶剂的质量;蔗糖的溶解度随着温度的升高而增大,升温,蔗糖的溶解度增大,但溶液的组成没有发生改变,糖水中蔗糖的质量分数不变。
6.D [解析] 不指明温度,无法比较物质的溶解度大小;t2 ℃时,甲物质的溶解度是40 g,所以甲的饱和溶液中溶质的质量分数为×100%≠40%;t2 ℃时,甲、乙的饱和溶液的质量不确定,所以分别降温到t1 ℃,析出晶体的质量不能确定;t1 ℃时,将甲、乙的饱和溶液分别升温到t2 ℃,两物质的溶解度均增大,溶质、溶剂质量均不会改变,所以两溶液中溶质的质量分数相等。
7.C [解析] t1 ℃时,甲的溶解度为31.6 g,乙的溶解度比甲大,所以将甲、乙各17 g分别加入50 g水中,充分搅拌,溶解的乙物质比甲多,因此所得两溶液的质量不相等;甲、乙溶液的状态不能确定,所以由t3 ℃降温至t2 ℃,所得两溶液中溶质的质量分数不一定相等;甲的溶解度受温度影响大,乙的溶解度受温度影响不大,若甲中混有少量的乙,可先配制较高温度下甲的饱和溶液,再采用降温结晶的方法提纯甲;将t3 ℃时甲的饱和溶液191 g降温至t1 ℃,析出甲的质量是91 g-31.6 g=59.4 g。
8.A [解析] 蒸发10 g水析出晶体后一定是饱和溶液,则饱和溶液中,10 g水溶解b g-a g物质恰好饱和,30 g水溶解3(b g-a g)物质恰好饱和,根据题意有c g-a g=3(b g-a g),即c=3b-2a。
9.(1)A>B>C
(2)40
(3)升高温度
(4)蒸发结晶
[解析] (3)蒸发溶剂、增加溶质能使不饱和溶液转化为饱和溶液,但会增大溶液中溶质质量分数,在不改变溶液中溶质质量分数的前提下,应采取升高温度的方法。(4)A溶解度受温度变化影响较大,B溶解度受温度变化影响较小,若B中含有少量的A物质,可采用蒸发结晶的方法提纯B。
10.(1)20 ℃时,硝酸钾的溶解度是31.6 g
(2)55 25%
(3)降温结晶 硝酸钾和氯化钠
(4)KNO3 Ⅰ、Ⅳ
[解析] (4)20 ℃时,氯化钠的溶解度大于硝酸钾的溶解度,所以20 ℃时将等质量的氯化钠、硝酸钾固体分别加入盛有100 g水的烧杯中,充分搅拌后有剩余固体的是硝酸钾。由图示可知:20 ℃时乙烧杯中氯化钠完全溶解,而氯化钠的溶解度随温度升高而增大,所以从20 ℃升温到60 ℃,溶质质量没有改变;将溶液从20 ℃降温,由于不知所加溶质质量且未说明所降温度的多少,所以降温不一定会析出晶体;20 ℃时甲烧杯中硝酸钾有剩余,则加入固体的质量应大于31.6 g,乙烧杯中溶质与溶剂的质量比不确定;氯化钠的溶解度随温度升高而增大,所以升温到60 ℃时,乙烧杯中溶液一定是不饱和溶液。
11.(1)A CD
(2)硝酸钾 氯化钠 50 降低温度并加入硒酸镉(合理即可)
(3)降温结晶(或冷却热饱和溶液)
12.D [解析] 将200 g溶有物质M的溶液从95 ℃降低到90 ℃,没有晶体析出,说明95 ℃时该溶液为不饱和溶液;将200 g溶有物质M的溶液从95 ℃降低到10 ℃的过程中,逐渐析出晶体,说明M的溶解度随温度的升高而增大,随温度的降低而减小;30 ℃时析出100 g M,所得溶液的质量为100 g;M的溶解度随温度的降低而减小,从M的不饱和溶液中析出M可采用先蒸发溶剂、再冷却结晶的方法。
13.(1)防止溶液中的硝酸钾析出,减少硝酸钾的损失
(2)降温结晶 (3)氯化钠、硝酸钾
[解析] (1)硝酸钾的溶解度受温度的影响较大,随温度的升高而增大,趁热过滤的原因是使硝酸钾尽量完全溶解在溶液中,防止溶液中的硝酸钾析出,减少硝酸钾的损失。
同课章节目录
