2021-2022学年高一上学期人教版(2019)化学必修第一册第1章第2节 离子反应第二课时 离子反应发生的条件及应用(16张ppt))
文档属性
| 名称 | 2021-2022学年高一上学期人教版(2019)化学必修第一册第1章第2节 离子反应第二课时 离子反应发生的条件及应用(16张ppt)) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-25 16:07:15 | ||
图片预览




文档简介
(共16张PPT)
第二节 离子反应
第二课时 离子反应发生的条件及应用
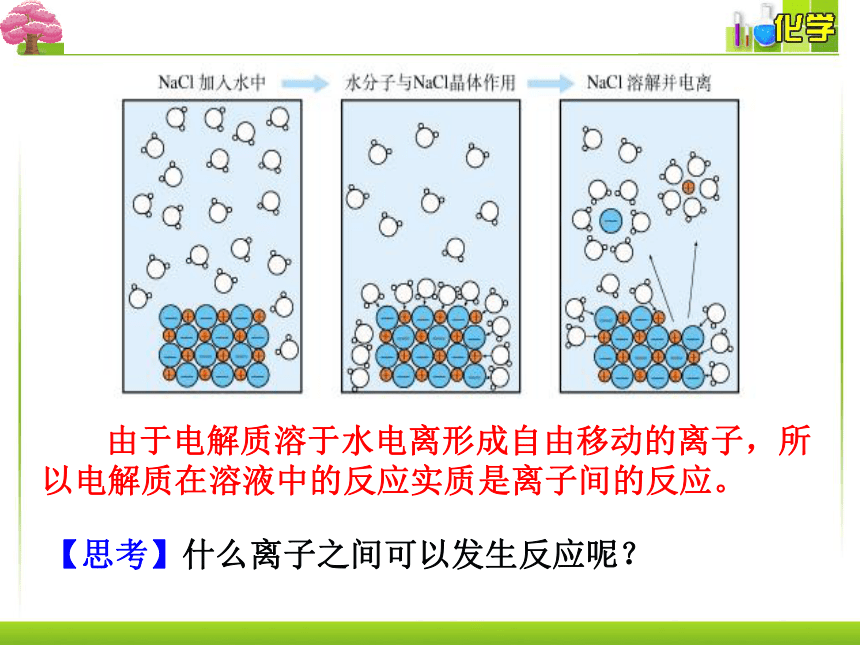
由于电解质溶于水电离形成自由移动的离子,所以电解质在溶液中的反应实质是离子间的反应。
【思考】什么离子之间可以发生反应呢?
1、通过实验事实认识离子反应及其发生的条件。
2、能正确书写离子方程式并能进行正误判断。
3、理解离子方程式的意义。
4、掌握一些常见离子能否共存的判断方法。
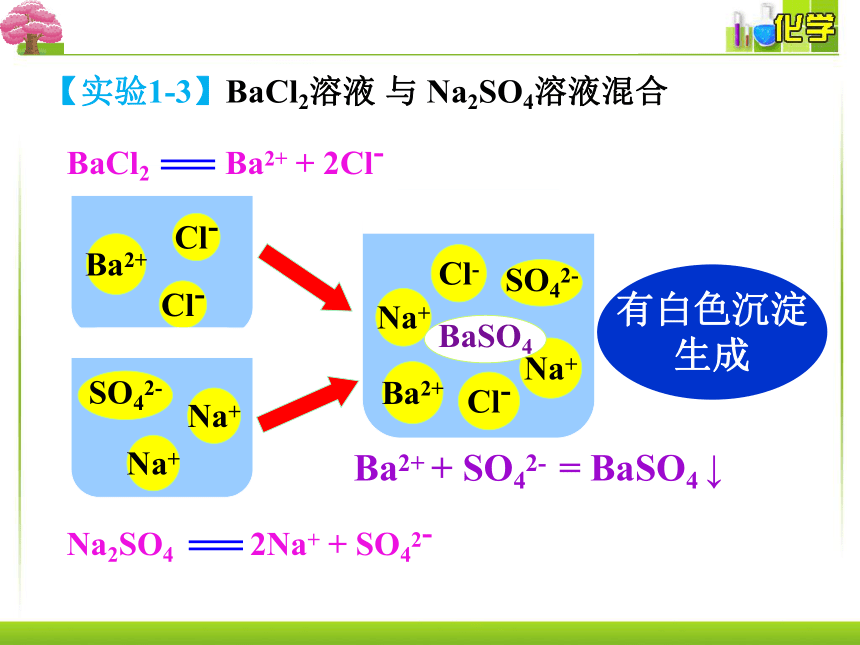
有白色沉淀
生成
Na+
SO42-
Cl-
Na+
Cl-
Ba2+
BaSO4
Ba2+ + SO42- = BaSO4 ↓
【实验1-3】BaCl2溶液 与 Na2SO4溶液混合
Ba2+
Cl-
Cl-
BaCl2 Ba2+ + 2Cl-
Na+
SO42-
Na+
Na2SO4 2Na+ + SO42-
一、离子反应
1、定义:
有离子参加或生成的反应。
2、发生地点:
一般在水溶液中
3、实质:
使反应物中某些离子的数量明显减小
【思考与交流】哪些物质之间能发生离子反应呢?
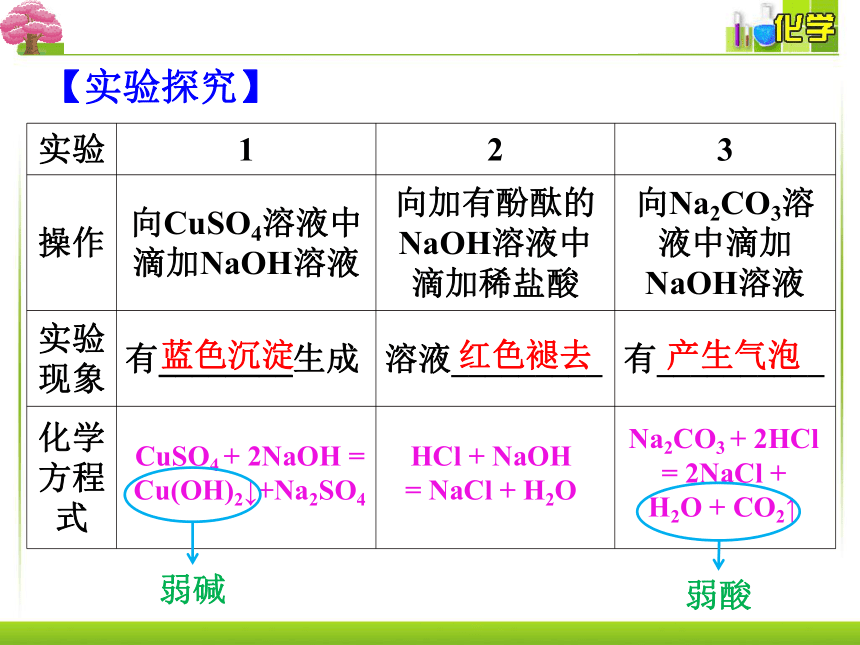
实验 1 2 3
操作 向CuSO4溶液中滴加NaOH溶液 向加有酚酞的NaOH溶液中滴加稀盐酸 向Na2CO3溶液中滴加NaOH溶液
实验现象 有________生成 溶液_________ 有__________
化学方程式
蓝色沉淀
CuSO4 + 2NaOH =
Cu(OH)2↓+Na2SO4
红色褪去
HCl + NaOH
= NaCl + H2O
产生气泡
Na2CO3 + 2HCl = 2NaCl +
H2O + CO2↑
【实验探究】
弱碱
弱酸
一、离子反应
1、定义:
有离子参加或生成的反应。
2、发生地点:
一般在水溶液中
3、结果:
使反应物中某些离子的浓度明显减小
【思考与交流】哪些物质之间能发生离子反应呢?
离子反应发生的条件:
①生成沉淀 ②生成气体 ③生成水
④生成弱酸或弱碱 ⑤溶液中的置换反应
物质溶解性口诀
钾钠铵硝盐易溶,钾钠铵钡碱易溶;
氢氧化钙是微溶,其余碱类皆难溶;
碳酸钡钙是难溶,硫酸钡铅也难溶;
硫酸钙银是微溶,银盐氯溴碘难溶。
判断下列物质间能否发生离子反应。
① NaCl溶液与AgNO3溶液( )
② KNO3溶液与NaOH溶液( )
③ NaOH溶液与HNO3溶液( )
④ Zn与CuSO4溶液( )
⑤NH4Cl溶液和NaOH溶液 ( )
⑥K2CO3溶液和稀硫酸( )
能
不能
能
能
生成了AgCl沉淀
生成了H2O
在溶液中发生了置换反应
能
生成了弱碱
能
生成了气体
【思考与交流】在上面这些能反应的物质中是不是所以离子都参与了反应呢?
1、定义:
用实际参加反应的离子来表示反应的式子
2、离子方程式的书写步骤
二、离子方程式
①写——写出反应的化学方程式:
②拆——把强酸、强碱、可溶性盐拆成离子形式,其余物质仍用化学式表示:
③删——删去方程式两边不参加反应的离子:
④查——检查方程式两边各元素的原子个数和电荷总数是否相等(注意:离子方程式的系数要约到最简)。
强酸:HCl、H2SO4、HNO3、HBr、HI、HClO4
强碱:KOH、Ca(OH)2 、NaOH、Ba(OH)2
1、写出下列物质在溶液中反应的离子方程式:
① Na2O与H2SO4
② KOH与NH4NO3
③ Al(OH)3与盐酸
④ Ba(OH)2与H2SO4
⑤NaHCO3与稀盐酸
Al(OH)3 + 3H+ = Al3+ + 3H2O
NH4+ + OH- = NH3·H2O
Na2O + 2H+ = 2Na+ + H2O
2H+ + SO42- + Ba2+ + 2OH- = BaSO4↓+2H2O
HCO3- + H+ = H2O + CO2↑
2、下列离子方程式正确的是( )
A.碳酸钠溶液与盐酸反应:
Na2CO3 + 2H+ = 2Na+ + H2O + CO2↑
B.向盐酸中滴加氨水:H+ + OH- = H2O
C. H2SO4溶液与Ba(OH)2溶液混合:
H+ + SO42+ + Ba2+ + OH- = BaSO4 ↓ + H2O
D.用小苏打治疗胃酸过多:
HCO3- + H+ = CO2↑ + H2O
D
3、离子方程式的意义
化学方程式 离子方程式
NaOH+HCl=NaCl+H2O KOH+HCl=KCl+H2O 2NaOH+H2SO4=Na2SO4+2H2O 2KOH+H2SO4=K2SO4+2H2O
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
意义:离子方程式不仅可以表示某一个具体的化学反应,而且还可以表示同一类型的反应。
【思考与讨论】
4、判断离子共存问题
通过前面的学习知道,要能发生离子反应,需满足生成沉淀、气体、水、弱酸、弱碱,因此离子不能共存的条件就是发生离子反应的条件。
【例1】下列各组离子在溶液中能大量共存的是 ( )
A. K+、Ag+、Cl-、H+
B. Ba2+、Na+、CO32-、OH-
C. H+、K+、CO32-、SO42-
D. Al3+、Fe3+、SO42-、Cl-
D
【例2】下列离子在溶液中,无色且能大量共存
的是 ( )
A. K+、Fe3+、Cl-、NO3-
B. Ba2+、K+、Cl-、OH-
C. H+、Mg2+、HCO3-、SO42-
D. Na+、K+、MnO4-、NO3-
注意:无色溶液中不存在有色离子
Fe3+(棕黄色) Fe2+(浅绿色)
MnO4-(紫红色) Cu2+(蓝色)
B
1、在pH=1的无色溶液中,能大量共存的离子组是( )
A.NH4+、Mg2+、SO42-、Cl-
B.Ba2+、K+、OH-、NO3-
C.Al3+、MnO4-、SO42-、Cl-
D.Na+、Cu2+、Cl-、Ba2+
A
H+
2、下列各组离子能够大量共存的是 ( )
pH=11的溶液中:Na+、Cl-、Ba2+、 NO3-
B.与Fe能产生氢气的溶液:K+、SO42-、CO32-、Na+
C.使酚酞试液变红的溶液:Mg2+、NO3-、Cl-、NH4+
D.无色溶液中:K+、Cu2+、SO42-、Zn2+
A
第二节 离子反应
第二课时 离子反应发生的条件及应用
由于电解质溶于水电离形成自由移动的离子,所以电解质在溶液中的反应实质是离子间的反应。
【思考】什么离子之间可以发生反应呢?
1、通过实验事实认识离子反应及其发生的条件。
2、能正确书写离子方程式并能进行正误判断。
3、理解离子方程式的意义。
4、掌握一些常见离子能否共存的判断方法。
有白色沉淀
生成
Na+
SO42-
Cl-
Na+
Cl-
Ba2+
BaSO4
Ba2+ + SO42- = BaSO4 ↓
【实验1-3】BaCl2溶液 与 Na2SO4溶液混合
Ba2+
Cl-
Cl-
BaCl2 Ba2+ + 2Cl-
Na+
SO42-
Na+
Na2SO4 2Na+ + SO42-
一、离子反应
1、定义:
有离子参加或生成的反应。
2、发生地点:
一般在水溶液中
3、实质:
使反应物中某些离子的数量明显减小
【思考与交流】哪些物质之间能发生离子反应呢?
实验 1 2 3
操作 向CuSO4溶液中滴加NaOH溶液 向加有酚酞的NaOH溶液中滴加稀盐酸 向Na2CO3溶液中滴加NaOH溶液
实验现象 有________生成 溶液_________ 有__________
化学方程式
蓝色沉淀
CuSO4 + 2NaOH =
Cu(OH)2↓+Na2SO4
红色褪去
HCl + NaOH
= NaCl + H2O
产生气泡
Na2CO3 + 2HCl = 2NaCl +
H2O + CO2↑
【实验探究】
弱碱
弱酸
一、离子反应
1、定义:
有离子参加或生成的反应。
2、发生地点:
一般在水溶液中
3、结果:
使反应物中某些离子的浓度明显减小
【思考与交流】哪些物质之间能发生离子反应呢?
离子反应发生的条件:
①生成沉淀 ②生成气体 ③生成水
④生成弱酸或弱碱 ⑤溶液中的置换反应
物质溶解性口诀
钾钠铵硝盐易溶,钾钠铵钡碱易溶;
氢氧化钙是微溶,其余碱类皆难溶;
碳酸钡钙是难溶,硫酸钡铅也难溶;
硫酸钙银是微溶,银盐氯溴碘难溶。
判断下列物质间能否发生离子反应。
① NaCl溶液与AgNO3溶液( )
② KNO3溶液与NaOH溶液( )
③ NaOH溶液与HNO3溶液( )
④ Zn与CuSO4溶液( )
⑤NH4Cl溶液和NaOH溶液 ( )
⑥K2CO3溶液和稀硫酸( )
能
不能
能
能
生成了AgCl沉淀
生成了H2O
在溶液中发生了置换反应
能
生成了弱碱
能
生成了气体
【思考与交流】在上面这些能反应的物质中是不是所以离子都参与了反应呢?
1、定义:
用实际参加反应的离子来表示反应的式子
2、离子方程式的书写步骤
二、离子方程式
①写——写出反应的化学方程式:
②拆——把强酸、强碱、可溶性盐拆成离子形式,其余物质仍用化学式表示:
③删——删去方程式两边不参加反应的离子:
④查——检查方程式两边各元素的原子个数和电荷总数是否相等(注意:离子方程式的系数要约到最简)。
强酸:HCl、H2SO4、HNO3、HBr、HI、HClO4
强碱:KOH、Ca(OH)2 、NaOH、Ba(OH)2
1、写出下列物质在溶液中反应的离子方程式:
① Na2O与H2SO4
② KOH与NH4NO3
③ Al(OH)3与盐酸
④ Ba(OH)2与H2SO4
⑤NaHCO3与稀盐酸
Al(OH)3 + 3H+ = Al3+ + 3H2O
NH4+ + OH- = NH3·H2O
Na2O + 2H+ = 2Na+ + H2O
2H+ + SO42- + Ba2+ + 2OH- = BaSO4↓+2H2O
HCO3- + H+ = H2O + CO2↑
2、下列离子方程式正确的是( )
A.碳酸钠溶液与盐酸反应:
Na2CO3 + 2H+ = 2Na+ + H2O + CO2↑
B.向盐酸中滴加氨水:H+ + OH- = H2O
C. H2SO4溶液与Ba(OH)2溶液混合:
H+ + SO42+ + Ba2+ + OH- = BaSO4 ↓ + H2O
D.用小苏打治疗胃酸过多:
HCO3- + H+ = CO2↑ + H2O
D
3、离子方程式的意义
化学方程式 离子方程式
NaOH+HCl=NaCl+H2O KOH+HCl=KCl+H2O 2NaOH+H2SO4=Na2SO4+2H2O 2KOH+H2SO4=K2SO4+2H2O
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
意义:离子方程式不仅可以表示某一个具体的化学反应,而且还可以表示同一类型的反应。
【思考与讨论】
4、判断离子共存问题
通过前面的学习知道,要能发生离子反应,需满足生成沉淀、气体、水、弱酸、弱碱,因此离子不能共存的条件就是发生离子反应的条件。
【例1】下列各组离子在溶液中能大量共存的是 ( )
A. K+、Ag+、Cl-、H+
B. Ba2+、Na+、CO32-、OH-
C. H+、K+、CO32-、SO42-
D. Al3+、Fe3+、SO42-、Cl-
D
【例2】下列离子在溶液中,无色且能大量共存
的是 ( )
A. K+、Fe3+、Cl-、NO3-
B. Ba2+、K+、Cl-、OH-
C. H+、Mg2+、HCO3-、SO42-
D. Na+、K+、MnO4-、NO3-
注意:无色溶液中不存在有色离子
Fe3+(棕黄色) Fe2+(浅绿色)
MnO4-(紫红色) Cu2+(蓝色)
B
1、在pH=1的无色溶液中,能大量共存的离子组是( )
A.NH4+、Mg2+、SO42-、Cl-
B.Ba2+、K+、OH-、NO3-
C.Al3+、MnO4-、SO42-、Cl-
D.Na+、Cu2+、Cl-、Ba2+
A
H+
2、下列各组离子能够大量共存的是 ( )
pH=11的溶液中:Na+、Cl-、Ba2+、 NO3-
B.与Fe能产生氢气的溶液:K+、SO42-、CO32-、Na+
C.使酚酞试液变红的溶液:Mg2+、NO3-、Cl-、NH4+
D.无色溶液中:K+、Cu2+、SO42-、Zn2+
A
