高中化学人教版(2019)选择性必修22.2 分子的空间构型 课件 (22张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修22.2 分子的空间构型 课件 (22张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-25 17:18:54 | ||
图片预览






文档简介
(共22张PPT)
第二节 分子的空间构型
教学目标
1.了解共价分子具有特定的空间结构。
2.运用价层电子对互斥模型预测简单分子的空间结构。
3.了解杂化轨道理论的要点和类型。
教学目录
1.分子结构的测定
2.多样的分子空间结构
3.价层电子对互斥模型
4.杂化轨道理论简介
情景微课堂
2015年,中国科学家屠呦呦获得了诺贝尔奖。青蒿素是中国传统药物青蒿中提取的抗疟药物。如何测定青蒿素的分子结构呢?
分子结构的测定
探索新知
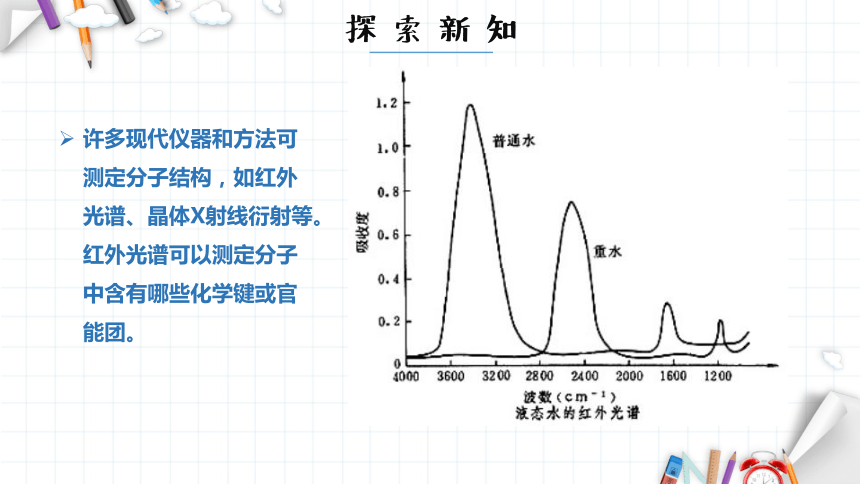
许多现代仪器和方法可测定分子结构,如红外光谱、晶体X射线衍射等。红外光谱可以测定分子中含有哪些化学键或官能团。
思考讨论
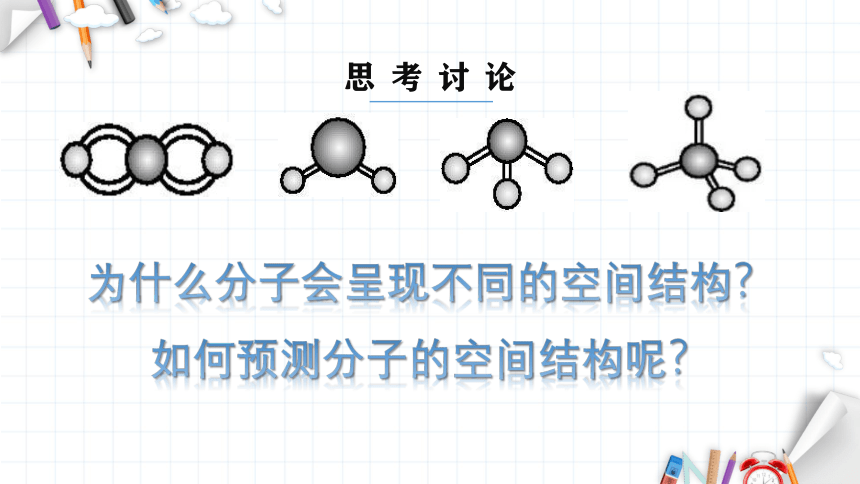
为什么分子会呈现不同的空间结构?如何预测分子的空间结构呢?
多样的分子空间结构
探索新知
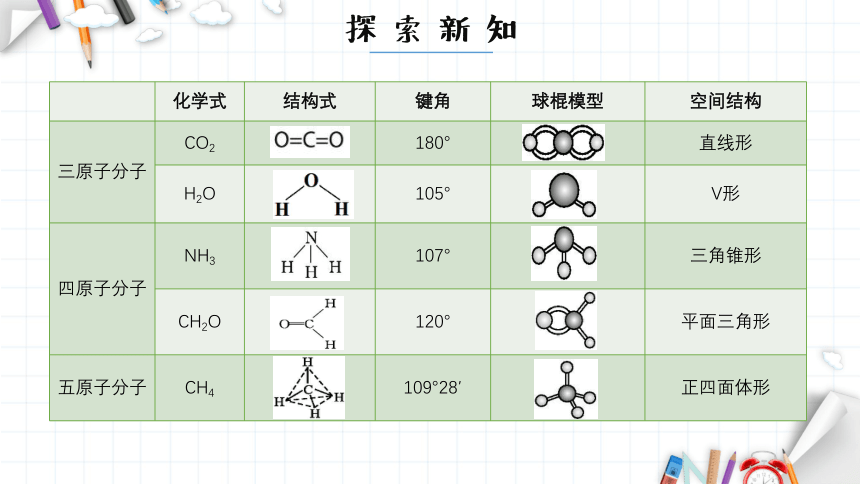
化学式 结构式 键角 球棍模型 空间结构
三原子分子 CO2 180° 直线形
H2O 105° V形
四原子分子 NH3 107° 三角锥形
CH2O 120° 平面三角形
五原子分子 CH4 109°28′ 正四面体形
价层电子对互斥模型
探索新知
价层电子对互斥理论
价层电子对互斥模型认为,分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。分子中的价层电子对包括σ键电子对和中心原子上的孤电子对,多重键只计其中σ键的电子对,不计π键电子对。
探索新知
中心原子价层电子对数的计算
(1)a表示中心原子的价电子数。
对主族元素,a=最外层电子数;
对于阳离子,a=价电子数-离子电荷数;
对于阴离子,a=价电子数+|离子电荷数|。
(2)x表示与中心原子结合的原子数。
(3)b表示与中心原子结合的原子最多能接受的电子数,氢为1,
其他原子=8-该原子的价电子数。
探索新知
VSEPR模型
1、中心原子上的价电子都用于形成共价键的分子。
ABn n=2——直线形 n=3——平面三角形 n=4——正四面体形
CO2 BF3 CH4
2、中心原子上有孤电子对的分子:对于中心原子上有孤电子对(未用于形成共价键的电子对)的分子,中心原子上的孤电子对也要占据中心原子周围的空间,并互相排斥使分子呈现不同的空间结构。
探索新知
H2O NH3 HCN SO2
V形 三角锥形 直线形 V形
利用价层电子对互斥理论判断分子的空间结构
ABm型分子或离子的价层电子对数
利用上式计算A原子价层电子对数时,需注意:
(1)氧族元素的原子作为中心原子A时提供6个价电子,作为配位原子B时不提
供价电子。
总结
探索新知
(2)卤素原子作为中心原子A时提供7个价电子,作为配位原子B时提供1个价电子。
(3) 若为分子,电荷数为0;
探索新知
杂化轨道理论是一种价键理论,是鲍林为了解释分子的空间结构提出的。
(1)轨道的杂化:在外界条件影响下,原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
(2)杂化轨道:原子轨道杂化后形成的一组新的原子轨道,叫做杂化原子轨道,简称杂化轨道。
(3)轨道杂化的过程:激发→杂化→轨道重叠
探索新知
探索新知
探索新知
杂化类型的判断
因为杂化轨道只能用于形成σ键或者用来容纳孤电子对,而两个原子之间只能形成一个σ键,故有下列关系:杂化轨道数=中心原子孤电子对数+中心原子结合的原子数,再由杂化轨道数判断杂化类型。
代表物 杂化轨道数 杂化轨道类型
CO2 0+2=2 sp
CH2O 0+3=3 sp2
CH4 0+4=4 sp3
SO2 1+2=3 sp2
NH3 1+3=4 sp3
H2O 2+2=4 sp3
感谢观看
第二节 分子的空间构型
教学目标
1.了解共价分子具有特定的空间结构。
2.运用价层电子对互斥模型预测简单分子的空间结构。
3.了解杂化轨道理论的要点和类型。
教学目录
1.分子结构的测定
2.多样的分子空间结构
3.价层电子对互斥模型
4.杂化轨道理论简介
情景微课堂
2015年,中国科学家屠呦呦获得了诺贝尔奖。青蒿素是中国传统药物青蒿中提取的抗疟药物。如何测定青蒿素的分子结构呢?
分子结构的测定
探索新知
许多现代仪器和方法可测定分子结构,如红外光谱、晶体X射线衍射等。红外光谱可以测定分子中含有哪些化学键或官能团。
思考讨论
为什么分子会呈现不同的空间结构?如何预测分子的空间结构呢?
多样的分子空间结构
探索新知
化学式 结构式 键角 球棍模型 空间结构
三原子分子 CO2 180° 直线形
H2O 105° V形
四原子分子 NH3 107° 三角锥形
CH2O 120° 平面三角形
五原子分子 CH4 109°28′ 正四面体形
价层电子对互斥模型
探索新知
价层电子对互斥理论
价层电子对互斥模型认为,分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。分子中的价层电子对包括σ键电子对和中心原子上的孤电子对,多重键只计其中σ键的电子对,不计π键电子对。
探索新知
中心原子价层电子对数的计算
(1)a表示中心原子的价电子数。
对主族元素,a=最外层电子数;
对于阳离子,a=价电子数-离子电荷数;
对于阴离子,a=价电子数+|离子电荷数|。
(2)x表示与中心原子结合的原子数。
(3)b表示与中心原子结合的原子最多能接受的电子数,氢为1,
其他原子=8-该原子的价电子数。
探索新知
VSEPR模型
1、中心原子上的价电子都用于形成共价键的分子。
ABn n=2——直线形 n=3——平面三角形 n=4——正四面体形
CO2 BF3 CH4
2、中心原子上有孤电子对的分子:对于中心原子上有孤电子对(未用于形成共价键的电子对)的分子,中心原子上的孤电子对也要占据中心原子周围的空间,并互相排斥使分子呈现不同的空间结构。
探索新知
H2O NH3 HCN SO2
V形 三角锥形 直线形 V形
利用价层电子对互斥理论判断分子的空间结构
ABm型分子或离子的价层电子对数
利用上式计算A原子价层电子对数时,需注意:
(1)氧族元素的原子作为中心原子A时提供6个价电子,作为配位原子B时不提
供价电子。
总结
探索新知
(2)卤素原子作为中心原子A时提供7个价电子,作为配位原子B时提供1个价电子。
(3) 若为分子,电荷数为0;
探索新知
杂化轨道理论是一种价键理论,是鲍林为了解释分子的空间结构提出的。
(1)轨道的杂化:在外界条件影响下,原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
(2)杂化轨道:原子轨道杂化后形成的一组新的原子轨道,叫做杂化原子轨道,简称杂化轨道。
(3)轨道杂化的过程:激发→杂化→轨道重叠
探索新知
探索新知
探索新知
杂化类型的判断
因为杂化轨道只能用于形成σ键或者用来容纳孤电子对,而两个原子之间只能形成一个σ键,故有下列关系:杂化轨道数=中心原子孤电子对数+中心原子结合的原子数,再由杂化轨道数判断杂化类型。
代表物 杂化轨道数 杂化轨道类型
CO2 0+2=2 sp
CH2O 0+3=3 sp2
CH4 0+4=4 sp3
SO2 1+2=3 sp2
NH3 1+3=4 sp3
H2O 2+2=4 sp3
感谢观看
