3.1.2 构成物质的基本微粒(课件51页)
文档属性
| 名称 | 3.1.2 构成物质的基本微粒(课件51页) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-25 16:00:54 | ||
图片预览








文档简介
(共51张PPT)
课题1 物质的变化和性质
沪教版 化学(初中)
第1节 构成物质的基本微粒
(第2课时)
同步课堂
学习目标:
重点难点:
1.通过学习,知道并能说出原子的构成。
2.能说出原子核外电子分层排布的规律,学会原子结构的表示方法。
3.知道原子可以结合成分子、同一元素的原子和离子可以互相转化,
初步认识核外电子在化学反应中的作用
1.原子的内部结构。
2.原子核外电子分层排布的规律。
3.离子形成的过程。
内 容 导 航
◆ 原 子
◆ 离 子
思考:下面两幅图说明什么?
说明了分子和原子是真实存在的,从而也证实了科学家的设想。
【新课引入】
学习过程:
三、原 子
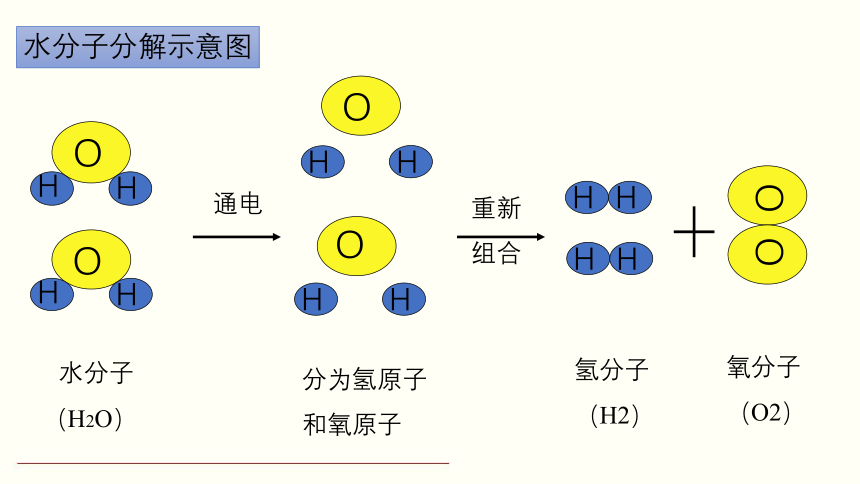
大量的研究结果表明,分子是由原子结合而成的。例如每个水分子由两个氢原子和一个氧原子构成。当水分子分解时,生成氢原子和氧原子,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子。
重新
组合
O
H
H
O
H
H
水分子
(H2O)
氧分子
(O2)
氢分子
(H2)
O
O
H
H
H
H
O
O
H
H
通电
H
H
分为氢原子和氧原子
水分子分解示意图
原子不但可以结合成分子,还能直接构成物质。常见的金属(如铁铜、铝、汞等)和稀有气体(如氢氖等)都是由原子直接构成的。因此,原子也是构成物质的一种微粒。
交流与讨论
在水的分解过程中,发生变化的是什么微粒 不发生变化的又是什么微粒 请把你的想法与同学交流、讨论。
归纳与小结
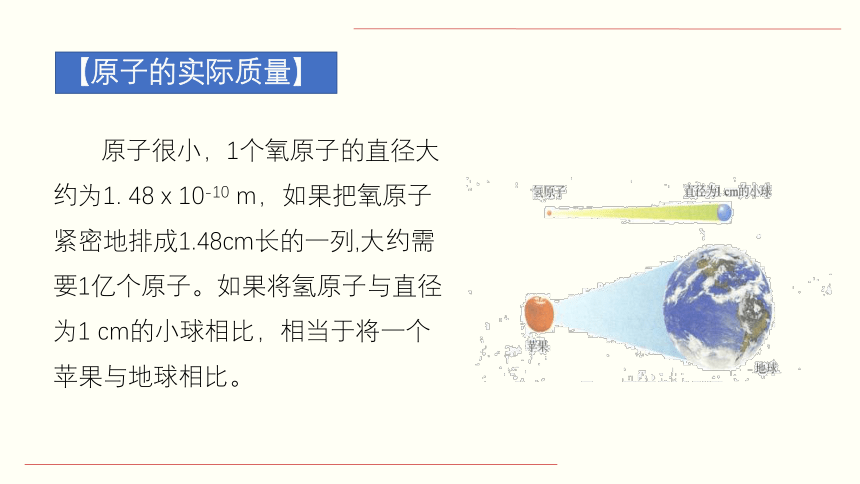
原子很小,1个氧原子的直径大约为1. 48 x 10-10 m,如果把氧原子紧密地排成1.48cm长的一列,大约需要1亿个原子。如果将氢原子与直径为1 cm的小球相比,相当于将一个苹果与地球相比。
【原子的实际质量】
原子的质量、体积都很小。那么 , 原子是不是构成物质的最小微粒 原子能不能再分
英国科学家汤姆生、卢瑟福为人类认识原子付出了巨大的努力。
【原子的构成】
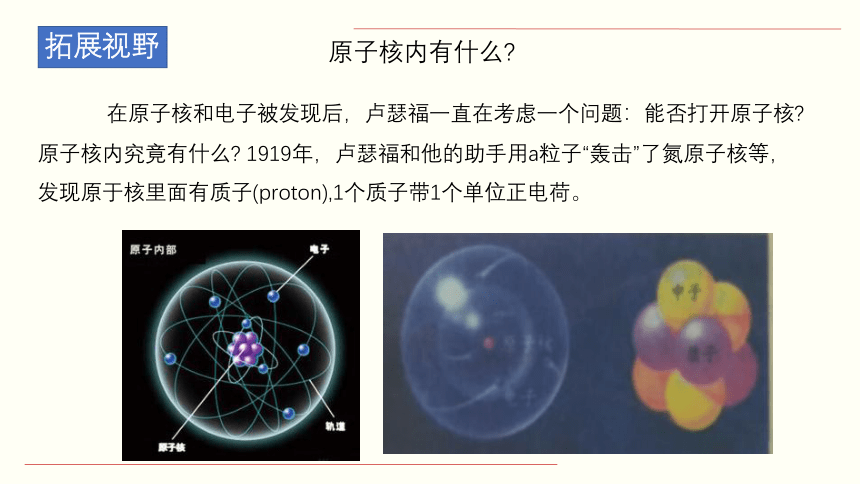
在原子核和电子被发现后,卢瑟福一直在考虑一个问题:能否打开原子核 原子核内究竟有什么 1919年,卢瑟福和他的助手用a粒子“轰击”了氮原子核等,发现原于核里面有质子(proton),1个质子带1个单位正电荷。
拓展视野
原子核内有什么
1920年,卢瑟福又预言:原子核中有不带电荷的中性粒子。
1932年,经过不少科学家的反复实验后确实发现,a粒子打在铍原子核,生了一种高速的不显电性的中性粒子,他们将其命名为中子(neutron)。中子的质量与质子的质量几乎相等。卢瑟福的预言被证实。
实验证明,有一种氢原子的核内只有1个质子,没有中子,核外有1个电子;有一种碳原子核内有6个质子6个中子,核外有6个电子。在卢瑟福之后,又经过了几代科学家的努力,在原子核内部不断发现新的基本粒子,原子深层次的奥秘正在被逐渐揭示。
是不是所有的原子都有质子、中子、核外电子三个部分?
交流与讨论
有一种氢原子中只有一个质子和一个核外电子,没有中子。所以并不是所有原子里都有中子。
原子
原子核
核外电子(每个电子带一个单位的负电荷)
质子(每个质子带一个单位正电荷)
中子(不带电)
【原子的结构】
1. 核电荷数=质子数=核外电子数(但不一定等于中子数)
2. 由于质子数等于核外电子数,正电荷总数等于负电荷总数,所以整个原子不显电性。
3. 不同种类的原子,核内质子数不同,核外电子数也不同,中子数可能相同。
归纳与小结
1. 原因:由于原子的实际质量太小,书写和使用都不太方便,因此采用相对原子质量来表示原子的质量。
2. 定义:以一种碳原子质量的 作为基准,其他原子的质量与这一基准的比,称为这种原子的相对原子质量(符号为Ar)。
【原子的相对原子质量】
3. 计算
一个碳原子的质量是:1.993×10-26千克;一个氧原子的质量是:2.657×10-26千克
一个铁原子的质量是:9.288×10-26千克
由于原子质量的数值太小,书写和使用都很不方便,怎么办?
相对原子质量就是以一种碳原子质量的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的比。
某原子的相对原子质量(Ar)=
碳原子质量的1/12
该原子(A)的质量
4. 公式:
5. 单位:相对原子质量是一个比值,它的国际单位制(SI)单位为“1”,一般不写出。
6.相对分子质量(Mr):等于构成分子的各原子的相对原子质量(Ar)的总和。
【原子结构示意图】
1. 电子层 2.核外电子的分层排布
1.电子层
(1) 核外电子绕核不停地做高速运动,但在含有多电子的原子中,有的电子能量低,在离核近的区域运动,有的电子能量高,在离核远的区域运动,就好像分了层一样,这样的区域称为电子层。离核最近的电子层叫第一电子层,离核稍近的叫第二电子层,由里向外以此类推。
(2) 不同原子的电子数不同,电子层数也可能不同,最少的只有一个电子层,如氢原子,最多的有七个电子层。
2. 核外电子的分层排布
①核外电子分层排布
二 三 四 五 六 七
K L M N O P Q
电子层
离核远近 近 远
能量高低 低 高
②核外电子离核越近,能量越低;离核越远。能量越高
⑤第一层电子数不超过 2 个,最外层电子数不超过 8 个,第二层电子数不超过 8个。
④核外电子总是先排满能量低的电子层,再进入能量较高的电子层。
③核外电子最少有 1 层,最多有 7 层。
活动探究
1-18元素原子结构示意图
找出其中的金属元素,非金属元素,稀有气体元素。
并分析它们各自的最外层电子数有什么特点。
元素的种类以及化学性质与原子最外层电子数关系:
③稀有气体的原子最外层都有 电子(氦为____个电子),不易_____
也不易_____电子,是一种相对稳定结构。
①金属的原子最外层电子一般_____4个,在化 学反应中易 电子;
②非金属的原子最外层电子一般 4个,在化学反应中易______电子;
少于
失去
多于
得到
8
2
失去
得到
结论:
元素的化学性质主要由原子的最外层电子数决定的。
元素的种类由原子的核电荷数(或质子数)决定。
①核外电子总是优先排布在能量最低的电子层上,只有当能量低的电子层被排满后,才能排布在能量较高的电子层上,即排满第1层再排第2层,排满第2层再排第3.....
②第1层电子数不超过2个,第2层电子数不超过8个,最外层电子数不超过8个(第1层为最外层时不超过2个)。
核外电子的分层排布规律
在化学变化中,电中性的原子经常因得到或失去电子而成为带电荷的微粒,这种带电的微粒称为离子。
四、离 子
【离子的定义】
离子的形成
下面是钠原子和氯原子,这两种原子的结构稳定吗?这两种原子该如何变化才能达到稳定呢?
8
2
1
+11
Na
8
2
+11
Na+
失去电子
8
2
8
+17
Cl-
8
2
7
+17
Cl
得到电子
Na+
Cl-
Na+
Cl-
钠离子
原子
失电子
阳离子( + )
氯离子
阴离子( - )
得电子
原子
离子:带有电荷的原子或原子团。
离子带的电荷数等于该原子(或原子团)失去或得到电子的数目。
【离子的分类】
离子
阳离子
阴离子
【离子的表示方法】
(1)离子符号
在元素符号(或原子团)右上角标明所带电荷及电性,标法是先写数字再写“+、-”号,只带1个单位电荷时,数字“1”省略不写,如Na+、Cl-等。如果要表示几个离子,则在离子符号前面加数字即可。
(2)离子的读法
根据离子的表示方法,读作“带几个单位正(负)电荷的某离子”例如Na+、Mg2+、Cl- 分别读作钠离子、(带两个单位正电荷的)镁离子、氯离子。
(3)离子符号的含义(数字“2”的意义)
归纳与小结
离子符号与化合价的区别
离子偏右数在前
标价正上数置后
【离子的形成】
( 1 ) 金属元素原子最外层电子数一般小于4,在化学反应中易失去电子,从而使质子数大于核外电子数,参加反应的原子带上正电荷形成阳离子,电子层数减少一层。
( 2 ) 非金属元素原子的最外层电子数一般大于4,在化学反应中易得到电子,从而使质子数小于核外电子数,参加反应的原子带上负电荷形成阴离子,电子层数不变。
【离子的结构】
(1)和对应的原子比较,阳离子少一个电子层,阴离子的电子层数不变。
(2)阴阳离子核外电子排布与具有相同电子层数的稀有气体元素原子的核外电子排布相同。
分子、原子、离子之间的转化
例1.(2021·吉林长春市·中考真题)物质是由微观粒子构成的,下
列物质由离子直接构成的是( )
A.氯化钠 B.氢气
C.金刚石 D.二氧化碳
【典例精讲】
A
【解析】A、氯化钠由钠离子和氯离子构成,符合题意;B、氢气由氢分子构成,不符合题意;C、金刚石由碳原子构成,不符合题意;D、二氧化碳由二氧化碳分子构成,不符合题意。故选A。
【典例精讲】
例2.(2021山东聊城二模)下列关于微观粒子说法不
正确的是( )
A.分子的质量一定比原子的质量大
B.同种原子可以构成不同种分子
C.所有原子都由原子核和核外电子构成
D.原子得到或失去电子变成离子
A
【答案】C
【解析】A、核内质子数决定元素的种类,故上述五种微粒只涉及四种元素,此选项表述正确;B、最外层电子数决定元素的化学性质,当最外层是8电子时,化学性质比较稳定,此选项表述正确;C、原子不带电,核内质子数等于核外电子数,阴离子带负电,核内质子数小于核外电子数,阳离子带正电,核内质子数大于核外电子数,故①②④属于原子,③属于阳离子,⑤属于阴离子,此选项表述不正确;D、①对应的元素是F,④对应的元素是Na,两种元素组成化合物的化学式为NaF,此选项表述正确。故选C。
【典例精讲】
C
例3. (2021湖南常德)如图是五种微粒的结构示意图,下列说法不正确的是( )
A.上述五种微粒只涉及四种元素
B.②③⑤表示的微粒性质较稳定
C.①②④属于原子,③⑤属于阴离子
D.①④对应元素组成化合物的化学式为NaF
-
【答案】C
【解析】A、核内质子数决定元素的种类,故上述五种微粒只涉及四种元素,此选项表述正确;B、最外层电子数决定元素的化学性质,当最外层是8电子时,化学性质比较稳定,此选项表述正确;C、原子不带电,核内质子数等于核外电子数,阴离子带负电,核内质子数小于核外电子数,阳离子带正电,核内质子数大于核外电子数,故①②④属于原子,③属于阳离子,⑤属于阴离子,此选项表述不正确;D、①对应的元素是F,④对应的元素是Na,两种元素组成化合物的化学式为NaF,此选项表述正确。故选C。
例3.某元素R的原子核带x个正电荷,则R2+的核外电子总数为 ( )
A.x-2 B.x+2
C.x D.无法确定
解析:原子核的电荷数减去失去的电子数2,即为该离子的电子数。
【典例精讲】
A
1.(2021四川省成都市青白江中学校二模)下列关于分子的叙述中,正确的是( )
A.一切物质都是由分子构成的
B.分子是化学变化中的最小粒子
C.分子是不能再分的一种粒子
D.分子是保持物质化学性质的最小粒子
D
【达标测评】
1.(2021成都市通锦中学校一模)用分子的知识解释下列现象,正确的是( )
A.缉毒犬能根据气味发现毒品,是由于分子不断运动
B.铁丝在空气中不燃烧而在氧气中燃烧,说明空气中和氧气中的氧分子化学性质不同
C.变瘪的乒乓球放入热水中能鼓起来,是由于分子受热体积变大
D.降温能使水结成冰,是因为在低温下水分子静止不动
A
【达标测评】
【达标训练】
2.(2021崇州市崇庆中学实验学校erm ) 下列对分子、原子、离子的认识正确的是( )
A.同种分子排列方式不同,化学性质不同
B.在干冰中,分子因相互作用而静止不动
C.同种原子按不同方式结合,可以构成不同的物质
D.原子得失电子形成离子后,原子核发生了变化
C
3.(2021金堂县福兴镇初级中学二模)在下列示意图表示的粒子中,属于原
子的有 (填序号,下同),属于阳离子的有 ,属于阴离子的
有 ,属于同种元素的为 。
②⑤⑥
①④
③
④⑤
【达标训练】
构成物质的基本微粒
原子
分子
微粒的性质
离子
很小
不断运动
有空隙
概念
很小
不断运动
有空隙
概念
构成
相对原子质量
相对分子质量
概念
分类
归纳与总结
归纳与总结
分子与原子的区别和联系
分子 原子
基本性质
定 义
本质区别
联 系
体积小、质量小、不停地运动、微粒之间有间隔
保持物质化学性质的最小粒子
化学变化中的最小粒子
化学变化中分子可以再分,而原子不能再分
分子可以分裂为原子,原子可以相互结合形成分子
离子与原子的区别
粒子种类 原子 离子
阳离子 阴离子
区 别 粒子结构
化学性质
电 性
符 号
联 系
核内质子=
核外电子数
核内电子数>
核外电数
核内电子数<
核外电子数
不一定稳定
较稳定
较稳定
不显电性
带正电
带负电
用元素符号表示:
如:S、Na……
用阳离子符号表示:
如:Na+Mg2+……
用阴离子符号表示:
如:Cl-、O2-……
原子
阳离子
失电子
得电子
失电子
得电子
阴离子
用分子或原子的观点解释下列问题:
1.物理变化和化学变化
物质发生物理变化时,分子本身没有变化,改变的只是分子间的间隔;
发生化学变化时,分子本身发生了变化,变成了别的物质的分子。
2.化学变化的本质:
在化学变化中分子分裂成原子,原子不能再分,而是重新构成新的分子。
3.运用分子的概念区分纯净物和混合物
由同种分子构成的物质是纯净物;由多种不同的分子构成的物质是混合物。
1.完成配套练习册;
2.预习组成物质的化学元素。
【作业布置】
谢 谢!
课题1 物质的变化和性质
沪教版 化学(初中)
第1节 构成物质的基本微粒
(第2课时)
同步课堂
学习目标:
重点难点:
1.通过学习,知道并能说出原子的构成。
2.能说出原子核外电子分层排布的规律,学会原子结构的表示方法。
3.知道原子可以结合成分子、同一元素的原子和离子可以互相转化,
初步认识核外电子在化学反应中的作用
1.原子的内部结构。
2.原子核外电子分层排布的规律。
3.离子形成的过程。
内 容 导 航
◆ 原 子
◆ 离 子
思考:下面两幅图说明什么?
说明了分子和原子是真实存在的,从而也证实了科学家的设想。
【新课引入】
学习过程:
三、原 子
大量的研究结果表明,分子是由原子结合而成的。例如每个水分子由两个氢原子和一个氧原子构成。当水分子分解时,生成氢原子和氧原子,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子。
重新
组合
O
H
H
O
H
H
水分子
(H2O)
氧分子
(O2)
氢分子
(H2)
O
O
H
H
H
H
O
O
H
H
通电
H
H
分为氢原子和氧原子
水分子分解示意图
原子不但可以结合成分子,还能直接构成物质。常见的金属(如铁铜、铝、汞等)和稀有气体(如氢氖等)都是由原子直接构成的。因此,原子也是构成物质的一种微粒。
交流与讨论
在水的分解过程中,发生变化的是什么微粒 不发生变化的又是什么微粒 请把你的想法与同学交流、讨论。
归纳与小结
原子很小,1个氧原子的直径大约为1. 48 x 10-10 m,如果把氧原子紧密地排成1.48cm长的一列,大约需要1亿个原子。如果将氢原子与直径为1 cm的小球相比,相当于将一个苹果与地球相比。
【原子的实际质量】
原子的质量、体积都很小。那么 , 原子是不是构成物质的最小微粒 原子能不能再分
英国科学家汤姆生、卢瑟福为人类认识原子付出了巨大的努力。
【原子的构成】
在原子核和电子被发现后,卢瑟福一直在考虑一个问题:能否打开原子核 原子核内究竟有什么 1919年,卢瑟福和他的助手用a粒子“轰击”了氮原子核等,发现原于核里面有质子(proton),1个质子带1个单位正电荷。
拓展视野
原子核内有什么
1920年,卢瑟福又预言:原子核中有不带电荷的中性粒子。
1932年,经过不少科学家的反复实验后确实发现,a粒子打在铍原子核,生了一种高速的不显电性的中性粒子,他们将其命名为中子(neutron)。中子的质量与质子的质量几乎相等。卢瑟福的预言被证实。
实验证明,有一种氢原子的核内只有1个质子,没有中子,核外有1个电子;有一种碳原子核内有6个质子6个中子,核外有6个电子。在卢瑟福之后,又经过了几代科学家的努力,在原子核内部不断发现新的基本粒子,原子深层次的奥秘正在被逐渐揭示。
是不是所有的原子都有质子、中子、核外电子三个部分?
交流与讨论
有一种氢原子中只有一个质子和一个核外电子,没有中子。所以并不是所有原子里都有中子。
原子
原子核
核外电子(每个电子带一个单位的负电荷)
质子(每个质子带一个单位正电荷)
中子(不带电)
【原子的结构】
1. 核电荷数=质子数=核外电子数(但不一定等于中子数)
2. 由于质子数等于核外电子数,正电荷总数等于负电荷总数,所以整个原子不显电性。
3. 不同种类的原子,核内质子数不同,核外电子数也不同,中子数可能相同。
归纳与小结
1. 原因:由于原子的实际质量太小,书写和使用都不太方便,因此采用相对原子质量来表示原子的质量。
2. 定义:以一种碳原子质量的 作为基准,其他原子的质量与这一基准的比,称为这种原子的相对原子质量(符号为Ar)。
【原子的相对原子质量】
3. 计算
一个碳原子的质量是:1.993×10-26千克;一个氧原子的质量是:2.657×10-26千克
一个铁原子的质量是:9.288×10-26千克
由于原子质量的数值太小,书写和使用都很不方便,怎么办?
相对原子质量就是以一种碳原子质量的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的比。
某原子的相对原子质量(Ar)=
碳原子质量的1/12
该原子(A)的质量
4. 公式:
5. 单位:相对原子质量是一个比值,它的国际单位制(SI)单位为“1”,一般不写出。
6.相对分子质量(Mr):等于构成分子的各原子的相对原子质量(Ar)的总和。
【原子结构示意图】
1. 电子层 2.核外电子的分层排布
1.电子层
(1) 核外电子绕核不停地做高速运动,但在含有多电子的原子中,有的电子能量低,在离核近的区域运动,有的电子能量高,在离核远的区域运动,就好像分了层一样,这样的区域称为电子层。离核最近的电子层叫第一电子层,离核稍近的叫第二电子层,由里向外以此类推。
(2) 不同原子的电子数不同,电子层数也可能不同,最少的只有一个电子层,如氢原子,最多的有七个电子层。
2. 核外电子的分层排布
①核外电子分层排布
二 三 四 五 六 七
K L M N O P Q
电子层
离核远近 近 远
能量高低 低 高
②核外电子离核越近,能量越低;离核越远。能量越高
⑤第一层电子数不超过 2 个,最外层电子数不超过 8 个,第二层电子数不超过 8个。
④核外电子总是先排满能量低的电子层,再进入能量较高的电子层。
③核外电子最少有 1 层,最多有 7 层。
活动探究
1-18元素原子结构示意图
找出其中的金属元素,非金属元素,稀有气体元素。
并分析它们各自的最外层电子数有什么特点。
元素的种类以及化学性质与原子最外层电子数关系:
③稀有气体的原子最外层都有 电子(氦为____个电子),不易_____
也不易_____电子,是一种相对稳定结构。
①金属的原子最外层电子一般_____4个,在化 学反应中易 电子;
②非金属的原子最外层电子一般 4个,在化学反应中易______电子;
少于
失去
多于
得到
8
2
失去
得到
结论:
元素的化学性质主要由原子的最外层电子数决定的。
元素的种类由原子的核电荷数(或质子数)决定。
①核外电子总是优先排布在能量最低的电子层上,只有当能量低的电子层被排满后,才能排布在能量较高的电子层上,即排满第1层再排第2层,排满第2层再排第3.....
②第1层电子数不超过2个,第2层电子数不超过8个,最外层电子数不超过8个(第1层为最外层时不超过2个)。
核外电子的分层排布规律
在化学变化中,电中性的原子经常因得到或失去电子而成为带电荷的微粒,这种带电的微粒称为离子。
四、离 子
【离子的定义】
离子的形成
下面是钠原子和氯原子,这两种原子的结构稳定吗?这两种原子该如何变化才能达到稳定呢?
8
2
1
+11
Na
8
2
+11
Na+
失去电子
8
2
8
+17
Cl-
8
2
7
+17
Cl
得到电子
Na+
Cl-
Na+
Cl-
钠离子
原子
失电子
阳离子( + )
氯离子
阴离子( - )
得电子
原子
离子:带有电荷的原子或原子团。
离子带的电荷数等于该原子(或原子团)失去或得到电子的数目。
【离子的分类】
离子
阳离子
阴离子
【离子的表示方法】
(1)离子符号
在元素符号(或原子团)右上角标明所带电荷及电性,标法是先写数字再写“+、-”号,只带1个单位电荷时,数字“1”省略不写,如Na+、Cl-等。如果要表示几个离子,则在离子符号前面加数字即可。
(2)离子的读法
根据离子的表示方法,读作“带几个单位正(负)电荷的某离子”例如Na+、Mg2+、Cl- 分别读作钠离子、(带两个单位正电荷的)镁离子、氯离子。
(3)离子符号的含义(数字“2”的意义)
归纳与小结
离子符号与化合价的区别
离子偏右数在前
标价正上数置后
【离子的形成】
( 1 ) 金属元素原子最外层电子数一般小于4,在化学反应中易失去电子,从而使质子数大于核外电子数,参加反应的原子带上正电荷形成阳离子,电子层数减少一层。
( 2 ) 非金属元素原子的最外层电子数一般大于4,在化学反应中易得到电子,从而使质子数小于核外电子数,参加反应的原子带上负电荷形成阴离子,电子层数不变。
【离子的结构】
(1)和对应的原子比较,阳离子少一个电子层,阴离子的电子层数不变。
(2)阴阳离子核外电子排布与具有相同电子层数的稀有气体元素原子的核外电子排布相同。
分子、原子、离子之间的转化
例1.(2021·吉林长春市·中考真题)物质是由微观粒子构成的,下
列物质由离子直接构成的是( )
A.氯化钠 B.氢气
C.金刚石 D.二氧化碳
【典例精讲】
A
【解析】A、氯化钠由钠离子和氯离子构成,符合题意;B、氢气由氢分子构成,不符合题意;C、金刚石由碳原子构成,不符合题意;D、二氧化碳由二氧化碳分子构成,不符合题意。故选A。
【典例精讲】
例2.(2021山东聊城二模)下列关于微观粒子说法不
正确的是( )
A.分子的质量一定比原子的质量大
B.同种原子可以构成不同种分子
C.所有原子都由原子核和核外电子构成
D.原子得到或失去电子变成离子
A
【答案】C
【解析】A、核内质子数决定元素的种类,故上述五种微粒只涉及四种元素,此选项表述正确;B、最外层电子数决定元素的化学性质,当最外层是8电子时,化学性质比较稳定,此选项表述正确;C、原子不带电,核内质子数等于核外电子数,阴离子带负电,核内质子数小于核外电子数,阳离子带正电,核内质子数大于核外电子数,故①②④属于原子,③属于阳离子,⑤属于阴离子,此选项表述不正确;D、①对应的元素是F,④对应的元素是Na,两种元素组成化合物的化学式为NaF,此选项表述正确。故选C。
【典例精讲】
C
例3. (2021湖南常德)如图是五种微粒的结构示意图,下列说法不正确的是( )
A.上述五种微粒只涉及四种元素
B.②③⑤表示的微粒性质较稳定
C.①②④属于原子,③⑤属于阴离子
D.①④对应元素组成化合物的化学式为NaF
-
【答案】C
【解析】A、核内质子数决定元素的种类,故上述五种微粒只涉及四种元素,此选项表述正确;B、最外层电子数决定元素的化学性质,当最外层是8电子时,化学性质比较稳定,此选项表述正确;C、原子不带电,核内质子数等于核外电子数,阴离子带负电,核内质子数小于核外电子数,阳离子带正电,核内质子数大于核外电子数,故①②④属于原子,③属于阳离子,⑤属于阴离子,此选项表述不正确;D、①对应的元素是F,④对应的元素是Na,两种元素组成化合物的化学式为NaF,此选项表述正确。故选C。
例3.某元素R的原子核带x个正电荷,则R2+的核外电子总数为 ( )
A.x-2 B.x+2
C.x D.无法确定
解析:原子核的电荷数减去失去的电子数2,即为该离子的电子数。
【典例精讲】
A
1.(2021四川省成都市青白江中学校二模)下列关于分子的叙述中,正确的是( )
A.一切物质都是由分子构成的
B.分子是化学变化中的最小粒子
C.分子是不能再分的一种粒子
D.分子是保持物质化学性质的最小粒子
D
【达标测评】
1.(2021成都市通锦中学校一模)用分子的知识解释下列现象,正确的是( )
A.缉毒犬能根据气味发现毒品,是由于分子不断运动
B.铁丝在空气中不燃烧而在氧气中燃烧,说明空气中和氧气中的氧分子化学性质不同
C.变瘪的乒乓球放入热水中能鼓起来,是由于分子受热体积变大
D.降温能使水结成冰,是因为在低温下水分子静止不动
A
【达标测评】
【达标训练】
2.(2021崇州市崇庆中学实验学校erm ) 下列对分子、原子、离子的认识正确的是( )
A.同种分子排列方式不同,化学性质不同
B.在干冰中,分子因相互作用而静止不动
C.同种原子按不同方式结合,可以构成不同的物质
D.原子得失电子形成离子后,原子核发生了变化
C
3.(2021金堂县福兴镇初级中学二模)在下列示意图表示的粒子中,属于原
子的有 (填序号,下同),属于阳离子的有 ,属于阴离子的
有 ,属于同种元素的为 。
②⑤⑥
①④
③
④⑤
【达标训练】
构成物质的基本微粒
原子
分子
微粒的性质
离子
很小
不断运动
有空隙
概念
很小
不断运动
有空隙
概念
构成
相对原子质量
相对分子质量
概念
分类
归纳与总结
归纳与总结
分子与原子的区别和联系
分子 原子
基本性质
定 义
本质区别
联 系
体积小、质量小、不停地运动、微粒之间有间隔
保持物质化学性质的最小粒子
化学变化中的最小粒子
化学变化中分子可以再分,而原子不能再分
分子可以分裂为原子,原子可以相互结合形成分子
离子与原子的区别
粒子种类 原子 离子
阳离子 阴离子
区 别 粒子结构
化学性质
电 性
符 号
联 系
核内质子=
核外电子数
核内电子数>
核外电数
核内电子数<
核外电子数
不一定稳定
较稳定
较稳定
不显电性
带正电
带负电
用元素符号表示:
如:S、Na……
用阳离子符号表示:
如:Na+Mg2+……
用阴离子符号表示:
如:Cl-、O2-……
原子
阳离子
失电子
得电子
失电子
得电子
阴离子
用分子或原子的观点解释下列问题:
1.物理变化和化学变化
物质发生物理变化时,分子本身没有变化,改变的只是分子间的间隔;
发生化学变化时,分子本身发生了变化,变成了别的物质的分子。
2.化学变化的本质:
在化学变化中分子分裂成原子,原子不能再分,而是重新构成新的分子。
3.运用分子的概念区分纯净物和混合物
由同种分子构成的物质是纯净物;由多种不同的分子构成的物质是混合物。
1.完成配套练习册;
2.预习组成物质的化学元素。
【作业布置】
谢 谢!
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
