4.2 化学反应中的质量关系(课件32页)
文档属性
| 名称 | 4.2 化学反应中的质量关系(课件32页) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-25 16:17:48 | ||
图片预览









文档简介
(共32张PPT)
课题1 物质的变化和性质
沪教版 化学(初中)
第2节 化学反应中的质量关系
同步课堂
学习目标:
重点难点:
1.通过实验探究,了解质量守恒定律,认识定量研究对化学科学
发展的重大作用;
2.会用微粒的观点对质量守恒定律作出解释;
3.能用质量守恒定律解释常见的化学反应中的质量关系。
1、用微粒的观点对质量守恒定律作出解释。
2、用质量守恒定律解释常见的化学反应中的质量关系。
【新课引入】
那么,化学反应前后物质的总质量发生变化吗?
物质发生化学变化都有新物质产生,同时还伴随着能量的释放或吸收。
1、火柴燃烧后只余下少许灰烬。
2、铜丝片在火焰上加热,表面变黑,质量增大。
化学变化前后物质总质量发生变化吗?
学习过程:
对物质变化要进行定量研究。
本课将通过科学探究来定量认识化学反应中各物质质量之间的关系。
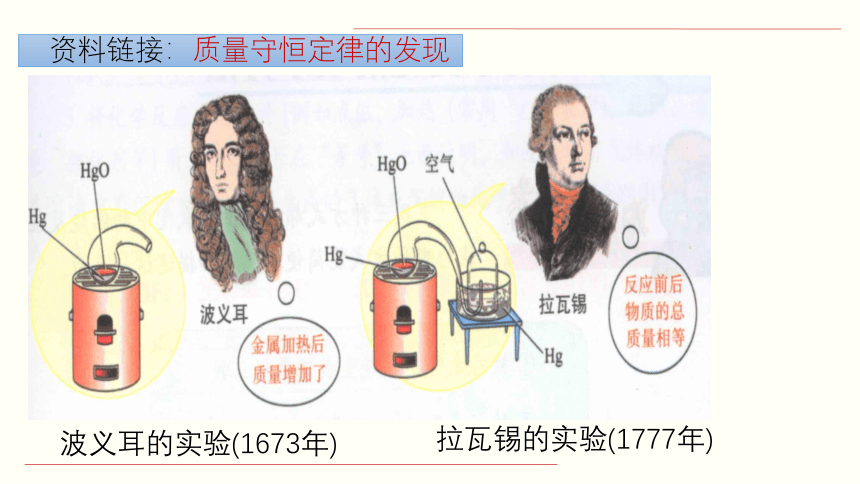
资料链接:质量守恒定律的发现
波义耳的实验(1673年)
拉瓦锡的实验(1777年)
提出问题:
参加化学反应的各物质都发生了变化,并有新物质生成。那么,参加反应的各物质质量总和与反应生成的各物质质量总和相比较,是否发生了变化?
活动与探究
猜想与假设:
1.发生了变化,反应生成的各物质的质量总和大于参加反应的各物质的质量总和。
2.发生了变化,反应生成的各物质的质量总和小于参加反应的各物质的质量总和。
3.没有变化,反应生成的各物质的质量总和等于参加反应的各物质的质量总和。
你的猜想是什么?
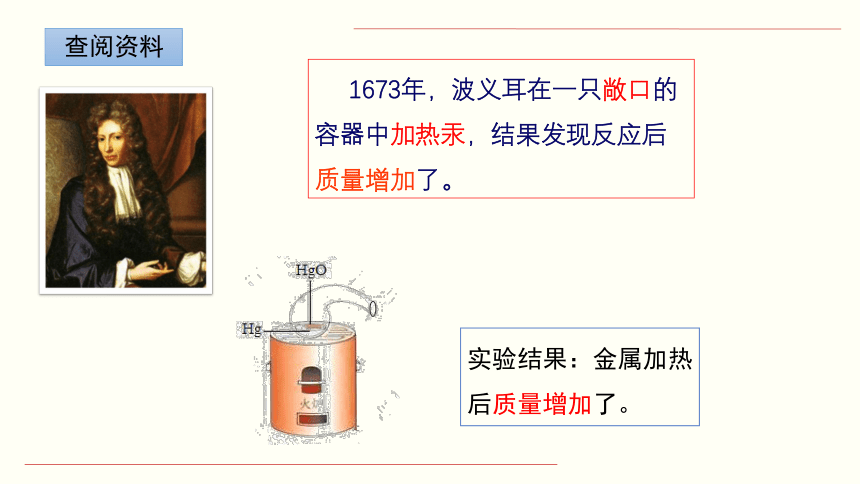
实验结果:金属加热后质量增加了。
查阅资料
1673年,波义耳在一只敞口的容器中加热汞,结果发现反应后质量增加了。
实验结果:反应前后物质的总质量相等。
查阅资料
1777年,拉瓦锡在密封容器中研究氧化汞的分解与生成实验,结果发现反应后质量不变。
法国化学家拉瓦锡
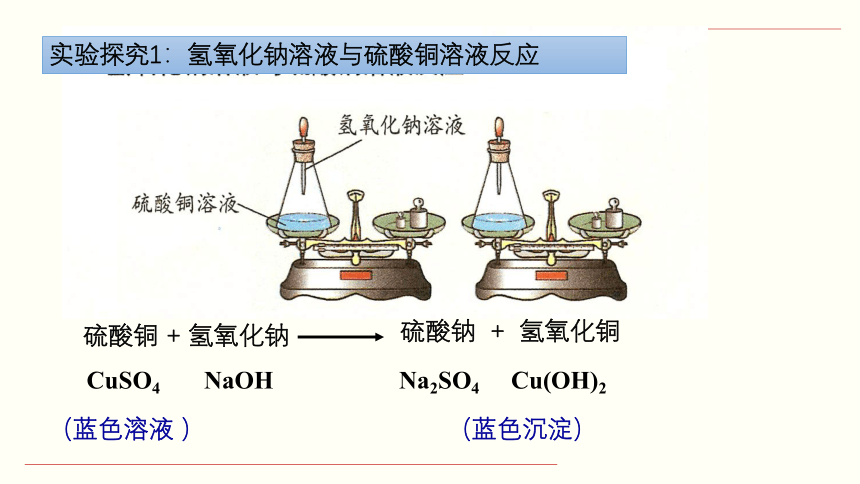
(蓝色溶液 ) (蓝色沉淀)
硫酸铜 + 氢氧化钠
CuSO4 NaOH Na2SO4 Cu(OH)2
实验探究1:氢氧化钠溶液与硫酸铜溶液反应
硫酸钠 + 氢氧化铜
实验1现象:
产生蓝色沉淀;溶液蓝色逐渐变浅;总质量不变
(天平仍然保持平衡)。
结 论:
反应前后,物质的总质量相等。
碳酸钙 + 盐酸 → 氯化钙 + 二氧化碳 + 水
CaCO3 HCl CaCl2 CO2 H2O
实验探究2:碳酸钙与盐酸反应
有气体放出
实验2现象:
锥形瓶内有大量气泡产生;石灰石逐渐减少;活塞向上移动;总质量不变(天平仍然保持平衡 )。
结 论:
反应前后,物质的总质量相等。
结论和反思
结论:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。(质量守恒定律)
质量守恒定律注意点:
①“参加”:研究的是参加反应的那部分质量;
②“化学反应”:不适用物理变化;
③“质量”:只有质量守恒,体积等其他方面不一定守恒;
④“总和”:守恒的是总质量而不是单个的物质质量。
1、实验中要注意哪些问题?
如:有气体参加或有气体生成的化学反应用来验证质量守恒定律时,整个装置必须密闭。
2、从化学变化的本质如何解释得到的结论?
化学变化的实质就是原子的重新组合。
分解 重新组合 构成
分子-----→原子--------→新分子-----→新物质
构成
交流与讨论
你能用物质由微粒构成的观点对质量守恒定律作出解释吗?请以金属镁和氧气的反应为例说明。
+
Mg O2 Mg O
交流与讨论
原子数:氧原子:2
镁原子:2
氧原子:2
镁原子:2
相对质量:24×2+16×2=80
2×(24 +16 )=80
参加反应的各物质质量总和
反应生成的各物质质量总和
化学反应前后
原子数目、原子种类、原子质量
原子数目、原子种类、原子质量
都不 变
微观分析
②三不变:原子种类、数目、质量不变;
质量守恒定律的微观本质:
①过程:分子分解成原子,原子重新组合成新分子;
③一变:分子种类改变。
1.质量守恒定律:参加化学反应的各物质的质量
总和等于反应后生成的各物质的质量总和。
2.质量守恒定律微观解释:化学反应前后原子的
种类、数目、质量没有改变。
课 堂 小 结
例1. (2021·湖南湘潭)根据如下微观示意图分析,下列结论正确的是( )
A.反应前后原子种类不变
B.丙物质的相对分子质量是18g
C.参加反应的甲与乙分子个数比为1:1
D.反应前后各元素的化合价均不变
【典例精讲】
C
【答案】A
【解析】A、由图可知,反应前后原子种类数目不变,A正确;B、相对分子质量单位是“1”不是“g”,B错误;C、由微观示意图可知,反应化学方程式2C2H6+7O2 4CO2+6H2O,故参加反应的甲与乙分子个数比为2:7,C错误;D、反应前氧气为单质,氧元素0价,反应后氧元素-2价,化合价改变,D错误。故选:A。
【典例精讲】
例2.(2021·天津)将16g纯净物R在足量氧气中完全燃烧,生成44g二氧化碳和36g水。下列判断正确的是( )
A.R只含碳、氢元素
B.消耗氧气32g
C.R含碳、氢、氧三种元素
D.R中碳元素的质量分数为70%
A
【答案】A
【解析】由分析得:A、R只含碳、氢元素,正确;B、根据质量守恒定律,消耗氧气为44+36-16=64g,错误;C、 R含碳、氢、氧三种元素,错误;D. R中碳元素的质量分数为 ,错误。故选A。
【典例精讲】
C
例3(2021·河北省卷)利用催化剂将废气中的二氧化碳转化为燃料X,是实现“碳中和”的路径之一,该反应的化学方程式为CO2+3H2 X+H2O,X的化学式为( )
A.CO B.CH4
C.CH3OH D.C2H5OH
-
【答案】C
【解析】根据质量守恒定律,反应前后原子的种类、数目不变,反应前C、H、O的原子个数分别为1、6、2,反应后C、H、O的原子个数分别为0、2、1,所以1个X分子中含有1个碳原子、4个氢原子和1个氧原子,X的化学式为CH3OH;故选C。
【典例精讲】
A
例4. (2021·黑龙江中考真题)密闭容器中有甲、乙、丙、丁四种物质,
在一定条件下发生化学反应,测得反应前后有关数据如下:
关于此反应说法正确的是( )
A.该反应是分解反应 B.物质乙一定是该反应的催化剂
C.待测数值是14 D.反应中甲与丙变化的质量比4∶7
物质 甲 乙 丙 丁
反应前质量/g 6 2 14 35
反应后质量/g 待测 2 22 13
【答案】A
【解析】A、根据分析,该反应中丁是反应物,甲和丙是生成物,符合分解反应的特征,选项A正确;B、物质乙在反应过程中质量没有发生变化,可能是催化剂,也可能是其他没有参加反应的物质,选项B不正确;C、根据分析,反应中甲增加了14g,因此待测数值是14g+6g=20g,选项C不正确;D、该反应中甲的质量增加了14g,丙的质量增加了8g,反应中甲与丙变化的质量比为:14∶8=7:4,选项D不正确。故选A。
1.下列现象能用质量守恒定律解释的是( )
A.水结冰前后质量不变
B.1升芝麻和1升大米混合,总体积小于2升
C.在降温加压的条件下,氧气变为淡蓝色液体
D.氧化钙与水反应生成氢氧化钙,反应前后物质的总质量不变
D
【达标测评】
【达标测评】
2.在一定密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如下
物质 X Y Z Q
反应前质量 2 2 84 5
反应后质量 待测 24 0 14
求反应后X的质量 ,该反应属于 反应.
55
分解
1.完成配套练习册;
2.预习组成物质的化学元素。
【作业布置】
谢 谢!
课题1 物质的变化和性质
沪教版 化学(初中)
第2节 化学反应中的质量关系
同步课堂
学习目标:
重点难点:
1.通过实验探究,了解质量守恒定律,认识定量研究对化学科学
发展的重大作用;
2.会用微粒的观点对质量守恒定律作出解释;
3.能用质量守恒定律解释常见的化学反应中的质量关系。
1、用微粒的观点对质量守恒定律作出解释。
2、用质量守恒定律解释常见的化学反应中的质量关系。
【新课引入】
那么,化学反应前后物质的总质量发生变化吗?
物质发生化学变化都有新物质产生,同时还伴随着能量的释放或吸收。
1、火柴燃烧后只余下少许灰烬。
2、铜丝片在火焰上加热,表面变黑,质量增大。
化学变化前后物质总质量发生变化吗?
学习过程:
对物质变化要进行定量研究。
本课将通过科学探究来定量认识化学反应中各物质质量之间的关系。
资料链接:质量守恒定律的发现
波义耳的实验(1673年)
拉瓦锡的实验(1777年)
提出问题:
参加化学反应的各物质都发生了变化,并有新物质生成。那么,参加反应的各物质质量总和与反应生成的各物质质量总和相比较,是否发生了变化?
活动与探究
猜想与假设:
1.发生了变化,反应生成的各物质的质量总和大于参加反应的各物质的质量总和。
2.发生了变化,反应生成的各物质的质量总和小于参加反应的各物质的质量总和。
3.没有变化,反应生成的各物质的质量总和等于参加反应的各物质的质量总和。
你的猜想是什么?
实验结果:金属加热后质量增加了。
查阅资料
1673年,波义耳在一只敞口的容器中加热汞,结果发现反应后质量增加了。
实验结果:反应前后物质的总质量相等。
查阅资料
1777年,拉瓦锡在密封容器中研究氧化汞的分解与生成实验,结果发现反应后质量不变。
法国化学家拉瓦锡
(蓝色溶液 ) (蓝色沉淀)
硫酸铜 + 氢氧化钠
CuSO4 NaOH Na2SO4 Cu(OH)2
实验探究1:氢氧化钠溶液与硫酸铜溶液反应
硫酸钠 + 氢氧化铜
实验1现象:
产生蓝色沉淀;溶液蓝色逐渐变浅;总质量不变
(天平仍然保持平衡)。
结 论:
反应前后,物质的总质量相等。
碳酸钙 + 盐酸 → 氯化钙 + 二氧化碳 + 水
CaCO3 HCl CaCl2 CO2 H2O
实验探究2:碳酸钙与盐酸反应
有气体放出
实验2现象:
锥形瓶内有大量气泡产生;石灰石逐渐减少;活塞向上移动;总质量不变(天平仍然保持平衡 )。
结 论:
反应前后,物质的总质量相等。
结论和反思
结论:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。(质量守恒定律)
质量守恒定律注意点:
①“参加”:研究的是参加反应的那部分质量;
②“化学反应”:不适用物理变化;
③“质量”:只有质量守恒,体积等其他方面不一定守恒;
④“总和”:守恒的是总质量而不是单个的物质质量。
1、实验中要注意哪些问题?
如:有气体参加或有气体生成的化学反应用来验证质量守恒定律时,整个装置必须密闭。
2、从化学变化的本质如何解释得到的结论?
化学变化的实质就是原子的重新组合。
分解 重新组合 构成
分子-----→原子--------→新分子-----→新物质
构成
交流与讨论
你能用物质由微粒构成的观点对质量守恒定律作出解释吗?请以金属镁和氧气的反应为例说明。
+
Mg O2 Mg O
交流与讨论
原子数:氧原子:2
镁原子:2
氧原子:2
镁原子:2
相对质量:24×2+16×2=80
2×(24 +16 )=80
参加反应的各物质质量总和
反应生成的各物质质量总和
化学反应前后
原子数目、原子种类、原子质量
原子数目、原子种类、原子质量
都不 变
微观分析
②三不变:原子种类、数目、质量不变;
质量守恒定律的微观本质:
①过程:分子分解成原子,原子重新组合成新分子;
③一变:分子种类改变。
1.质量守恒定律:参加化学反应的各物质的质量
总和等于反应后生成的各物质的质量总和。
2.质量守恒定律微观解释:化学反应前后原子的
种类、数目、质量没有改变。
课 堂 小 结
例1. (2021·湖南湘潭)根据如下微观示意图分析,下列结论正确的是( )
A.反应前后原子种类不变
B.丙物质的相对分子质量是18g
C.参加反应的甲与乙分子个数比为1:1
D.反应前后各元素的化合价均不变
【典例精讲】
C
【答案】A
【解析】A、由图可知,反应前后原子种类数目不变,A正确;B、相对分子质量单位是“1”不是“g”,B错误;C、由微观示意图可知,反应化学方程式2C2H6+7O2 4CO2+6H2O,故参加反应的甲与乙分子个数比为2:7,C错误;D、反应前氧气为单质,氧元素0价,反应后氧元素-2价,化合价改变,D错误。故选:A。
【典例精讲】
例2.(2021·天津)将16g纯净物R在足量氧气中完全燃烧,生成44g二氧化碳和36g水。下列判断正确的是( )
A.R只含碳、氢元素
B.消耗氧气32g
C.R含碳、氢、氧三种元素
D.R中碳元素的质量分数为70%
A
【答案】A
【解析】由分析得:A、R只含碳、氢元素,正确;B、根据质量守恒定律,消耗氧气为44+36-16=64g,错误;C、 R含碳、氢、氧三种元素,错误;D. R中碳元素的质量分数为 ,错误。故选A。
【典例精讲】
C
例3(2021·河北省卷)利用催化剂将废气中的二氧化碳转化为燃料X,是实现“碳中和”的路径之一,该反应的化学方程式为CO2+3H2 X+H2O,X的化学式为( )
A.CO B.CH4
C.CH3OH D.C2H5OH
-
【答案】C
【解析】根据质量守恒定律,反应前后原子的种类、数目不变,反应前C、H、O的原子个数分别为1、6、2,反应后C、H、O的原子个数分别为0、2、1,所以1个X分子中含有1个碳原子、4个氢原子和1个氧原子,X的化学式为CH3OH;故选C。
【典例精讲】
A
例4. (2021·黑龙江中考真题)密闭容器中有甲、乙、丙、丁四种物质,
在一定条件下发生化学反应,测得反应前后有关数据如下:
关于此反应说法正确的是( )
A.该反应是分解反应 B.物质乙一定是该反应的催化剂
C.待测数值是14 D.反应中甲与丙变化的质量比4∶7
物质 甲 乙 丙 丁
反应前质量/g 6 2 14 35
反应后质量/g 待测 2 22 13
【答案】A
【解析】A、根据分析,该反应中丁是反应物,甲和丙是生成物,符合分解反应的特征,选项A正确;B、物质乙在反应过程中质量没有发生变化,可能是催化剂,也可能是其他没有参加反应的物质,选项B不正确;C、根据分析,反应中甲增加了14g,因此待测数值是14g+6g=20g,选项C不正确;D、该反应中甲的质量增加了14g,丙的质量增加了8g,反应中甲与丙变化的质量比为:14∶8=7:4,选项D不正确。故选A。
1.下列现象能用质量守恒定律解释的是( )
A.水结冰前后质量不变
B.1升芝麻和1升大米混合,总体积小于2升
C.在降温加压的条件下,氧气变为淡蓝色液体
D.氧化钙与水反应生成氢氧化钙,反应前后物质的总质量不变
D
【达标测评】
【达标测评】
2.在一定密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如下
物质 X Y Z Q
反应前质量 2 2 84 5
反应后质量 待测 24 0 14
求反应后X的质量 ,该反应属于 反应.
55
分解
1.完成配套练习册;
2.预习组成物质的化学元素。
【作业布置】
谢 谢!
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
