第2章 身边的化学物质单元复习(课件36页)
文档属性
| 名称 | 第2章 身边的化学物质单元复习(课件36页) |  | |
| 格式 | pptx | ||
| 文件大小 | 738.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-25 16:54:18 | ||
图片预览










文档简介
(共36张PPT)
课题1 物质的变化和性质
沪教版 化学(初中)
第2章 身边的化学物质
(复 习)
同步课堂
学习目标:
重点难点:
1.掌握氧气的性质及实验室制取氧气的方法。
2.掌握二氧化碳的性质及实验室制取二氧化碳的方法。
3.掌握水的组成及常见的净水方法
1.氧气的实验室制取方法。
2. 二氧化碳的实验室制取方法。
性质活泼的氧气
复习过程:
一、氧气的性质和用途
1、物理性质:在通常状况下,氧气是一种 色、 味的气体, 溶于水,密度比空气 。在压强为101KPa时,温度为-183℃时可变为 色液体,在-218℃时可变为 色 状固体。
2、化学性质:氧气的化学性质 ,能与许多物质发生化学反应,是一种常见的 。
无
无
不易
略大
淡蓝
雪花
比较活泼
氧化剂(助燃剂)
淡蓝
性质活泼的氧气
1、与非金属反应:
S + O2 == SO2
点燃
C + O2 == CO2
点燃
4P + 5O2 == 2P2O5
点燃
2H2 + O2 == 2H2O
点燃
淡蓝色火焰(空气中)
明亮的蓝紫色火焰(纯氧中)
均有刺激性气味气体产生。
淡蓝色火焰
黄白色火焰,产生大量白烟
红光(空气中)
白光(纯氧中)
均产生使澄清的石灰水变浑浊的气体。
性质活泼的氧气
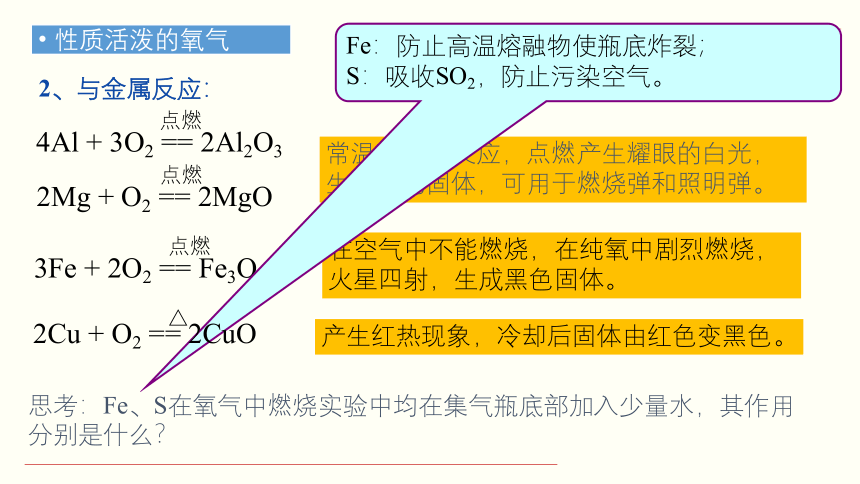
2、与金属反应:
2Mg + O2 == 2MgO
点燃
4Al + 3O2 == 2Al2O3
点燃
3Fe + 2O2 == Fe3O4
点燃
常温下即可反应,点燃产生耀眼的白光,生成白色固体,可用于燃烧弹和照明弹。
在空气中不能燃烧,在纯氧中剧烈燃烧,火星四射,生成黑色固体。
产生红热现象,冷却后固体由红色变黑色。
思考:Fe、S在氧气中燃烧实验中均在集气瓶底部加入少量水,其作用分别是什么?
Fe:防止高温熔融物使瓶底炸裂;
S:吸收SO2,防止污染空气。
2Cu + O2 == 2CuO
△
明亮的蓝色火焰
3、与化合物反应
2CO + O2 == 2CO2
点燃
CH4 + 2O2 == CO2 + 2H2O
点燃
蓝色火焰
性质活泼的氧气
二、化合反应、氧化反应、分解反应
化合反应:两种或两种以上的物质生成另一种物质的反应。
氧化反应:物质跟氧发生的反应。
氧可以是氧气,也可以是含氧化合物;氧气是氧化剂,具有氧化性。
联系:化合反应不一定是氧化反应,氧化反应不一定是化合反应。
CaO + H2O == Ca(OH)2 CH4 + 2O2 == CO2 + 2H2O
性质活泼的氧气
氧化反应
剧烈
氧化
缓慢
氧化
有限空间:爆炸
广阔空间:燃烧(发光、 放热)
呼吸、食物变质、酒和醋的酿造、铁生锈、农家肥腐熟
性质活泼的氧气
三、氧气的实验室制法
1、反应原理:
2H2O2 == 2H2O + O2↑
MnO2
2KClO3 == 2KCl + 3O2↑
MnO2
2KMnO4 == K2MnO4 + MnO2 + O2↑
△
性质活泼的氧气
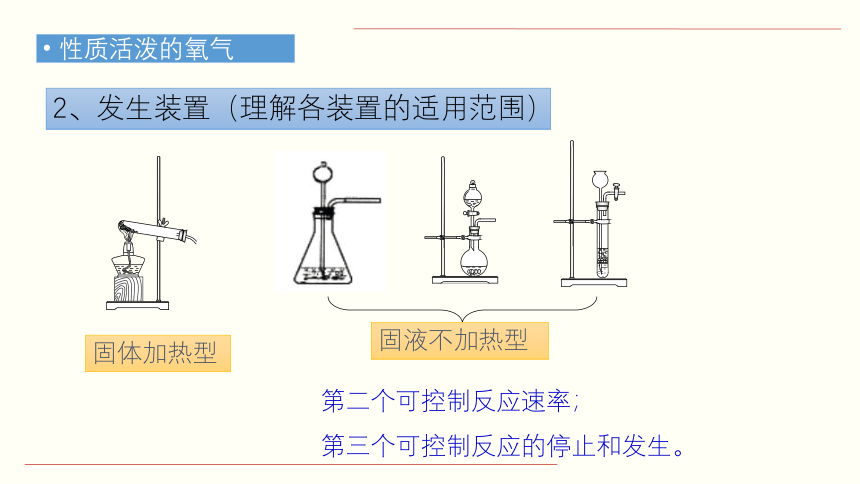
2、发生装置(理解各装置的适用范围)
固体加热型
固液不加热型
第二个可控制反应速率;
第三个可控制反应的停止和发生。
性质活泼的氧气
性质活泼的氧气
3.注意事项:
1、药品平铺在试管底部的原因:使药品受热均匀。
2、铁夹夹在离试管口约1/3处。
3、导管伸入试管不能太长的原因:便于气体的排出。
4、试管口略向下倾斜的原因:
防止冷凝水倒流至试管底部,炸裂试管。
5、用酒精灯的外焰先均匀预热,再集中在有药品的部位集中加热。
6、等有连续的气泡产生时再收集的原因:
刚加热时产生的气泡中混有空气,这时的气体不纯。
7、实验完毕,先撤导管,后移酒精灯原因:
防止试管冷却后,水槽内的水沿导管上升,进入试管,使试管破裂。
8、收集满的氧气,应正放在桌面上,并用毛玻璃片盖上原因:
氧气密度比空气略大。
9、试管口应放一团棉花:
防止高锰酸钾粉末进入导管
性质活泼的氧气
性质活泼的氧气
5、检验与验满:
带火星的木条
伸入集气瓶
放在瓶口
检验
验满
a
b
4.收集方法:(分析采用原因,适用范围)
排水法
收集较纯净的气体
向上排空气法
收集干燥的气体
向上排空气法由 端进气,排水法由 端进气。
a
b
四、催化剂和催化作用
催化剂:是指在化学反应中能增大其它物质的反应速率,而本身的 质量和化学性质在反应前后都没有改变的物质。
特点:一变两不变。
改变化学反应速率,不同的反应用不同的催化剂;反应前后质量和化学性质不变。
注意:没有催化剂也可反应;催化剂不能改变生成物的数量;催化剂参与反应。
性质活泼的氧气
五、工业制取氧气
空气
(气态)
加压
降温
空气
(液态)
蒸发
N2 -196℃
O2 -183℃
物理变化
性质活泼的氧气
奇妙的二氧化碳
一、二氧化碳在自然界中的循环
1、CO2的生成
⑴动植物的 ;
⑵化石燃料的 ;
⑶动植物尸体的 ;
2、CO2的消耗
植物的 。
呼 吸
燃 烧
腐 烂
光合作用
二.二氧化碳的性质
1.物理性质
通常CO2是____色、____味的气体,密度比空气__ _,__ _ _溶于水。固体CO2俗称_________,易升华吸热,可作_________。
无
无
大
可
干冰
制冷剂
2.化学性质
①二氧化碳既不燃烧也不支持燃烧
向放有阶梯蜡烛的烧杯中倾倒CO2,____面的蜡烛先熄灭,这个实验说明了a.CO2的密度比空气____;b.__________________________ 。
下
大
既不燃烧也不支持燃烧
奇妙的二氧化碳
②二氧化碳与水反应
CO2通入水中生成_________________,反应的化学方程式为__________________________,碳酸不稳定,易分解,反应的化学方程式为_______________________。
碳酸(或H2CO3)
H2O+CO2===H2CO3
H2CO3===H2O+CO2↑
解释CO2通入石蕊试液,使溶液变红。
③二氧化碳与碱反应
向澄清的石灰水里通入CO2,石灰水变_________,这是由于生成了___________________的缘故,其化学方程式为__________________________________,这个反应可用来鉴定CO2气体(吸收用NaOH溶液)。
浑浊
白色不溶性碳酸钙
CO2+Ca(OH)2===CaCO3↓+H2O
奇妙的二氧化碳
④二氧化碳不能供给呼吸
二氧化碳本身没有毒性,但当空气中的CO2超过正常含量时,会对人体健康产生影响。在进入久未开启的菜窖、干涸的深井和深洞底部之前,必须先做________试验。
灯火
奇妙的二氧化碳
(2)实验室制法
①反应原理
利用________或__________和_________反应制取,化学方程式为 。
石灰石
大理石
CaCO3+2HCl===CaCl2+H2O+CO2↑
三.二氧化碳的制法
(1)工业制法
工业上利用煅烧_____________的方法制取CO2,化学方程式为_________________________。
石灰石
奇妙的二氧化碳
稀盐酸
CaCO3===CaO+CO2↑
奇妙的二氧化碳
②实验装置
(发生装置取决于 和 。)
反应物状态
反应条件
制取少量CO2
制取较多CO2
可控制反应的发生和停止
可控制反应速率
奇妙的二氧化碳
③收集和验满方法
收集:______________法
验满:将燃烧的木条________________,木条熄灭说明已收集满。
向上排空气
靠近集气瓶口
思考:收集方法与气体的哪些性质有关?
密度、水溶性已及是否与水和氧气反应。
a进b出
短进长出
奇妙的二氧化碳
④检验方法
将_____________倒入集气瓶中振荡,溶液变____ ,说明气体为CO2。
⑤干燥方法
通常使用_________对CO2进行干燥,不能使用___________、_______进行干燥。
澄清的石灰水
浑浊
浓硫酸
碱石灰
烧碱固体
长进短出
发生装置→净化装置→干燥装置→收集装置→尾气处理
四.二氧化碳的用途
(1)根据CO2不燃烧也不支持燃烧且密度大于空气的性质,可用来______________。
(2)二氧化碳是一种工业原料,可以用于制纯碱、尿素和__________等工业。
(3)干冰可用作___________,可用于保藏很容易腐败的食品,还可用于____________。
(4)在温室里施用CO2作___________,可以提高农作物的产量。
灭 火
汽 水
制冷剂
人工降雨
肥 料
奇妙的二氧化碳
1、水通电分解
化学方程式 2H2O == 2H2↑ + O2 ↑
电极
体积比
质量比
气体检验方法
现象
实验结论
通电
负极
正极
2 ︰ 1
1 ︰ 8
点燃 带火星的木条
淡蓝色火焰 复燃
水由氢元素和氧元素组成
每个水分子由两个氢原子和一个氧原子构成
分子可分解成原子,原子又可构成新的分子
自然界中的水
注意:
1、水电解通的是 电;
2、为增强溶液的导电性,可在水中加入少量 或 溶液。
3、体积比小于1︰2的原因:
氧气的溶解度大于氢气
氧气可能与电极材料反应
直流
H2SO4
NaOH
4、收集的氢气较少时,可能只发出爆鸣声,而看不到淡蓝色火焰。
5、点燃氢气等可燃性气体前要验纯。
2H2 + O2 == 2H2O
点燃
自然界中的水
2、水与某些非金属氧化物反应生成含氧酸
CO2 + H2O == H2CO3
SO2 + H2O == H2SO3
SO3 + H2O == H2SO4
3、水与某些金属氧化物反应生成可溶性碱
CaO + H2O == Ca(OH)2
自然界中的水
纯净水:不含任何杂质的水,属于纯净物,
如医用蒸馏水。
自然水:河水、湖水、井水、海水含有杂质,
属于混合物。
自然水
不溶性杂质(如泥沙)
可溶性杂质(各种离子)
微生物
1、
自然界中的水
自来水厂通常对天然水进行 、 、 、 等处理达到饮用水标准。
过滤
吸附
消毒
加絮凝剂
除悬浮物
明矾
过滤
除不溶物
砂石
吸附
除有气味有色物质
活性炭
消毒
除微生物
ClO2
沉降
自然界中的水
3、硬水和软水
⑴硬水是含有 较多的水,软水是含 较少的水。
⑵硬水和软水常用 来区分,产生泡沫较多的是 ,产生泡沫少的是 。
⑶硬水的软化方法:
生活中用煮沸法
工业上用蒸馏法
Ca2+ Mg2+
Ca2+ Mg2+
肥皂水
软水
硬水
⑷硬水的危害:
生活中洗衣服洗不干净且浪费肥皂;
锅炉易结水垢,严重时会导致爆炸。
自然界中的水
1. (2020江苏扬州)氧气是空气的主要成分之一。下列说法不正确的是( )
A. 通常状况下,O2是无色气体
B. 相同条件下,O2的密度大于CO2
C. 分离液态空气可获得O2
D. O2能够支持可燃物的燃烧
典例精讲
B
2.(2021·广西梧州市·中考真题)下列对实验现象的描述,错误的
是( )
A.铁丝在氧气中燃烧,火星四射,生成黑色固体
B.镁条燃烧时,发出耀眼的白光,生成白色固体
C.乙炔在空气中燃烧,火焰为淡蓝色,生成刺激性气味的气体
D.在蜡烛火焰上方罩一个冷而干燥的烧杯,发现烧杯内壁有液滴
C
3.(2021·北京中考真题)将CO2通入下列液体中,能产生
白色沉淀的是( )
A.水 B.稀硫酸
C.食盐水 D.澄清石灰水
D
4.(2021·辽宁中考真题)有关水的净化,下列说法错
误的是( )
A.活性炭吸附色素异味
B.投药消毒过程中发生化学变化
C.煮沸可降低水的硬度
D.明矾除去水中所有不溶性杂质
D
5.(2021·北京中考真题)电解水实验如图,下列说法不正确的是( )
A.试管1中得到H2 B.水由H2、O2构成
C.水发生了分解反应 D.水由氢、氧元素组成
B
谢 谢!
课题1 物质的变化和性质
沪教版 化学(初中)
第2章 身边的化学物质
(复 习)
同步课堂
学习目标:
重点难点:
1.掌握氧气的性质及实验室制取氧气的方法。
2.掌握二氧化碳的性质及实验室制取二氧化碳的方法。
3.掌握水的组成及常见的净水方法
1.氧气的实验室制取方法。
2. 二氧化碳的实验室制取方法。
性质活泼的氧气
复习过程:
一、氧气的性质和用途
1、物理性质:在通常状况下,氧气是一种 色、 味的气体, 溶于水,密度比空气 。在压强为101KPa时,温度为-183℃时可变为 色液体,在-218℃时可变为 色 状固体。
2、化学性质:氧气的化学性质 ,能与许多物质发生化学反应,是一种常见的 。
无
无
不易
略大
淡蓝
雪花
比较活泼
氧化剂(助燃剂)
淡蓝
性质活泼的氧气
1、与非金属反应:
S + O2 == SO2
点燃
C + O2 == CO2
点燃
4P + 5O2 == 2P2O5
点燃
2H2 + O2 == 2H2O
点燃
淡蓝色火焰(空气中)
明亮的蓝紫色火焰(纯氧中)
均有刺激性气味气体产生。
淡蓝色火焰
黄白色火焰,产生大量白烟
红光(空气中)
白光(纯氧中)
均产生使澄清的石灰水变浑浊的气体。
性质活泼的氧气
2、与金属反应:
2Mg + O2 == 2MgO
点燃
4Al + 3O2 == 2Al2O3
点燃
3Fe + 2O2 == Fe3O4
点燃
常温下即可反应,点燃产生耀眼的白光,生成白色固体,可用于燃烧弹和照明弹。
在空气中不能燃烧,在纯氧中剧烈燃烧,火星四射,生成黑色固体。
产生红热现象,冷却后固体由红色变黑色。
思考:Fe、S在氧气中燃烧实验中均在集气瓶底部加入少量水,其作用分别是什么?
Fe:防止高温熔融物使瓶底炸裂;
S:吸收SO2,防止污染空气。
2Cu + O2 == 2CuO
△
明亮的蓝色火焰
3、与化合物反应
2CO + O2 == 2CO2
点燃
CH4 + 2O2 == CO2 + 2H2O
点燃
蓝色火焰
性质活泼的氧气
二、化合反应、氧化反应、分解反应
化合反应:两种或两种以上的物质生成另一种物质的反应。
氧化反应:物质跟氧发生的反应。
氧可以是氧气,也可以是含氧化合物;氧气是氧化剂,具有氧化性。
联系:化合反应不一定是氧化反应,氧化反应不一定是化合反应。
CaO + H2O == Ca(OH)2 CH4 + 2O2 == CO2 + 2H2O
性质活泼的氧气
氧化反应
剧烈
氧化
缓慢
氧化
有限空间:爆炸
广阔空间:燃烧(发光、 放热)
呼吸、食物变质、酒和醋的酿造、铁生锈、农家肥腐熟
性质活泼的氧气
三、氧气的实验室制法
1、反应原理:
2H2O2 == 2H2O + O2↑
MnO2
2KClO3 == 2KCl + 3O2↑
MnO2
2KMnO4 == K2MnO4 + MnO2 + O2↑
△
性质活泼的氧气
2、发生装置(理解各装置的适用范围)
固体加热型
固液不加热型
第二个可控制反应速率;
第三个可控制反应的停止和发生。
性质活泼的氧气
性质活泼的氧气
3.注意事项:
1、药品平铺在试管底部的原因:使药品受热均匀。
2、铁夹夹在离试管口约1/3处。
3、导管伸入试管不能太长的原因:便于气体的排出。
4、试管口略向下倾斜的原因:
防止冷凝水倒流至试管底部,炸裂试管。
5、用酒精灯的外焰先均匀预热,再集中在有药品的部位集中加热。
6、等有连续的气泡产生时再收集的原因:
刚加热时产生的气泡中混有空气,这时的气体不纯。
7、实验完毕,先撤导管,后移酒精灯原因:
防止试管冷却后,水槽内的水沿导管上升,进入试管,使试管破裂。
8、收集满的氧气,应正放在桌面上,并用毛玻璃片盖上原因:
氧气密度比空气略大。
9、试管口应放一团棉花:
防止高锰酸钾粉末进入导管
性质活泼的氧气
性质活泼的氧气
5、检验与验满:
带火星的木条
伸入集气瓶
放在瓶口
检验
验满
a
b
4.收集方法:(分析采用原因,适用范围)
排水法
收集较纯净的气体
向上排空气法
收集干燥的气体
向上排空气法由 端进气,排水法由 端进气。
a
b
四、催化剂和催化作用
催化剂:是指在化学反应中能增大其它物质的反应速率,而本身的 质量和化学性质在反应前后都没有改变的物质。
特点:一变两不变。
改变化学反应速率,不同的反应用不同的催化剂;反应前后质量和化学性质不变。
注意:没有催化剂也可反应;催化剂不能改变生成物的数量;催化剂参与反应。
性质活泼的氧气
五、工业制取氧气
空气
(气态)
加压
降温
空气
(液态)
蒸发
N2 -196℃
O2 -183℃
物理变化
性质活泼的氧气
奇妙的二氧化碳
一、二氧化碳在自然界中的循环
1、CO2的生成
⑴动植物的 ;
⑵化石燃料的 ;
⑶动植物尸体的 ;
2、CO2的消耗
植物的 。
呼 吸
燃 烧
腐 烂
光合作用
二.二氧化碳的性质
1.物理性质
通常CO2是____色、____味的气体,密度比空气__ _,__ _ _溶于水。固体CO2俗称_________,易升华吸热,可作_________。
无
无
大
可
干冰
制冷剂
2.化学性质
①二氧化碳既不燃烧也不支持燃烧
向放有阶梯蜡烛的烧杯中倾倒CO2,____面的蜡烛先熄灭,这个实验说明了a.CO2的密度比空气____;b.__________________________ 。
下
大
既不燃烧也不支持燃烧
奇妙的二氧化碳
②二氧化碳与水反应
CO2通入水中生成_________________,反应的化学方程式为__________________________,碳酸不稳定,易分解,反应的化学方程式为_______________________。
碳酸(或H2CO3)
H2O+CO2===H2CO3
H2CO3===H2O+CO2↑
解释CO2通入石蕊试液,使溶液变红。
③二氧化碳与碱反应
向澄清的石灰水里通入CO2,石灰水变_________,这是由于生成了___________________的缘故,其化学方程式为__________________________________,这个反应可用来鉴定CO2气体(吸收用NaOH溶液)。
浑浊
白色不溶性碳酸钙
CO2+Ca(OH)2===CaCO3↓+H2O
奇妙的二氧化碳
④二氧化碳不能供给呼吸
二氧化碳本身没有毒性,但当空气中的CO2超过正常含量时,会对人体健康产生影响。在进入久未开启的菜窖、干涸的深井和深洞底部之前,必须先做________试验。
灯火
奇妙的二氧化碳
(2)实验室制法
①反应原理
利用________或__________和_________反应制取,化学方程式为 。
石灰石
大理石
CaCO3+2HCl===CaCl2+H2O+CO2↑
三.二氧化碳的制法
(1)工业制法
工业上利用煅烧_____________的方法制取CO2,化学方程式为_________________________。
石灰石
奇妙的二氧化碳
稀盐酸
CaCO3===CaO+CO2↑
奇妙的二氧化碳
②实验装置
(发生装置取决于 和 。)
反应物状态
反应条件
制取少量CO2
制取较多CO2
可控制反应的发生和停止
可控制反应速率
奇妙的二氧化碳
③收集和验满方法
收集:______________法
验满:将燃烧的木条________________,木条熄灭说明已收集满。
向上排空气
靠近集气瓶口
思考:收集方法与气体的哪些性质有关?
密度、水溶性已及是否与水和氧气反应。
a进b出
短进长出
奇妙的二氧化碳
④检验方法
将_____________倒入集气瓶中振荡,溶液变____ ,说明气体为CO2。
⑤干燥方法
通常使用_________对CO2进行干燥,不能使用___________、_______进行干燥。
澄清的石灰水
浑浊
浓硫酸
碱石灰
烧碱固体
长进短出
发生装置→净化装置→干燥装置→收集装置→尾气处理
四.二氧化碳的用途
(1)根据CO2不燃烧也不支持燃烧且密度大于空气的性质,可用来______________。
(2)二氧化碳是一种工业原料,可以用于制纯碱、尿素和__________等工业。
(3)干冰可用作___________,可用于保藏很容易腐败的食品,还可用于____________。
(4)在温室里施用CO2作___________,可以提高农作物的产量。
灭 火
汽 水
制冷剂
人工降雨
肥 料
奇妙的二氧化碳
1、水通电分解
化学方程式 2H2O == 2H2↑ + O2 ↑
电极
体积比
质量比
气体检验方法
现象
实验结论
通电
负极
正极
2 ︰ 1
1 ︰ 8
点燃 带火星的木条
淡蓝色火焰 复燃
水由氢元素和氧元素组成
每个水分子由两个氢原子和一个氧原子构成
分子可分解成原子,原子又可构成新的分子
自然界中的水
注意:
1、水电解通的是 电;
2、为增强溶液的导电性,可在水中加入少量 或 溶液。
3、体积比小于1︰2的原因:
氧气的溶解度大于氢气
氧气可能与电极材料反应
直流
H2SO4
NaOH
4、收集的氢气较少时,可能只发出爆鸣声,而看不到淡蓝色火焰。
5、点燃氢气等可燃性气体前要验纯。
2H2 + O2 == 2H2O
点燃
自然界中的水
2、水与某些非金属氧化物反应生成含氧酸
CO2 + H2O == H2CO3
SO2 + H2O == H2SO3
SO3 + H2O == H2SO4
3、水与某些金属氧化物反应生成可溶性碱
CaO + H2O == Ca(OH)2
自然界中的水
纯净水:不含任何杂质的水,属于纯净物,
如医用蒸馏水。
自然水:河水、湖水、井水、海水含有杂质,
属于混合物。
自然水
不溶性杂质(如泥沙)
可溶性杂质(各种离子)
微生物
1、
自然界中的水
自来水厂通常对天然水进行 、 、 、 等处理达到饮用水标准。
过滤
吸附
消毒
加絮凝剂
除悬浮物
明矾
过滤
除不溶物
砂石
吸附
除有气味有色物质
活性炭
消毒
除微生物
ClO2
沉降
自然界中的水
3、硬水和软水
⑴硬水是含有 较多的水,软水是含 较少的水。
⑵硬水和软水常用 来区分,产生泡沫较多的是 ,产生泡沫少的是 。
⑶硬水的软化方法:
生活中用煮沸法
工业上用蒸馏法
Ca2+ Mg2+
Ca2+ Mg2+
肥皂水
软水
硬水
⑷硬水的危害:
生活中洗衣服洗不干净且浪费肥皂;
锅炉易结水垢,严重时会导致爆炸。
自然界中的水
1. (2020江苏扬州)氧气是空气的主要成分之一。下列说法不正确的是( )
A. 通常状况下,O2是无色气体
B. 相同条件下,O2的密度大于CO2
C. 分离液态空气可获得O2
D. O2能够支持可燃物的燃烧
典例精讲
B
2.(2021·广西梧州市·中考真题)下列对实验现象的描述,错误的
是( )
A.铁丝在氧气中燃烧,火星四射,生成黑色固体
B.镁条燃烧时,发出耀眼的白光,生成白色固体
C.乙炔在空气中燃烧,火焰为淡蓝色,生成刺激性气味的气体
D.在蜡烛火焰上方罩一个冷而干燥的烧杯,发现烧杯内壁有液滴
C
3.(2021·北京中考真题)将CO2通入下列液体中,能产生
白色沉淀的是( )
A.水 B.稀硫酸
C.食盐水 D.澄清石灰水
D
4.(2021·辽宁中考真题)有关水的净化,下列说法错
误的是( )
A.活性炭吸附色素异味
B.投药消毒过程中发生化学变化
C.煮沸可降低水的硬度
D.明矾除去水中所有不溶性杂质
D
5.(2021·北京中考真题)电解水实验如图,下列说法不正确的是( )
A.试管1中得到H2 B.水由H2、O2构成
C.水发生了分解反应 D.水由氢、氧元素组成
B
谢 谢!
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
