1.6几种重要的盐 同步练习(含解析)
文档属性
| 名称 | 1.6几种重要的盐 同步练习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 92.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-11-25 19:59:16 | ||
图片预览


文档简介
几种重要的盐
一、单选题
1.技术员测定了某块耕地土壤中的氮磷钾含量,测定结果及土壤肥量标准如表,请你判断此块耕地应施用的化肥是( )
含氮 含磷 含钾
土壤肥量标准(g/kg) 0.62 0.34 17.8
测定结果(g/kg) 0.4 0.38 13.6
A. Ca3(PO4)2 B. (NH4)2SO4 C. K2CO3 D. KNO3
2.下列物质名称、俗名、化学式完全一致的一组是( )
A. 氢氧化钠、烧碱、NaOH B. 氢氧化钙、石灰石、Ca(OH)2
C. 氧化钙、熟石灰、CaO D. 碳酸钠、火碱、Na2CO3
3.下列关于科学实验的“操作-现象-结论”的描述正确的是( )
A. 在某固体物质中加入稀盐酸,产生大量气泡,该物质一定是碳酸盐
B. 在某溶液中加入氯化钡溶液和稀硝酸,产生白色沉淀,该溶液中一定含有硫酸根离子
C. 某溶液用pH试纸测试,试纸变蓝色(pH约为10),该溶液一定是碱性溶液
D. 在稀盐酸与氢氧化钠反应后的溶液中滴加无色酚酞试液不变色,则断定两者恰好完全
反应
4.化肥对提高农作物的产量有重要作用,下列化肥属于氮肥的是( )
A. K2SO4 B. Ca3(PO4)2 C. CO(NH2)2 D. KNO3
5.向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉,反应过程中,测得混合物中溶液的质量与加入铁粉的质量关系如图所示。有关该反应过程中的下列说法正确的是( )
A. a点,向溶液中滴加稀盐酸,无白色沉淀
B. c点,向过滤后得到的固体中滴加稀盐酸,无气泡产生
C. d点,溶液中的溶质为Fe(NO3)2和Cu(NO3)2
D. e点,过滤后得到的固体中只含有2种物质
6.酸、碱、盐在工农业生产和日常生活中的广泛应用,促进了人类文明的进步和社会的可持续发展.下列有关酸、碱、盐的生产或应用的说法不合理的是( )
A. 汽车或电动车的蓄电池中用到的硫酸溶液是由浓硫酸稀释而成
B. 纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产
C. 用石灰乳与硫酸铜溶液混合可配制防治植物病害的波尔多液
D. 将草木灰(含K2CO3)与氯化铵混合施用
7.下列物质中,有一种与其它三种物质不属于同一类别的是( )
A. 纯碱 B. 氨水 C. 熟石灰 D. 苛性钠
8.过氧化氢俗称双氧水,它是一种液体,易分解为水和氧气,常作氧化剂、漂白剂和消毒剂,为了贮存、运输、使用方便,工业上常将H2O2转化为固态的过碳酸钠晶体(其化学式为2Na2CO3 3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是( )
A. MnO2 B. 稀硫酸 C. 稀盐酸 D. NaHCO3
9.下列物质的名称、俗名、化学式不完全一致的是( )
A. 氢氧化钠 烧碱 NaOH B. 氢氧化钙 消石灰 Ca(OH)2
C. 氧化钙 熟石灰 CaO D. 固态二氧化碳 干冰 CO2
10.合理使用化肥,有利于农作物的生长和减少环境污染。下列有关化肥的说法错误的是( )
A. 化肥虽有利于农作物生长,但不可大量使用 B. 可将铵态氮肥与碱性物质混合施用
C. 磷酸二氢铵(NH4H2PO4)是一种复合肥料 D. 提倡将农家肥与化肥综合使用
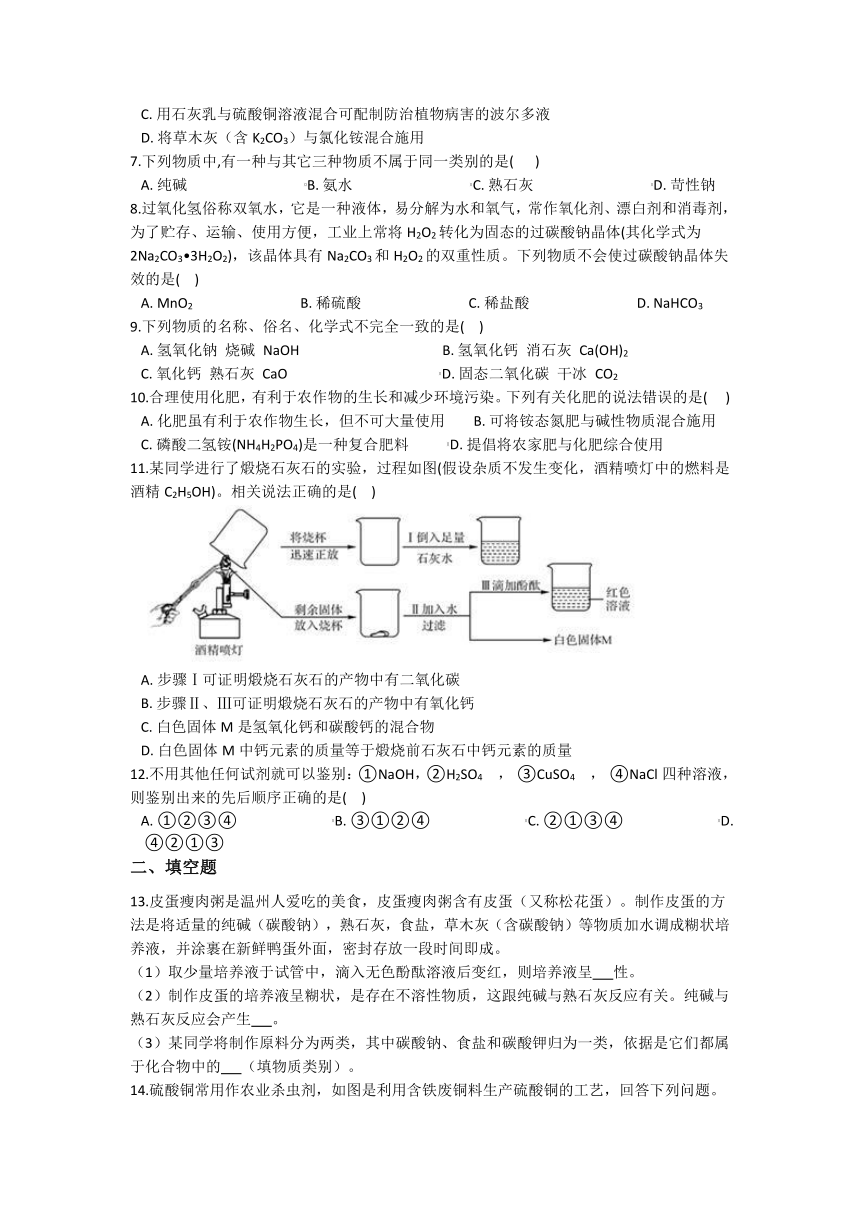
11.某同学进行了煅烧石灰石的实验,过程如图(假设杂质不发生变化,酒精喷灯中的燃料是酒精C2H5OH)。相关说法正确的是( )
A. 步骤Ⅰ可证明煅烧石灰石的产物中有二氧化碳
B. 步骤Ⅱ、Ⅲ可证明煅烧石灰石的产物中有氧化钙
C. 白色固体M是氢氧化钙和碳酸钙的混合物
D. 白色固体M中钙元素的质量等于煅烧前石灰石中钙元素的质量
12.不用其他任何试剂就可以鉴别:①NaOH,②H2SO4 , ③CuSO4 , ④NaCl四种溶液,则鉴别出来的先后顺序正确的是( )
A. ①②③④ B. ③①②④ C. ②①③④ D. ④②①③
二、填空题
13.皮蛋瘦肉粥是温州人爱吃的美食,皮蛋瘦肉粥含有皮蛋(又称松花蛋)。制作皮蛋的方法是将适量的纯碱(碳酸钠),熟石灰,食盐,草木灰(含碳酸钠)等物质加水调成糊状培养液,并涂裹在新鲜鸭蛋外面,密封存放一段时间即成。
(1)取少量培养液于试管中,滴入无色酚酞溶液后变红,则培养液呈 性。
(2)制作皮蛋的培养液呈糊状,是存在不溶性物质,这跟纯碱与熟石灰反应有关。纯碱与熟石灰反应会产生 。
(3)某同学将制作原料分为两类,其中碳酸钠、食盐和碳酸钾归为一类,依据是它们都属于化合物中的 (填物质类别)。
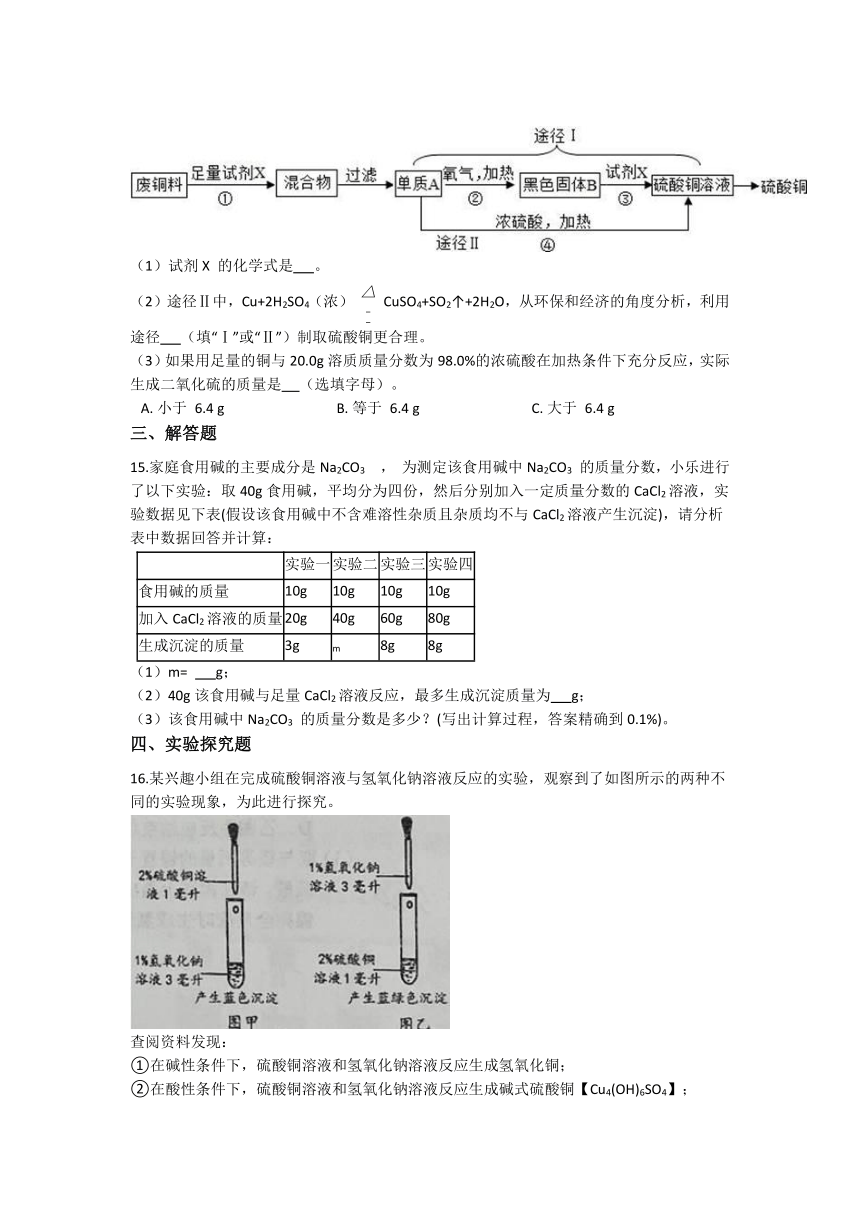
14.硫酸铜常用作农业杀虫剂,如图是利用含铁废铜料生产硫酸铜的工艺,回答下列问题。
(1)试剂X 的化学式是 。
(2)途径Ⅱ中,Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,从环保和经济的角度分析,利用途径 (填“Ⅰ”或“Ⅱ”)制取硫酸铜更合理。
(3)如果用足量的铜与20.0g溶质质量分数为98.0%的浓硫酸在加热条件下充分反应,实际生成二氧化硫的质量是 (选填字母)。
A. 小于 6.4 g B. 等于 6.4 g C. 大于 6.4 g
三、解答题
15.家庭食用碱的主要成分是Na2CO3 , 为测定该食用碱中Na2CO3 的质量分数,小乐进行了以下实验:取40g食用碱,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表(假设该食用碱中不含难溶性杂质且杂质均不与CaCl2溶液产生沉淀),请分析表中数据回答并计算:
实验一 实验二 实验三 实验四
食用碱的质量 10g 10g 10g 10g
加入CaCl2溶液的质量 20g 40g 60g 80g
生成沉淀的质量 3g m 8g 8g
(1)m= g;
(2)40g该食用碱与足量CaCl2溶液反应,最多生成沉淀质量为 g;
(3)该食用碱中Na2CO3 的质量分数是多少?(写出计算过程,答案精确到0.1%)。
四、实验探究题
16.某兴趣小组在完成硫酸铜溶液与氢氧化钠溶液反应的实验,观察到了如图所示的两种不同的实验现象,为此进行探究。
查阅资料发现:
①在碱性条件下,硫酸铜溶液和氢氧化钠溶液反应生成氢氧化铜;
②在酸性条件下,硫酸铜溶液和氢氧化钠溶液反应生成碱式硫酸铜【Cu4(OH)6SO4】;
③碱式硫酸铜为蓝绿色固体,不溶于水但溶于酸,与盐酸反应的化学方程式为:Cu4(OH)6SO4+6HCl = CuSO4 + 3CuCl2 + 6H2O;
(1)结合甲乙两组的实验,同学们推测硫酸铜溶液呈酸性。请写出他们的依据:
(2)为验证乙实验产生的沉淀为碱式硫酸铜,同学们进行如下表所示实验。
步骤 主要实验操作 实验现象
① 取乙组实验后的混合物过滤 得到蓝绿色沉淀
② 取蓝绿色沉淀,用蒸馏水洗涤几次 无明显现象
③ 向最后一次洗涤液中滴加氯化钡溶液
④ 取洗涤后的蓝绿色沉淀于试管中,滴加稀盐酸 沉淀全部溶解,得到蓝绿色溶液
⑤ 取少量蓝绿色溶液于试管中,滴加氯化钡溶液 产生白色沉淀
实验结论:蓝绿色沉淀是碱式硫酸铜
完成步骤③实验现象 。
(3)为了确保氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜,实验的关键是
答案解析部分
一、单选题
1.【答案】 D
【解析】【分析】根据表格数据,分析这块土地所缺的营养素,再根据所缺的营养素选择合适的化肥。
【解答】根据表格数据可知,含氮量和含钾量偏低,因此应该补充氮元素和钾元素,即使用含有氮元素和钾元素的复合肥。
A.Ca3(PO4)2 , 只含有磷元素,为磷肥,故A不合题意;
B.(NH4)2SO4 , 只含有氮元素,为氮肥,故B不合题意;
C.K2CO3 , 只含有钾元素,为钾肥,故C不合题意;
D.KNO3 , 同时含有氮元素和钾元素,为复合肥,故D符合题意。
故选D。
2.【答案】 A
【解析】【分析】根据常见化学物质的名称和化学式分析判断。
【解答】A.氢氧化钠,俗称烧碱、火碱和苛性钠,化学式为NaOH,故A正确;
B.氢氧化钙,俗称熟石灰或消石灰,化学式为Ca(OH)2 , 故B错误;
C.氧化钙,俗称生石灰,化学式为CaO,故C错误;
D.碳酸钠,俗称纯碱,化学式为Na2CO3 , 故D错误。
故选A。
3.【答案】 C
【解析】【分析】(1)根据酸的化学性质判断;
(2)氯化银和硫酸钡都是不溶于酸的白色沉淀;
(3)pH<7,呈酸性;pH>7,呈碱性;
(4)无色酚酞试液遇到碱变成红色,遇到酸或中性溶液不变色,据此分析判断。
【解答】A.活泼金属和酸反应,生成盐和氢气,也会看到气泡,故A错误;
B.白色沉淀可能是硫酸钡,也可能是氯化银,不能说明溶液中一定存在硫酸根离子,故B错误;
C.某溶液用pH试纸测试,试纸变蓝色(pH约为10),该溶液一定是碱性溶液,故C正确;
D.无色酚酞不变色,可能是二者恰好完全反应,也可能是稀盐酸过量,故D错误。
故选C。
4.【答案】 C
【解析】【分析】含有氮元素的为氮肥,含有钾元素的为钾肥,含有磷元素的为磷肥,据此分析判断。
【解答】A.K2SO4 中含有钾元素,为钾肥,故A不合题意;
B.Ca3(PO4)2 含有磷元素,为磷肥,故B不合题意;
C.CO(NH2)2 含有氮元素,为氮肥,故C符合题意;
D.KNO3含有氮元素和钾元素,为复合肥,故D不合题意。
故选C。
5.【答案】 B
【解析】【分析】铁比铜活泼,铜比银活泼,向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉时,铁先和硝酸银反应生成硝酸亚铁和银,后和硝酸铜反应生成硝酸亚铁和铜,据此分析判断。
【解答】A.a点时,铁粉正在和硝酸银反应,此时溶液中含有硝酸银,向溶液中滴加稀盐酸,产生白色沉淀氯化银,故A错误;
B.c点时,铁粉和硝酸铜反应,生成硝酸亚铁和铜。过滤后得到的固体中含有银和铜,向过滤后得到的固体中滴加稀盐酸时,稀盐酸不能和银、铜反应,因此无气泡产生,故B正确;
C.d点时,铁和硝酸银、硝酸铜恰好完全反应,因此溶液中的溶质为硝酸亚铁,故C错误;
D.e点,加入的铁粉过滤,则过滤后得到的固体中含有银、铜和铁3种物质,故D错误。
故选B。
6.【答案】 D
【解析】【分析】根据自己对常见 酸、碱、盐的理解和认识分析判断。
【解答】A.汽车或电动车的蓄电池中用到的硫酸溶液是由浓硫酸稀释而成 ,故A正确不合题意;
B.纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产,故B正确不合题意;
C.用石灰乳与硫酸铜溶液混合可配制防治植物病害的波尔多液,故C正确不合题意;
D.将草木灰(含K2CO3)与氯化铵混合施用,其中的碳酸钾会和氯化铵反应生成氨气,从而降低肥效,故D错误符合题意。
故选D。
7.【答案】 A
【解析】【分析】对四种物质进行分类即可。
【解答】纯碱属于盐,而氨水、熟石灰和苛性钠都属于碱,则不属于同一类别的是纯碱,故A符合题意,而B、C、D不合题意。
故选A。
8.【答案】 D
【解析】【分析】只要物质不与碳酸钠和双氧水反应,那么就不会使其失效,据此分析判断。
【解答】二氧化锰会使双氧水分解,生成水和氧气,故A不合题意;
稀硫酸和稀盐酸,都能与碳酸钠反应,从而生成二氧化碳气体,故B、C不合题意;
碳酸氢钠与碳酸钠和双氧水都不反应,故D符合题意。
故选D。
9.【答案】 C
【解析】【分析】根据常见化学物质的名称和化学式分析判断。
【解答】A.氢氧化钠 ,俗称烧碱,化学式为NaOH,故A正确不合题意;
B.氢氧化钙,俗称消石灰,化学式为Ca(OH)2 ,故B正确不合题意;
C.氧化钙的俗称不是熟石灰,故C错误符合题意;
D.固态二氧化碳, 俗称干冰,化学式为CO2 , 故D正确不合题意。
故选C。
10.【答案】 B
【解析】【分析】根据物质中含有氮、磷、钾至少两种元素的物质属于复合肥,铵态氮肥与碱性物质可发生反应,不能混用及化肥对水体有污染分析。
【解答】A、化肥过量使用会造成水体污染,不可大量使用,不符合题意;
B、铵态氮肥与碱性物质可发生反应产生氨气,降低肥效,不可混合施用,符合题意;
C、 磷酸二氢铵中含有植物所需磷元素和氮元素,属于复合肥,不符合题意;
D、农家肥和化肥性能互补, 提倡将农家肥与化肥综合使用,不符合题意;
故选B。
11.【答案】 B
【解析】【分析】石灰石主要成分是碳酸钙,生石灰是氧化钙,澄清石灰水是氢氧化钙,碳酸钙受热分解生成氧化钙,生石灰溶于水变成熟石灰,熟石灰与二氧化碳反应生成碳酸钙。
【解答】A由于酒精燃烧生成了二氧化碳,实验中澄清石灰水变浑浊,不能证明二氧化碳是石灰石中产生的,故A不符合题意;
B由于氧化钙与水反应生成了氢氧化钙,氢氧化钙溶液显碱性,能使酚酞试剂变红色,说明石灰石煅烧产物中有氧化钙,故B 符合题意;
C由于石灰石中含有杂质,白色的固体M中含有氢氧化钙和杂质,碳酸钙是可能存在,故C不符合题意;
D由于氧化钙能与水反应生成氢氧化钙,氢氧化钙微溶于水,白色的固体M中钙元素的质量小于煅烧前石灰石中钙元素的质量,故D不符合题意。
故答案为:B.
12.【答案】 B
【解析】【分析】物质的鉴别: 先观察物质的颜色,再通过物质之间互相反应现象去判断。
【解答】硫酸铜是蓝色的,其他都是无色的,所以③先判断出来,再利用硫酸铜去滴入剩余的溶液其中①会有蓝色絮状沉淀产生:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 , 第二个①,再将剩余②④滴入沉淀,能使沉淀溶解就为硫酸:Cu(OH)2+H2SO4=CuSO4+2H2O,第三个鉴别是 ② ,最后就是 ④ ;所以顺序是③①②④。
故答案为:B
二、填空题
13.【答案】 (1)碱
(2)白色沉淀/碳酸钙
(3)盐
【解析】【分析】(1)无色酚酞试液遇到酸不变色,遇到碱变成红色;
(2)纯碱为碳酸钠,碳酸钠和氢氧化钙反应,生成碳酸钙沉淀和氢氧化钠;
(3)酸由氢离子和酸根离子构成,碱由金属离子和氢氧根离子构成,盐由金属离子和酸根离子构成,据此分析解答。
【解答】(1)取少量培养液于试管中,滴入无色酚酞溶液后变红,则培养液呈碱性。
(2)制作皮蛋的培养液呈糊状,是存在不溶性物质,这跟纯碱与熟石灰反应有关。纯碱与熟石灰反应会产生白色沉淀碳酸钙。
(3)碳酸钠、食盐和碳酸钾归为一类,它们都由金属离子和酸根离子构成,因此它们都属于化合物中的盐。
14.【答案】 (1)H2SO4
(2)Ⅰ
(3)A
【解析】【分析】(1)铜不与稀硫酸反应,而铁可以与稀硫酸反应;
(2)对比两种途径,从反应进行的完全性和是否生成污染物的角度分析;
(3)根据铜和浓硫酸反应的方程式,计算出理论上可以生成二氧化硫的质量,然后结合浓硫酸随着反应的进行浓度的变化来分析判断。
【解答】(1)废铜料中含有铁,所以要制得硫酸铜,应该先把铁除去,除去铁应该选用稀硫酸,则试剂X的化学式为H2SO4;
(2)途径Ⅰ中为金属单质铜与氧气在加热条件下生成黑色固体氧化铜,氧化铜与稀硫酸反应生成硫酸铜,途径II中铜和浓硫酸反应要生成二氧化硫会污染空气,且反应进行中随着浓硫酸浓度的减小,反应会越来越慢,造成硫酸浪费,所以应该选择途径I;
(3)设20.0g溶质质量分数为98.0%的浓硫酸在加热条件下与铜完全反应,生成二氧化硫的质量为x
;
196 64
20g×98.0% x
;
解得:x=6.4g。
如果完全反应,那么应该生成6.4g气体,但是随着反应的进行浓硫酸会变稀,而使反应终止,故难以生成6.4g二氧化硫,即实际上生成的气体要小于6.4g;
故选A。
三、解答题
15.【答案】 (1)6
(2)32
(3)解:设10克样品中碳酸钠的质量为M
Na2CO3+CaCl2= CaCO3↓+2NaCl
106 100
M 8克
M=8.48克
Na2CO3%=8.48克/10克×100%=84.8%
答:样品中碳酸钠的质量分数是84.8%
【解析】【分析】(1)在食用碱中的碳酸钠完全反应前,生成沉淀的质量与加入氯化钙溶液的质量成正比,根据实验一计算m的值。
(2)当食用碱完全反应时,生成沉淀的质量与碱的质量成正比,根据表格确定10g食用碱反应生成沉淀的质量,然后据此关系计算。
(3)写出碳酸钠和氯化钙反应的方程式,根据生成的碳酸钙沉淀的质量计算出参加反应的碳酸钠的质量,最后根据计算碳酸钠的质量分数。
【解答】(1)根据实验一可知,20g氯化钙溶液完全反应生成沉淀3g,则实验二加入40g氯化钙溶液产生沉淀的质量:。
(2)实验三中加入60g氯化钙溶液,实验四中加入80g氯化钙溶液,生成沉淀的质量都是8g,则10g食用碱完全反应生成8g沉淀,则40g食用碱生成沉淀的质量:。
四、实验探究题
16.【答案】 (1)乙组实验中将氢氧化钠溶液滴入硫酸铜溶液产生蓝色沉淀。
(2)无明显现象
(3)将硫酸铜溶液滴入氢氧化钠溶液中(答案合理即可)。
【解析】【分析】(1)根据材料②可知,只有在酸性条件下,硫酸铜和氢氧化钠反应生成蓝绿色的碱式碳酸铜,而图乙中恰好生成了蓝绿色沉淀,据此分析硫酸铜溶液的酸碱性;
(2)根据“碱式硫酸铜为蓝绿色固体,不溶于水但溶于酸”分析解答;
(3)根据材料①可知,在碱性条件下,硫酸铜才能和氢氧化钠反应生成氢氧化铜,据此分析实验方法。
【解答】(1)结合甲乙两组的实验,同学们推测硫酸铜溶液呈酸性。请写出他们的依据:乙组实验中将氢氧化钠溶液滴入硫酸铜溶液产生蓝色沉淀。
(2)根据“碱式硫酸铜为蓝绿色固体,不溶于水”可知,蒸馏水洗涤蓝绿色的碱式碳酸铜时,它不会在水中溶解,即洗涤液中肯定没有硫酸根离子,因此滴入氯化钡溶液也不会形成沉淀,即无明显现象。
(3)为了确保氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜,实验的关键是:将硫酸铜溶液滴入氢氧化钠溶液中。
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
一、单选题
1.技术员测定了某块耕地土壤中的氮磷钾含量,测定结果及土壤肥量标准如表,请你判断此块耕地应施用的化肥是( )
含氮 含磷 含钾
土壤肥量标准(g/kg) 0.62 0.34 17.8
测定结果(g/kg) 0.4 0.38 13.6
A. Ca3(PO4)2 B. (NH4)2SO4 C. K2CO3 D. KNO3
2.下列物质名称、俗名、化学式完全一致的一组是( )
A. 氢氧化钠、烧碱、NaOH B. 氢氧化钙、石灰石、Ca(OH)2
C. 氧化钙、熟石灰、CaO D. 碳酸钠、火碱、Na2CO3
3.下列关于科学实验的“操作-现象-结论”的描述正确的是( )
A. 在某固体物质中加入稀盐酸,产生大量气泡,该物质一定是碳酸盐
B. 在某溶液中加入氯化钡溶液和稀硝酸,产生白色沉淀,该溶液中一定含有硫酸根离子
C. 某溶液用pH试纸测试,试纸变蓝色(pH约为10),该溶液一定是碱性溶液
D. 在稀盐酸与氢氧化钠反应后的溶液中滴加无色酚酞试液不变色,则断定两者恰好完全
反应
4.化肥对提高农作物的产量有重要作用,下列化肥属于氮肥的是( )
A. K2SO4 B. Ca3(PO4)2 C. CO(NH2)2 D. KNO3
5.向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉,反应过程中,测得混合物中溶液的质量与加入铁粉的质量关系如图所示。有关该反应过程中的下列说法正确的是( )
A. a点,向溶液中滴加稀盐酸,无白色沉淀
B. c点,向过滤后得到的固体中滴加稀盐酸,无气泡产生
C. d点,溶液中的溶质为Fe(NO3)2和Cu(NO3)2
D. e点,过滤后得到的固体中只含有2种物质
6.酸、碱、盐在工农业生产和日常生活中的广泛应用,促进了人类文明的进步和社会的可持续发展.下列有关酸、碱、盐的生产或应用的说法不合理的是( )
A. 汽车或电动车的蓄电池中用到的硫酸溶液是由浓硫酸稀释而成
B. 纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产
C. 用石灰乳与硫酸铜溶液混合可配制防治植物病害的波尔多液
D. 将草木灰(含K2CO3)与氯化铵混合施用
7.下列物质中,有一种与其它三种物质不属于同一类别的是( )
A. 纯碱 B. 氨水 C. 熟石灰 D. 苛性钠
8.过氧化氢俗称双氧水,它是一种液体,易分解为水和氧气,常作氧化剂、漂白剂和消毒剂,为了贮存、运输、使用方便,工业上常将H2O2转化为固态的过碳酸钠晶体(其化学式为2Na2CO3 3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是( )
A. MnO2 B. 稀硫酸 C. 稀盐酸 D. NaHCO3
9.下列物质的名称、俗名、化学式不完全一致的是( )
A. 氢氧化钠 烧碱 NaOH B. 氢氧化钙 消石灰 Ca(OH)2
C. 氧化钙 熟石灰 CaO D. 固态二氧化碳 干冰 CO2
10.合理使用化肥,有利于农作物的生长和减少环境污染。下列有关化肥的说法错误的是( )
A. 化肥虽有利于农作物生长,但不可大量使用 B. 可将铵态氮肥与碱性物质混合施用
C. 磷酸二氢铵(NH4H2PO4)是一种复合肥料 D. 提倡将农家肥与化肥综合使用
11.某同学进行了煅烧石灰石的实验,过程如图(假设杂质不发生变化,酒精喷灯中的燃料是酒精C2H5OH)。相关说法正确的是( )
A. 步骤Ⅰ可证明煅烧石灰石的产物中有二氧化碳
B. 步骤Ⅱ、Ⅲ可证明煅烧石灰石的产物中有氧化钙
C. 白色固体M是氢氧化钙和碳酸钙的混合物
D. 白色固体M中钙元素的质量等于煅烧前石灰石中钙元素的质量
12.不用其他任何试剂就可以鉴别:①NaOH,②H2SO4 , ③CuSO4 , ④NaCl四种溶液,则鉴别出来的先后顺序正确的是( )
A. ①②③④ B. ③①②④ C. ②①③④ D. ④②①③
二、填空题
13.皮蛋瘦肉粥是温州人爱吃的美食,皮蛋瘦肉粥含有皮蛋(又称松花蛋)。制作皮蛋的方法是将适量的纯碱(碳酸钠),熟石灰,食盐,草木灰(含碳酸钠)等物质加水调成糊状培养液,并涂裹在新鲜鸭蛋外面,密封存放一段时间即成。
(1)取少量培养液于试管中,滴入无色酚酞溶液后变红,则培养液呈 性。
(2)制作皮蛋的培养液呈糊状,是存在不溶性物质,这跟纯碱与熟石灰反应有关。纯碱与熟石灰反应会产生 。
(3)某同学将制作原料分为两类,其中碳酸钠、食盐和碳酸钾归为一类,依据是它们都属于化合物中的 (填物质类别)。
14.硫酸铜常用作农业杀虫剂,如图是利用含铁废铜料生产硫酸铜的工艺,回答下列问题。
(1)试剂X 的化学式是 。
(2)途径Ⅱ中,Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,从环保和经济的角度分析,利用途径 (填“Ⅰ”或“Ⅱ”)制取硫酸铜更合理。
(3)如果用足量的铜与20.0g溶质质量分数为98.0%的浓硫酸在加热条件下充分反应,实际生成二氧化硫的质量是 (选填字母)。
A. 小于 6.4 g B. 等于 6.4 g C. 大于 6.4 g
三、解答题
15.家庭食用碱的主要成分是Na2CO3 , 为测定该食用碱中Na2CO3 的质量分数,小乐进行了以下实验:取40g食用碱,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表(假设该食用碱中不含难溶性杂质且杂质均不与CaCl2溶液产生沉淀),请分析表中数据回答并计算:
实验一 实验二 实验三 实验四
食用碱的质量 10g 10g 10g 10g
加入CaCl2溶液的质量 20g 40g 60g 80g
生成沉淀的质量 3g m 8g 8g
(1)m= g;
(2)40g该食用碱与足量CaCl2溶液反应,最多生成沉淀质量为 g;
(3)该食用碱中Na2CO3 的质量分数是多少?(写出计算过程,答案精确到0.1%)。
四、实验探究题
16.某兴趣小组在完成硫酸铜溶液与氢氧化钠溶液反应的实验,观察到了如图所示的两种不同的实验现象,为此进行探究。
查阅资料发现:
①在碱性条件下,硫酸铜溶液和氢氧化钠溶液反应生成氢氧化铜;
②在酸性条件下,硫酸铜溶液和氢氧化钠溶液反应生成碱式硫酸铜【Cu4(OH)6SO4】;
③碱式硫酸铜为蓝绿色固体,不溶于水但溶于酸,与盐酸反应的化学方程式为:Cu4(OH)6SO4+6HCl = CuSO4 + 3CuCl2 + 6H2O;
(1)结合甲乙两组的实验,同学们推测硫酸铜溶液呈酸性。请写出他们的依据:
(2)为验证乙实验产生的沉淀为碱式硫酸铜,同学们进行如下表所示实验。
步骤 主要实验操作 实验现象
① 取乙组实验后的混合物过滤 得到蓝绿色沉淀
② 取蓝绿色沉淀,用蒸馏水洗涤几次 无明显现象
③ 向最后一次洗涤液中滴加氯化钡溶液
④ 取洗涤后的蓝绿色沉淀于试管中,滴加稀盐酸 沉淀全部溶解,得到蓝绿色溶液
⑤ 取少量蓝绿色溶液于试管中,滴加氯化钡溶液 产生白色沉淀
实验结论:蓝绿色沉淀是碱式硫酸铜
完成步骤③实验现象 。
(3)为了确保氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜,实验的关键是
答案解析部分
一、单选题
1.【答案】 D
【解析】【分析】根据表格数据,分析这块土地所缺的营养素,再根据所缺的营养素选择合适的化肥。
【解答】根据表格数据可知,含氮量和含钾量偏低,因此应该补充氮元素和钾元素,即使用含有氮元素和钾元素的复合肥。
A.Ca3(PO4)2 , 只含有磷元素,为磷肥,故A不合题意;
B.(NH4)2SO4 , 只含有氮元素,为氮肥,故B不合题意;
C.K2CO3 , 只含有钾元素,为钾肥,故C不合题意;
D.KNO3 , 同时含有氮元素和钾元素,为复合肥,故D符合题意。
故选D。
2.【答案】 A
【解析】【分析】根据常见化学物质的名称和化学式分析判断。
【解答】A.氢氧化钠,俗称烧碱、火碱和苛性钠,化学式为NaOH,故A正确;
B.氢氧化钙,俗称熟石灰或消石灰,化学式为Ca(OH)2 , 故B错误;
C.氧化钙,俗称生石灰,化学式为CaO,故C错误;
D.碳酸钠,俗称纯碱,化学式为Na2CO3 , 故D错误。
故选A。
3.【答案】 C
【解析】【分析】(1)根据酸的化学性质判断;
(2)氯化银和硫酸钡都是不溶于酸的白色沉淀;
(3)pH<7,呈酸性;pH>7,呈碱性;
(4)无色酚酞试液遇到碱变成红色,遇到酸或中性溶液不变色,据此分析判断。
【解答】A.活泼金属和酸反应,生成盐和氢气,也会看到气泡,故A错误;
B.白色沉淀可能是硫酸钡,也可能是氯化银,不能说明溶液中一定存在硫酸根离子,故B错误;
C.某溶液用pH试纸测试,试纸变蓝色(pH约为10),该溶液一定是碱性溶液,故C正确;
D.无色酚酞不变色,可能是二者恰好完全反应,也可能是稀盐酸过量,故D错误。
故选C。
4.【答案】 C
【解析】【分析】含有氮元素的为氮肥,含有钾元素的为钾肥,含有磷元素的为磷肥,据此分析判断。
【解答】A.K2SO4 中含有钾元素,为钾肥,故A不合题意;
B.Ca3(PO4)2 含有磷元素,为磷肥,故B不合题意;
C.CO(NH2)2 含有氮元素,为氮肥,故C符合题意;
D.KNO3含有氮元素和钾元素,为复合肥,故D不合题意。
故选C。
5.【答案】 B
【解析】【分析】铁比铜活泼,铜比银活泼,向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉时,铁先和硝酸银反应生成硝酸亚铁和银,后和硝酸铜反应生成硝酸亚铁和铜,据此分析判断。
【解答】A.a点时,铁粉正在和硝酸银反应,此时溶液中含有硝酸银,向溶液中滴加稀盐酸,产生白色沉淀氯化银,故A错误;
B.c点时,铁粉和硝酸铜反应,生成硝酸亚铁和铜。过滤后得到的固体中含有银和铜,向过滤后得到的固体中滴加稀盐酸时,稀盐酸不能和银、铜反应,因此无气泡产生,故B正确;
C.d点时,铁和硝酸银、硝酸铜恰好完全反应,因此溶液中的溶质为硝酸亚铁,故C错误;
D.e点,加入的铁粉过滤,则过滤后得到的固体中含有银、铜和铁3种物质,故D错误。
故选B。
6.【答案】 D
【解析】【分析】根据自己对常见 酸、碱、盐的理解和认识分析判断。
【解答】A.汽车或电动车的蓄电池中用到的硫酸溶液是由浓硫酸稀释而成 ,故A正确不合题意;
B.纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产,故B正确不合题意;
C.用石灰乳与硫酸铜溶液混合可配制防治植物病害的波尔多液,故C正确不合题意;
D.将草木灰(含K2CO3)与氯化铵混合施用,其中的碳酸钾会和氯化铵反应生成氨气,从而降低肥效,故D错误符合题意。
故选D。
7.【答案】 A
【解析】【分析】对四种物质进行分类即可。
【解答】纯碱属于盐,而氨水、熟石灰和苛性钠都属于碱,则不属于同一类别的是纯碱,故A符合题意,而B、C、D不合题意。
故选A。
8.【答案】 D
【解析】【分析】只要物质不与碳酸钠和双氧水反应,那么就不会使其失效,据此分析判断。
【解答】二氧化锰会使双氧水分解,生成水和氧气,故A不合题意;
稀硫酸和稀盐酸,都能与碳酸钠反应,从而生成二氧化碳气体,故B、C不合题意;
碳酸氢钠与碳酸钠和双氧水都不反应,故D符合题意。
故选D。
9.【答案】 C
【解析】【分析】根据常见化学物质的名称和化学式分析判断。
【解答】A.氢氧化钠 ,俗称烧碱,化学式为NaOH,故A正确不合题意;
B.氢氧化钙,俗称消石灰,化学式为Ca(OH)2 ,故B正确不合题意;
C.氧化钙的俗称不是熟石灰,故C错误符合题意;
D.固态二氧化碳, 俗称干冰,化学式为CO2 , 故D正确不合题意。
故选C。
10.【答案】 B
【解析】【分析】根据物质中含有氮、磷、钾至少两种元素的物质属于复合肥,铵态氮肥与碱性物质可发生反应,不能混用及化肥对水体有污染分析。
【解答】A、化肥过量使用会造成水体污染,不可大量使用,不符合题意;
B、铵态氮肥与碱性物质可发生反应产生氨气,降低肥效,不可混合施用,符合题意;
C、 磷酸二氢铵中含有植物所需磷元素和氮元素,属于复合肥,不符合题意;
D、农家肥和化肥性能互补, 提倡将农家肥与化肥综合使用,不符合题意;
故选B。
11.【答案】 B
【解析】【分析】石灰石主要成分是碳酸钙,生石灰是氧化钙,澄清石灰水是氢氧化钙,碳酸钙受热分解生成氧化钙,生石灰溶于水变成熟石灰,熟石灰与二氧化碳反应生成碳酸钙。
【解答】A由于酒精燃烧生成了二氧化碳,实验中澄清石灰水变浑浊,不能证明二氧化碳是石灰石中产生的,故A不符合题意;
B由于氧化钙与水反应生成了氢氧化钙,氢氧化钙溶液显碱性,能使酚酞试剂变红色,说明石灰石煅烧产物中有氧化钙,故B 符合题意;
C由于石灰石中含有杂质,白色的固体M中含有氢氧化钙和杂质,碳酸钙是可能存在,故C不符合题意;
D由于氧化钙能与水反应生成氢氧化钙,氢氧化钙微溶于水,白色的固体M中钙元素的质量小于煅烧前石灰石中钙元素的质量,故D不符合题意。
故答案为:B.
12.【答案】 B
【解析】【分析】物质的鉴别: 先观察物质的颜色,再通过物质之间互相反应现象去判断。
【解答】硫酸铜是蓝色的,其他都是无色的,所以③先判断出来,再利用硫酸铜去滴入剩余的溶液其中①会有蓝色絮状沉淀产生:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 , 第二个①,再将剩余②④滴入沉淀,能使沉淀溶解就为硫酸:Cu(OH)2+H2SO4=CuSO4+2H2O,第三个鉴别是 ② ,最后就是 ④ ;所以顺序是③①②④。
故答案为:B
二、填空题
13.【答案】 (1)碱
(2)白色沉淀/碳酸钙
(3)盐
【解析】【分析】(1)无色酚酞试液遇到酸不变色,遇到碱变成红色;
(2)纯碱为碳酸钠,碳酸钠和氢氧化钙反应,生成碳酸钙沉淀和氢氧化钠;
(3)酸由氢离子和酸根离子构成,碱由金属离子和氢氧根离子构成,盐由金属离子和酸根离子构成,据此分析解答。
【解答】(1)取少量培养液于试管中,滴入无色酚酞溶液后变红,则培养液呈碱性。
(2)制作皮蛋的培养液呈糊状,是存在不溶性物质,这跟纯碱与熟石灰反应有关。纯碱与熟石灰反应会产生白色沉淀碳酸钙。
(3)碳酸钠、食盐和碳酸钾归为一类,它们都由金属离子和酸根离子构成,因此它们都属于化合物中的盐。
14.【答案】 (1)H2SO4
(2)Ⅰ
(3)A
【解析】【分析】(1)铜不与稀硫酸反应,而铁可以与稀硫酸反应;
(2)对比两种途径,从反应进行的完全性和是否生成污染物的角度分析;
(3)根据铜和浓硫酸反应的方程式,计算出理论上可以生成二氧化硫的质量,然后结合浓硫酸随着反应的进行浓度的变化来分析判断。
【解答】(1)废铜料中含有铁,所以要制得硫酸铜,应该先把铁除去,除去铁应该选用稀硫酸,则试剂X的化学式为H2SO4;
(2)途径Ⅰ中为金属单质铜与氧气在加热条件下生成黑色固体氧化铜,氧化铜与稀硫酸反应生成硫酸铜,途径II中铜和浓硫酸反应要生成二氧化硫会污染空气,且反应进行中随着浓硫酸浓度的减小,反应会越来越慢,造成硫酸浪费,所以应该选择途径I;
(3)设20.0g溶质质量分数为98.0%的浓硫酸在加热条件下与铜完全反应,生成二氧化硫的质量为x
;
196 64
20g×98.0% x
;
解得:x=6.4g。
如果完全反应,那么应该生成6.4g气体,但是随着反应的进行浓硫酸会变稀,而使反应终止,故难以生成6.4g二氧化硫,即实际上生成的气体要小于6.4g;
故选A。
三、解答题
15.【答案】 (1)6
(2)32
(3)解:设10克样品中碳酸钠的质量为M
Na2CO3+CaCl2= CaCO3↓+2NaCl
106 100
M 8克
M=8.48克
Na2CO3%=8.48克/10克×100%=84.8%
答:样品中碳酸钠的质量分数是84.8%
【解析】【分析】(1)在食用碱中的碳酸钠完全反应前,生成沉淀的质量与加入氯化钙溶液的质量成正比,根据实验一计算m的值。
(2)当食用碱完全反应时,生成沉淀的质量与碱的质量成正比,根据表格确定10g食用碱反应生成沉淀的质量,然后据此关系计算。
(3)写出碳酸钠和氯化钙反应的方程式,根据生成的碳酸钙沉淀的质量计算出参加反应的碳酸钠的质量,最后根据计算碳酸钠的质量分数。
【解答】(1)根据实验一可知,20g氯化钙溶液完全反应生成沉淀3g,则实验二加入40g氯化钙溶液产生沉淀的质量:。
(2)实验三中加入60g氯化钙溶液,实验四中加入80g氯化钙溶液,生成沉淀的质量都是8g,则10g食用碱完全反应生成8g沉淀,则40g食用碱生成沉淀的质量:。
四、实验探究题
16.【答案】 (1)乙组实验中将氢氧化钠溶液滴入硫酸铜溶液产生蓝色沉淀。
(2)无明显现象
(3)将硫酸铜溶液滴入氢氧化钠溶液中(答案合理即可)。
【解析】【分析】(1)根据材料②可知,只有在酸性条件下,硫酸铜和氢氧化钠反应生成蓝绿色的碱式碳酸铜,而图乙中恰好生成了蓝绿色沉淀,据此分析硫酸铜溶液的酸碱性;
(2)根据“碱式硫酸铜为蓝绿色固体,不溶于水但溶于酸”分析解答;
(3)根据材料①可知,在碱性条件下,硫酸铜才能和氢氧化钠反应生成氢氧化铜,据此分析实验方法。
【解答】(1)结合甲乙两组的实验,同学们推测硫酸铜溶液呈酸性。请写出他们的依据:乙组实验中将氢氧化钠溶液滴入硫酸铜溶液产生蓝色沉淀。
(2)根据“碱式硫酸铜为蓝绿色固体,不溶于水”可知,蒸馏水洗涤蓝绿色的碱式碳酸铜时,它不会在水中溶解,即洗涤液中肯定没有硫酸根离子,因此滴入氯化钡溶液也不会形成沉淀,即无明显现象。
(3)为了确保氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜,实验的关键是:将硫酸铜溶液滴入氢氧化钠溶液中。
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
