2.2 构成物质的微粒(Ⅰ)—分子 2.3构成物质的微粒(Ⅱ)——原子和离子课件--2021-2022学年九年级化学科粤版(2012)上册(30张PPT)
文档属性
| 名称 | 2.2 构成物质的微粒(Ⅰ)—分子 2.3构成物质的微粒(Ⅱ)——原子和离子课件--2021-2022学年九年级化学科粤版(2012)上册(30张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-25 15:10:25 | ||
图片预览








文档简介
(共30张PPT)
第二章第2节
构成物质的微粒(Ⅰ)——分子
第二章第3节
构成物质的微粒(Ⅱ)——原子和离子
构成物质的微粒——分子
冲糖水时,把糖放到开水中,糖不见了,而杯中的水却变甜了;
把香水洒在小手巾上,抖开手巾,绕教室一周,教室内充满了香水的味道;
在玻璃管两端的胶塞内,分别放置蘸有浓盐酸和浓氨水的小团棉花,会发现玻璃管内靠近蘸浓盐酸的棉花部分产生浓浓的白烟。
所有这些现象都与分子有关,那什么是分子呢?
分子的定义
分子是构成物质的一种微粒,是保持物质化学性质的一种微粒。
注意:1.针对由分子构成的物质来说的。
2.分子只能保持物质的化学性质,不能保持 物质的物理性质。
构成物质的微粒——分子
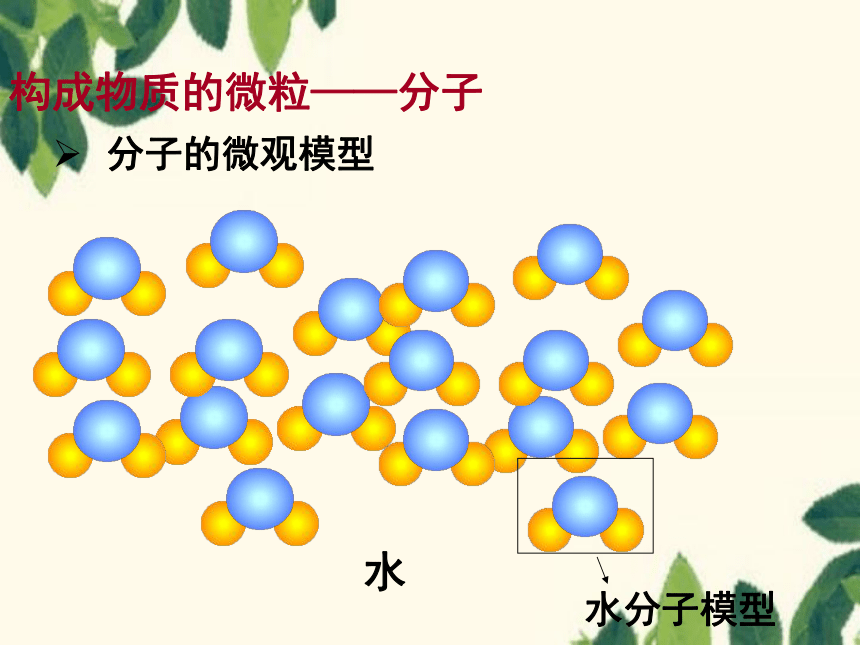
水
水分子模型
构成物质的微粒——分子
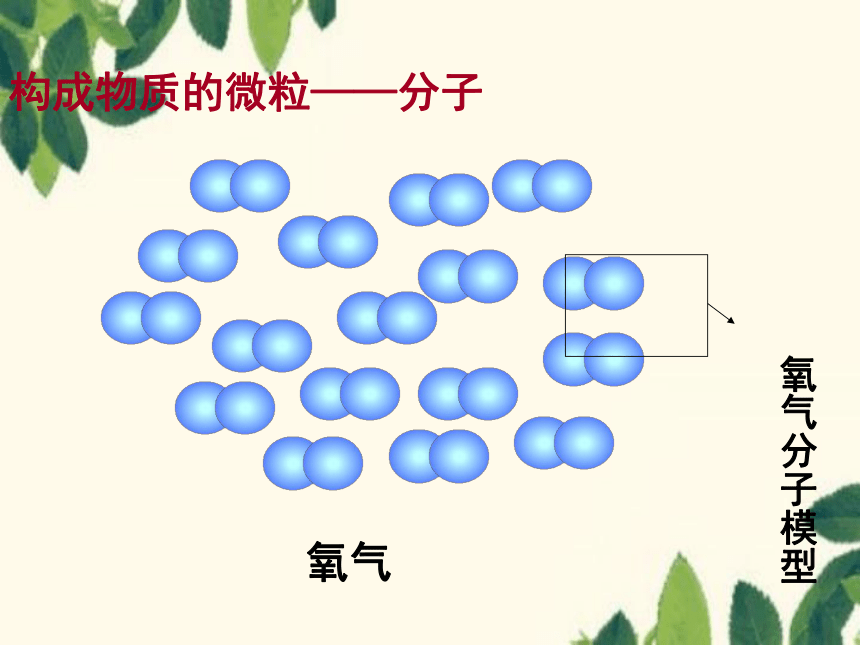
分子的微观模型
氧气
氧气分子模型
构成物质的微粒——分子
用扫描隧道显微镜放大几百万倍获得的苯分子的图像
分子的性质
分子的质量和体积都很小
构成物质的微粒——分子
一滴水中有1.67×1021个水分子,即:1670000000000000000000个。
一个水分子的质量是3×10-26千克,即0.00000000000000000000000003 kg。
如果10亿人都来数一滴水中的水分子,每人每分钟数100个,24小时不停的数,需要数多少年?
三万多年
分子的质量和体积都很小
构成物质的微粒——分子
分子的性质
分子与分子之间存在间隔
构成物质的微粒——分子
水
100 mL
酒精
100 mL
分子的性质
固体
液体
气体
气体分子
间的间隔
<
液体分子
间的间隔
固体分子
间的间隔
构成物质的微粒——分子
分子的性质
分子与分子之间存在间隔
<
品红分子在冷水和热水中的运动情况
分子总是不断地运动着
构成物质的微粒——分子
分子的性质
分子
原子
构成
在化学变化中破裂成
物质
构成
构成
构成物质的微粒——原子
原子的概念
原子是化学变化中的最小微粒。
原子可以构成分子,也可以直接构成某些物质。
注意:化学反应前后原子的种类和数目不变。
构成物质的微粒——原子
原子与分子的关系
分子 原子
相同点 都是构成物质的基本粒子;
质量、体积都非常小;
彼此间有间隔;
处于不断运动中;
同种物质的分子(原子)性质相同,不同种物质的分子(原子)性质不同
不同点 在化学变化中分子可以再分,而原子不可分
相互关系 分子可以分裂为原子,原子可以相互结合构成分子
构成物质的微粒——原子
原子的构成
质子(+)
中子
原子核
原子
核外电子(-)
{
(+){
构成物质的微粒——原子
构成物质的微粒——原子
原子的带电性
1个电子带一个单位负电荷
中子不带电
1个质子带一个单位正电荷
原子是否显电性?
核外电子数=核电荷数=质子数
不显电性
构成物质的微粒——原子
原子的带电性
质子带正电,中子不带电,电子带负电。
质子和中子的质量很小,但比电子大很多。
中子不带电,所以原子核的电性由质子决定,因此原子核带正电,数目跟质子相等。
总结
构成物质的微粒——原子
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
不同种类的原子,质子数、电子数不同。
质子数=核外电子数=核电荷数=原子序数。
不是所有原子都有中子。
几种常见原子的构成
注意:
构成物质的微粒——原子
原子核外电子排布规律
没有固定的轨道,但有经常出现的区域;
核外电子是分层排布的;
离核越近能量越低;
最外层电子最多不超过8个电子(只有1层的不超过2个电子)。
构成物质的微粒——原子
原子结构示意图
+8
2
6
原子核
电子层
质子数
电子层上的电子个数
构成物质的微粒——原子
氧元素的原子结构示意图
稀有气体元素的原子结构
He
Ne
特点:最外层电子数8个(氦2个)达到稳定状态。
构成物质的微粒——原子
原子结构示意图
金属元素的原子结构
Li
Be
Mg
Al
特点:最外层电子数一般少于4个,在化学变化中容易失去电子。
构成物质的微粒——原子
原子结构示意图
非金属元素的原子结构
H
B
F
C
N
特点:最外层电子数一般大于等于4个,在化学变化中容易得到电子。
构成物质的微粒——原子
原子结构示意图
O
原子的化学性质与其最外层电子数的关系
构成物质的微粒——原子
原子的分类 最外层电子数 得失电子趋势 化学性质 结论
金属原子 一般小于4 易失去电子 易发生化学反应 原子的化学性质与原子最外层电子数关系密切
非金属原子 一般大于4 易得到电子
稀有气体原子 等于8(氦等于2) 稳定结构 难发生化学反应
原子的相对原子质量
构成物质的微粒——原子
定义:以一种碳原子(C-12)的质量的1/12作为标准,
把其他原子的质量跟这个标准相比较所得到的比值,叫做这种原子的相对原子质量(符号为Ar)。
表达式
离子的概念
带电荷的原子或原子团。
离子的分类
阳离子:带正电荷,如 。
阴离子:带负电荷,如 。
构成物质的微粒——离子
离子的形成
构成物质的微粒——离子
质子数=核外电子数
质子数<核外电子数
阳离子:质子数>核外电子数;
阴离子:质子数<核外电子数;
质量数:原子核中质子数和中子数之和叫质量数。
质量数 = 质子数 + 中子数
离子质子数与核外电子数之间的关系
构成物质的微粒——离子
原子种类不同,质子数也不同。
原子中,核电荷数=质子数=核外电子数。
原子是由质子、中子、电子三种粒子构成,但不是所有的原子核内都有中子。
氢原子中没有中子。
在原子中质子数等于核外电子数,但质子数不一定等于中子数。
原子很小,但有一定质量,原子的质量主要集中在原子核上。
总结
质量数=质子数+中子数。
原子 ::核电荷数=质子数=核外电子数。
阳离子 :核电荷数=质子数>核外电子数,
核外电子数=a-m。
阴离子 :核电荷数=质子数<核外电子数,
核外电子数=b+n。
总结
第二章第2节
构成物质的微粒(Ⅰ)——分子
第二章第3节
构成物质的微粒(Ⅱ)——原子和离子
构成物质的微粒——分子
冲糖水时,把糖放到开水中,糖不见了,而杯中的水却变甜了;
把香水洒在小手巾上,抖开手巾,绕教室一周,教室内充满了香水的味道;
在玻璃管两端的胶塞内,分别放置蘸有浓盐酸和浓氨水的小团棉花,会发现玻璃管内靠近蘸浓盐酸的棉花部分产生浓浓的白烟。
所有这些现象都与分子有关,那什么是分子呢?
分子的定义
分子是构成物质的一种微粒,是保持物质化学性质的一种微粒。
注意:1.针对由分子构成的物质来说的。
2.分子只能保持物质的化学性质,不能保持 物质的物理性质。
构成物质的微粒——分子
水
水分子模型
构成物质的微粒——分子
分子的微观模型
氧气
氧气分子模型
构成物质的微粒——分子
用扫描隧道显微镜放大几百万倍获得的苯分子的图像
分子的性质
分子的质量和体积都很小
构成物质的微粒——分子
一滴水中有1.67×1021个水分子,即:1670000000000000000000个。
一个水分子的质量是3×10-26千克,即0.00000000000000000000000003 kg。
如果10亿人都来数一滴水中的水分子,每人每分钟数100个,24小时不停的数,需要数多少年?
三万多年
分子的质量和体积都很小
构成物质的微粒——分子
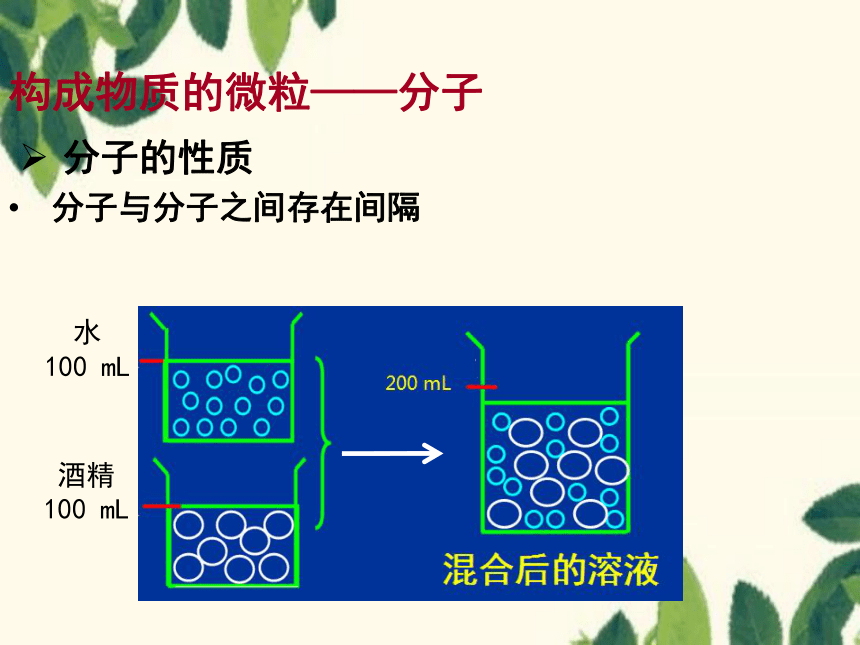
分子的性质
分子与分子之间存在间隔
构成物质的微粒——分子
水
100 mL
酒精
100 mL
分子的性质
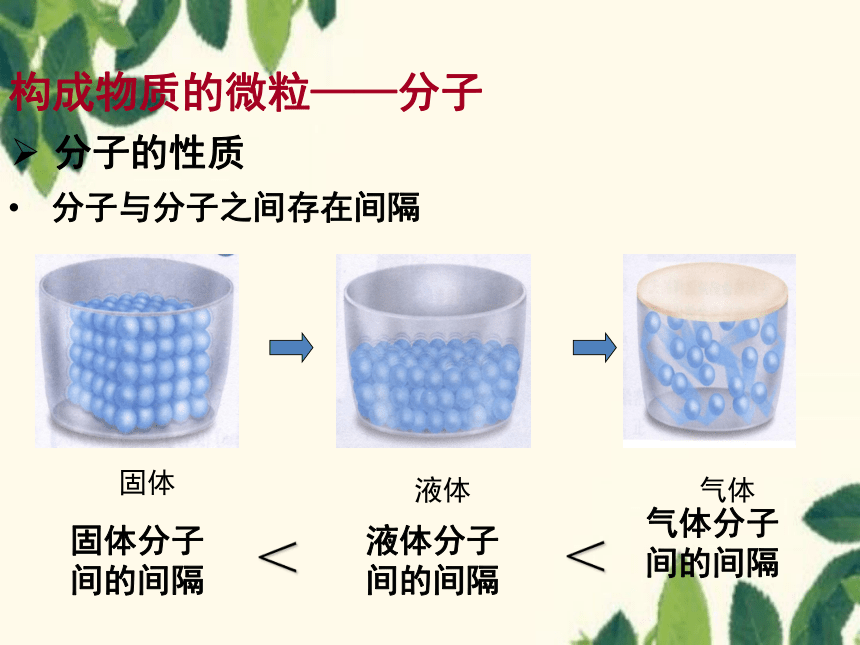
固体
液体
气体
气体分子
间的间隔
<
液体分子
间的间隔
固体分子
间的间隔
构成物质的微粒——分子
分子的性质
分子与分子之间存在间隔
<
品红分子在冷水和热水中的运动情况
分子总是不断地运动着
构成物质的微粒——分子
分子的性质
分子
原子
构成
在化学变化中破裂成
物质
构成
构成
构成物质的微粒——原子
原子的概念
原子是化学变化中的最小微粒。
原子可以构成分子,也可以直接构成某些物质。
注意:化学反应前后原子的种类和数目不变。
构成物质的微粒——原子
原子与分子的关系
分子 原子
相同点 都是构成物质的基本粒子;
质量、体积都非常小;
彼此间有间隔;
处于不断运动中;
同种物质的分子(原子)性质相同,不同种物质的分子(原子)性质不同
不同点 在化学变化中分子可以再分,而原子不可分
相互关系 分子可以分裂为原子,原子可以相互结合构成分子
构成物质的微粒——原子
原子的构成
质子(+)
中子
原子核
原子
核外电子(-)
{
(+){
构成物质的微粒——原子
构成物质的微粒——原子
原子的带电性
1个电子带一个单位负电荷
中子不带电
1个质子带一个单位正电荷
原子是否显电性?
核外电子数=核电荷数=质子数
不显电性
构成物质的微粒——原子
原子的带电性
质子带正电,中子不带电,电子带负电。
质子和中子的质量很小,但比电子大很多。
中子不带电,所以原子核的电性由质子决定,因此原子核带正电,数目跟质子相等。
总结
构成物质的微粒——原子
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
不同种类的原子,质子数、电子数不同。
质子数=核外电子数=核电荷数=原子序数。
不是所有原子都有中子。
几种常见原子的构成
注意:
构成物质的微粒——原子
原子核外电子排布规律
没有固定的轨道,但有经常出现的区域;
核外电子是分层排布的;
离核越近能量越低;
最外层电子最多不超过8个电子(只有1层的不超过2个电子)。
构成物质的微粒——原子
原子结构示意图
+8
2
6
原子核
电子层
质子数
电子层上的电子个数
构成物质的微粒——原子
氧元素的原子结构示意图
稀有气体元素的原子结构
He
Ne
特点:最外层电子数8个(氦2个)达到稳定状态。
构成物质的微粒——原子
原子结构示意图
金属元素的原子结构
Li
Be
Mg
Al
特点:最外层电子数一般少于4个,在化学变化中容易失去电子。
构成物质的微粒——原子
原子结构示意图
非金属元素的原子结构
H
B
F
C
N
特点:最外层电子数一般大于等于4个,在化学变化中容易得到电子。
构成物质的微粒——原子
原子结构示意图
O
原子的化学性质与其最外层电子数的关系
构成物质的微粒——原子
原子的分类 最外层电子数 得失电子趋势 化学性质 结论
金属原子 一般小于4 易失去电子 易发生化学反应 原子的化学性质与原子最外层电子数关系密切
非金属原子 一般大于4 易得到电子
稀有气体原子 等于8(氦等于2) 稳定结构 难发生化学反应
原子的相对原子质量
构成物质的微粒——原子
定义:以一种碳原子(C-12)的质量的1/12作为标准,
把其他原子的质量跟这个标准相比较所得到的比值,叫做这种原子的相对原子质量(符号为Ar)。
表达式
离子的概念
带电荷的原子或原子团。
离子的分类
阳离子:带正电荷,如 。
阴离子:带负电荷,如 。
构成物质的微粒——离子
离子的形成
构成物质的微粒——离子
质子数=核外电子数
质子数<核外电子数
阳离子:质子数>核外电子数;
阴离子:质子数<核外电子数;
质量数:原子核中质子数和中子数之和叫质量数。
质量数 = 质子数 + 中子数
离子质子数与核外电子数之间的关系
构成物质的微粒——离子
原子种类不同,质子数也不同。
原子中,核电荷数=质子数=核外电子数。
原子是由质子、中子、电子三种粒子构成,但不是所有的原子核内都有中子。
氢原子中没有中子。
在原子中质子数等于核外电子数,但质子数不一定等于中子数。
原子很小,但有一定质量,原子的质量主要集中在原子核上。
总结
质量数=质子数+中子数。
原子 ::核电荷数=质子数=核外电子数。
阳离子 :核电荷数=质子数>核外电子数,
核外电子数=a-m。
阴离子 :核电荷数=质子数<核外电子数,
核外电子数=b+n。
总结
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
