弱电解质的电离
图片预览









文档简介
(共32张PPT)
溶液导电性
溶液导电示意图:
定向移动
自由移动的离子
电解质溶于水
或受热熔化就能电离
电离
接通电源
导电
溶液导电性与离子浓度、离子所带的电荷数 有关。
电离并不需要通电,
只要溶于水或加热熔化就能电离。
开始灯泡亮:Ba(OH)2=Ba2+ + 2OH- (能导电)
Ba2++2OH- +2H+ +SO42-=BaSO4↓+2H2O
(灯泡逐渐变暗,最后熄灭)
最后灯泡又亮了,因为过量的硫酸:
H2SO4=2H+ + SO42- (能导电)
1.电解质在水溶液里或熔化状况下能导电的化合物。
酸:HCl HNO3 H2SO4 H3PO4 H2S HClO
碱:NaOH KOH Ca(OH)2 NH3·H2O Mg(OH)2
盐:NaCl CuSO4 CaCO3 NaHCO3
多数金属氧化物:Na2O MgO Al2O3 Na2O2
回顾.复习:电解质和非电解质
2、非电解质 在水溶液里和熔化状况下都不能导电的
化合物。
多数有机物:蔗糖 、酒精、乙醚、烃、苯等是非电解质。
非金属氧化物:CO2 SO3 SO2 NO2等是非电解质。
某些非金属氢化物: NH3 PH3 CH4
☆电解质与非电解质的判断: 主要看该化合物在溶于水或熔融状态下,自身能否电离出阴、阳离子,能电离的属于电解质,不能电离的属于非电解质。水溶液能够导电只能作为参考因素。
熔融的NaOH是电解质, 因Fe 、Cl2是单质,NaOH溶液是混合物.故Fe、 Cl2 NaOH溶液既不是电解质也不是非电解质。
Na2O是电解质的原因是它熔融状态下能导电,Na2O(熔融)=2Na+ +O2-
而不是溶于水能导电,因为:Na2O + H2O = 2NaOH
【问】CO2 SO3 SO2、NH3的水溶液能导电,它们是电解质吗?
------SO2、Cl2、NH3的水溶液虽然能导电,但自身不能电离出阴、阳离子,而是靠生成的酸或碱电离出阴、阳离子,
故CO2 SO3 SO2、NH3是非电解质.
【问】 Fe、 Cl2 的水溶液、熔融的NaOH 、 NaOH溶液能导电,
它们是电解质吗?
(1)下列说法正确的是( )
A.液态HCl不导电,所以HCl是非电解质。
B.NH3、CO2的水溶液均导电,所以NH3、CO2是电解质。
C.铁、石墨都能导电,所以铁、石墨是电解质。
D.蔗糖在水溶液里和熔化状况下都不能导电,
它是非电解质。
D
(2)下列物质属于非电解质的是( )
A HF B Cl2 C P2O5 D CO
CD
(3) NaHSO4在水溶液里电离出的离子是___________。
Na+和H+ 和SO42-
讨 论
NaHSO4在熔融状况下电离出的离子是___________。
Na+和HSO4-
×
×
×
√
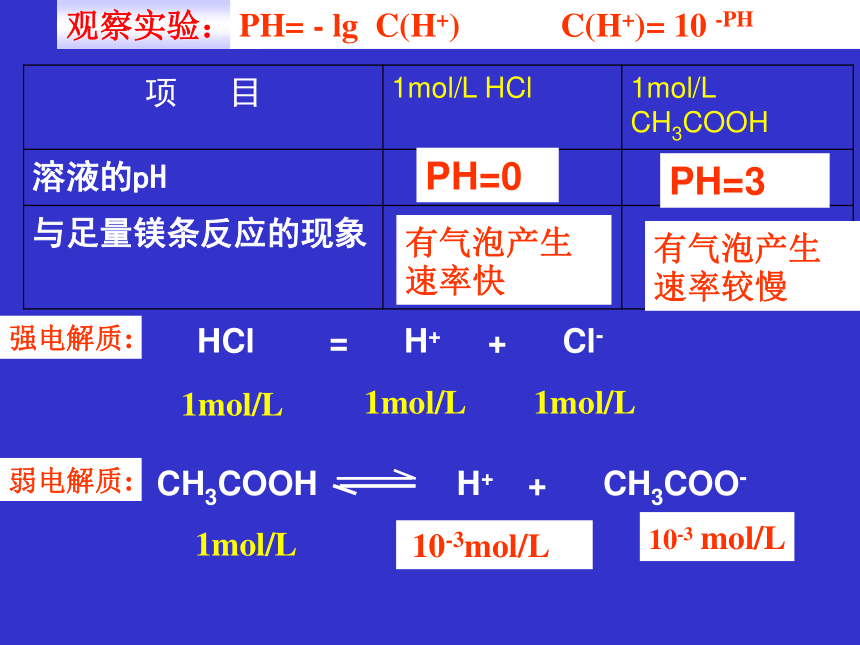
项 目 1mol/L HCl 1mol/L CH3COOH
溶液的pH
与足量镁条反应的现象
PH=0
PH=3
观察实验:
有气泡产生速率快
有气泡产生速率较慢
CH3COOH H+ + CH3COO-
弱电解质:
HCl = H+ + Cl-
1mol/L
1mol/L
1mol/L
1mol/L
10-3mol/L
10-3 mol/L
PH= - lg C(H+) C(H+)= 10 -PH
强电解质:
第三章 水溶液中的离子平衡
第一节 弱电解质的电离
1.了解强、弱电解质在水溶液中电离程度的差异及其原因,在化学平衡概念的基础上理解电离平衡概念。
2.了解酸碱电离理论,能运用电离平衡原理解释弱电解质在水溶液中的电离情况。
3. 会书写电离方程式。
强电解质在稀水溶液中全部以离子形态存在。
盐酸溶液中全部是H+和Cl-,无HCl分子存在。
(还有大量H2O分子,极少量OH-)
1、强电解质:在水溶液里能全部电离成离子的电解质。
HCl = H+ + Cl-
CH3COOH H+ + CH3COO-
弱电解质在稀水溶液中电离的趋势很小,主要以分子形态存在,离子很少。
醋酸溶液中主要是醋酸分子,只有少量H+和CH3COO-
(还有大量H2O分子,极少量OH-)
2、弱电解质:在水溶液里部分电离成离子的电解质。
3.划分强弱电解质的标准: 电解质在水溶液里能否完全电离.
第1节 弱电解质的电离
一、强弱电解质:
强电解质
强酸:HCl H2SO4 HNO3 HBr HI等
强碱: NaOH KOH Ba(OH)2 Ca(OH)2
大多数盐:ZnCl2 Na2CO3 NH4NO3
NaHSO4 CaCO3 BaSO4
活泼金属氧化物 :Na2O K2O MgO Al2O3 Na2O2等
强电解质在溶液中以水合离子的形式存在。
弱电解质
弱酸:H2CO3 CH3COOH HF HClO等
弱碱:NH3.H2O Cu(OH)2 Fe(OH)3
水: H2O
个别盐 如HgCl2 PbAc2
弱电解质在溶液中以分子、水合离子的形式存在。
◆CaCO3 BaSO4虽难溶于水,但溶解的那少量完全电离 CaCO3=Ca2+ +CO32- 故它们是强电解质。
NH3.H2O → NH4+ + OH- H2O →H+ + OH-
H2SO4=2H++SO42—
Fe2(SO4)3=2Fe3++3SO42—
CaCO3=Ca2+ +CO32-
NaHSO4=Na + +H++SO42—
1. 强电解质的电离方程式:(全部电离用“=”)
二、电离方程式的书写:
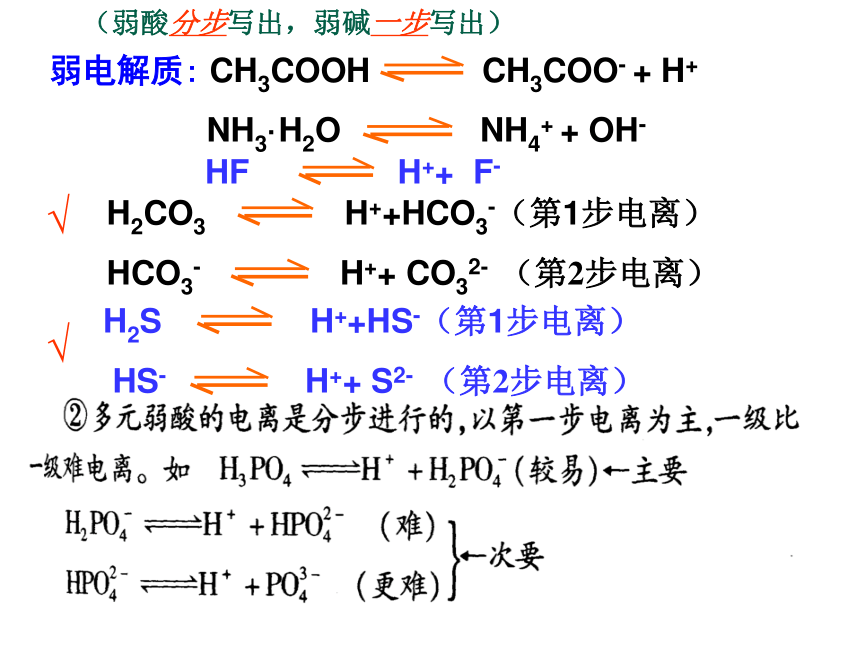
2. 弱电解质的电离方程式:(部分电离用可逆符号“→”)
(弱酸分步写出,弱碱一步写出)
醋酸溶液
H2S H++HS—
HS— H++S2—
CH3COOH CH3COO—+H+
(第一步电离程度相对大些)
(第二步电离程度更小)
外加酸或碱都会使水的电离平衡向逆方向移动
NH3.H2O → NH4+ + OH- Fe(OH)3 → Fe3+ + 3OH-
H2O →H+ + OH-
硫化氢水溶液
弱电解质: CH3COOH CH3COO- + H+
NH3·H2O NH4+ + OH-
H2CO3 H++HCO3-(第1步电离)
HCO3- H++ CO32- (第2步电离)
H2S H++HS-(第1步电离)
HS- H++ S2- (第2步电离)
HF H++ F-
√
√
(弱酸分步写出,弱碱一步写出)
V离子化= V分子化
平衡状态
V离子结合成分子
t1
0
t
V
弱电解质电离的V-t图
V分子离解成离子
CH3COOH CH3COO - + H+
离子化
分子化
三、电离平衡: 在一定条件下,当电解质分子离解成离子的速率和离子结合成分子的速率相等,就达到了电离平衡.
填写《课本》P42图表:
一元弱酸:H+ + A- HA
C(H+) C(A-) C(HA)
HA初溶于水时
达到电离平衡前
达到电离平衡后
一元弱碱:B+ +OH- BOH
C(B+) C(OH-) C(BOH)
等体积等浓度的B+ OH-溶液相混合时
达到电离平衡前
达到电离平衡后
最大
最小
最小
变大
变大
变小
不变
不变
不变
最大
最大
最小
变小
变小
变大
不变
不变
不变
1. 电离平衡常数
在一定温度下,当弱电解质在溶液中达到电离平衡时,溶液中各种离子浓度的乘积,跟溶液中未电离的分子浓度之比是一个常数,称为电离平衡常数,简称为电离常数。用K表示。
(一般酸的电离常数用Ka表示,碱的电离常数用Kb表示)
例如:CH3COOH的电离平衡常数为:
CH3COOH CH3COO- + H+
例如:25℃时, Ka(HNO2) =4.6×10-4, Ka(CH3COOH)=1.8 ×10-5,
Ka(HCN)=6.2×10-10.试比较它们酸性的强弱。
酸的强弱: HNO2 > CH3COOH > HCN
☆电离常数K只与温度有关,温度升高,K值增大
与电解质的浓度无关。
(氢氰酸)
(亚硝酸)
电离度:当弱电解质在溶液中达到平衡时,溶液中已经电离的电解质分子数占原来总分子数的百分数。
电离度(补充内容)
α =————— 100%
n (已电离)
n (总)
( 讨论)25℃,0.1mol/LCH3COOH溶液,
测得c (H+)=1.32 10-3mol/L , 求α
c (已电离)
c (总)
= ———— 100%
c (已电离)
c (总)
= ———— 100%
α
=
1.32 10-3mol/L
0.1 mol/L
100%
=1.32%
☆电离常数K只与温度有关,温度升高,K值增大
K与浓度无关.
☆ 电离度受温度和浓度的影响
浓度越大,电离度越小。
温度越高,电离度越大;
(问)为什么弱电解质浓度越大电离程度越小?
------弱电解质的电离依靠水的作用,浓度越大,相对水的含量就少,促进电离的能力就越弱,电离程度就越小。越稀越电离。
加水稀释,醋酸分子,醋酸离子,以及氢离子浓度都在减小,右边是两种离子浓度减小,因此减小的程度更大,平衡正向移动, (越稀越电离)
CH3COOH CH3COO- + H+
从电离平衡的角度:
根据电离平衡常数计算,可得出(越稀越电离)
(1)温度(越热越电离)
电离过程是吸热过程,温度升高,平衡向电离方向移动
(2)浓度(越稀越电离)
弱电解质浓度越小,电离程度越大
(3)同离子效应(抑制电离)
加入与弱电解质具有相同离子的强电解质,使电离平衡逆向移动
(4)化学反应(促进电离)
加入与弱电解质电离产生的某种离子反应的物质时,使电离平衡正向移动
2.影响电离平衡的因素
决定因素—弱电解质的本性;
外界条件的影响主要是—温度, 浓度;
升高温度,电离度增大,离子浓度增大
稀释使电离度增大,离子浓度一般减少
(探讨) 在CH3COOH溶液中分别加入下列物质,对CH3COOH的电离平衡各有什么影响?
CH3COOH CH3COO—+H+
加入物质或方法 盐酸 NaOH固体 加热 CH3COONa 大量水
电离平衡移动方向
逆
逆
正
正
正
化学平衡移动原理(勒夏特列原理)也适用于电离平衡,当条件发生改变时,电离平衡也发生移动。
勒夏特列原理: 在一个平衡体系中,若改变影响平衡的一个条件,平衡总是向减弱这种改变的方向移动。 #FIRST
HAc H+ + Ac-
起始量
变化量
平衡量
C(H+)
C- C(H+)
C(H+)
0
0
C
C(H+)
C(H+)
C(H+)
当Ka﹤10-4 ,
探讨:求25℃时,Cmol/L的CH3COOH溶液的氢离子浓度和电离度, Ka=1.8×10-5.
有关电离常数 、离子浓度及电离度的计算:
对于一元弱酸HA溶液,(若Ka<10-5时),其电离度α、氢离子浓度H+、电离平衡常数Ka三者关系:
NH3 H2O的电离平衡常数为:
NH3 H2O NH4+ + OH-
25℃时,Kb(NH3 H2O) = 1.8×10-5
对于一元弱碱BOH溶液,(若Ka<10-5时),其电离度α、OH-、电离平衡常数Kb三者关系:
b
(OH-)=
(讨论1)在1升浓度为c摩/升的弱酸HA溶液中,HA、H+和A-的物质的量之和为nc摩,则HA的电离度是 (A) n×100% (B)n/2 ×100%
(C) (n-1)×100% (D)n%
C
有关电离度计算
HA H+ + A-
始
变
平
0
0
C
X
X
X
C- X
X
X
C- X + +
X
X
= n C
X=(n-1)C
a=
(n-1)C
C
×100%
=(n-1)
×100%
HA H+ + A-
(讨论2) 相同温度下,两种稀氨水A和B,浓度分别为0.2mol/L和0.1mol/L,则A、B的OH-浓度之比为( )
A.大于2 B. 小于2
C. 等于2 D. 不能肯定
B
课堂 . 探讨
3.在25℃时,用蒸馏水稀释氨水,随溶液的稀释,下列各项中始终保持增大趋势的是( )
B.
C.
D.
A.
A
课堂 . 探讨
不变
讨论4.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如左图所示,
⑴O点导电能力为0的理由是
⑵a、b、c三点溶液的c(H+)由小到大的顺序是
⑶a、b、c三点醋酸的电离程度最大的是
⑷要使c点c(Ac— )增大,c(H+)减少,可采取的措施是(至少写出三种方法)
① ,
② ,
③ ,
④ 。
导电能力
加水体积
O
a
b
c
课堂 . 探讨电离平衡的移动
因冰醋酸为无水CH3COOH (HAc), 在O点无自由移动的离子.
c(H+): c ﹤ a ﹤ b
b
HAc H+ + Ac-
醋酸 醋酸根离子
加NaOH固体或溶液
加NaAc固体或溶液
加Na2CO3固体或溶液
加Zn
或CaO
或CaCO3
讨论5.某二元弱酸H2A溶液中,[A2-]浓度最大的是( )
A.0.01mol/L的H2A溶液
B.0.01mol/LNaHA溶液
C.0.02mol/L的HCl与0.04mol/LNaHA溶液等体积混合的 溶液
D. 0.02mol/L的NaOH与0.02mol/LNaHA溶液等体积混合的溶液
D
2. 一定量的盐酸与过量的锌反应制氢气,为了减缓速率,且不影响生成氢气的总量,可向盐酸中加入( )
A NaCl溶液 B NaNO3溶液
C NH4Cl (固体) D CH3COONa (固体)
1.在CH3COOH CH3COO-+H+的电离平衡中,要使平衡
右移且氢氧根离子浓度增大,应采取的措施是( )
A 加入硫酸 B 加入氢氧化钠
C加水 D 升温
BC
AD
课堂 . 作业
3.用水稀释0.1mol·L-1氨水时,溶液中随着水量的增加而增加的是( )
A.c(OH-)/c(NH3·H2O) B.c(NH3·H2O)/c(OH-)
C.c (H+)和c (OH-)的乘积 D.OH-的物质的量浓度
A
5. 1mol/L的盐酸、醋酸1L,分别加入足量的铁。
开始反应时产生氢气的速率________ ,
最终收集到的氢气的物质的量______ 。
硫酸>盐酸>醋酸
硫酸>盐酸=醋酸
4.将0.2mol·L-1醋酸溶液加水稀释,下列说法正确的是( )
A.c(H+)和c(OH-)都减小 B.溶液中c(OH-)增大
C.电离平衡向右移动 D.溶液的pH增大
5.用水稀释0.1mol·L-1氨水时,溶液中随着水量的增加而增加的是( )
A.c(OH-)/c(NH3·H2O) B.c(NH3·H2O)/c(OH-)
C.c (H+)和c (OH-)的乘积 D.OH-的物质的量浓度
BC
A
6.某二元弱酸H2A溶液中,[A2-]浓度最大的是( )
A.0.01mol/L的H2A溶液 B.0.01mol/LNaHA溶液
C.0.02mol/L的HCl与0.04mol/LNaHA溶液等体积混合的溶液
D. 0.02mol/L的NaOH与0.02mol/LNaHA溶液等体积混合的溶液
D
(讨论) 在2mol/L的醋酸溶液中分别采取:①加水、②加氢氧化钠溶液、③加稀硫酸、④加NaAC固体 ⑤加热、⑥加锌对醋酸溶液的电离平衡有何影响?[H+]、[AC-]、电离度如何变化?填下表。
平衡移动方向 [H+] [AC-] 电离度
水
NaOH
稀硫酸
NaAC
加热
加锌
正向移动
减小
增大
增大
逆向移动
增大
减小
减小
减小
增大
减小
增大
增大
增大
减小
增大
增大
逆向移动
正向移动
正向移动
正向移动
减少
减少
增大
对于一元弱碱溶液,(若Kb<10-5时),其电离度α、氢氧根离子浓度OH-、电离平衡常数Kb三者关系:
对于一元弱酸HA溶液,(若Ka<10-5时),其电离度α、氢离子浓度H+、电离平衡常数Ka三者关系:
1.电离常数K只与温度有关,温度升高,K值增大
与电解质的浓度无关。
2.电离度受温度和浓度的影响
浓度越大,电离度越小。
温度越高,电离度越大;
知识归纳
强电解质 弱电解质
相同点
不同点 电离程度
电离过程
表示方法
存在形式
都是电解质,在水溶液中均能电离
完全电离
部分电离
不可逆过程
可逆过程
水合离子
分子和水合离子
Al2(SO4)3=
KHSO4 =
NaHCO3=
HI =
2Al3++3SO42-
K++H++SO42-
Na++HCO3-
H++I-
CH3COOH CH3COO- + H+
NH3·H2O NH4+ + OH-
Fe(OH)3 Fe3++3OH-
强电解质的电离方程式:(全部电离用“=”)
弱电解质的电离方程式:(部分电离用可逆符号“→”)
(弱酸分步写出,弱碱一步写出)
(1)下列物质中属于强电解质的是( )
A H2O B CaCl2 C Fe(OH)2 D HBr
(2)下列物质的水溶液中,除水分子外还存在其它分子的是( )
A盐酸 B 醋酸 C 硝酸钾 D 氨水
(3)下列物质中,导电性最差的是( )
A熔融氢氧化钠 B 盐酸溶液
C 氨水溶液 D 固态氯化钾
B D
B D
D
讨 论
多元弱酸是分步电离的,每步各有电离常数,通常用Ka1Ka2Ka3表示.如:H3PO4的电离。
HPO42- H++PO43- Ka3=2.2×10-13
H2PO4- H++HPO42- Ka2=6.2×10-8
H3PO4 H++H2PO4- Ka1=7.5×10-3
从上可看出:Ka1>Ka2>Ka3,Ka1比Ka2约大105倍,Ka2比Ka3约大105倍,多元弱酸的电离主要由第一步决定.几种常见的多元弱酸的电离常数.
H2CO3 K1=4.3×10-7 ,K2=5.6×10-11
H2SO3 K1=1.5×10-3 , K2=1.0×10-8
H2S K1=9.1×10-8 , K2=1.0×10-12
溶液导电性
溶液导电示意图:
定向移动
自由移动的离子
电解质溶于水
或受热熔化就能电离
电离
接通电源
导电
溶液导电性与离子浓度、离子所带的电荷数 有关。
电离并不需要通电,
只要溶于水或加热熔化就能电离。
开始灯泡亮:Ba(OH)2=Ba2+ + 2OH- (能导电)
Ba2++2OH- +2H+ +SO42-=BaSO4↓+2H2O
(灯泡逐渐变暗,最后熄灭)
最后灯泡又亮了,因为过量的硫酸:
H2SO4=2H+ + SO42- (能导电)
1.电解质在水溶液里或熔化状况下能导电的化合物。
酸:HCl HNO3 H2SO4 H3PO4 H2S HClO
碱:NaOH KOH Ca(OH)2 NH3·H2O Mg(OH)2
盐:NaCl CuSO4 CaCO3 NaHCO3
多数金属氧化物:Na2O MgO Al2O3 Na2O2
回顾.复习:电解质和非电解质
2、非电解质 在水溶液里和熔化状况下都不能导电的
化合物。
多数有机物:蔗糖 、酒精、乙醚、烃、苯等是非电解质。
非金属氧化物:CO2 SO3 SO2 NO2等是非电解质。
某些非金属氢化物: NH3 PH3 CH4
☆电解质与非电解质的判断: 主要看该化合物在溶于水或熔融状态下,自身能否电离出阴、阳离子,能电离的属于电解质,不能电离的属于非电解质。水溶液能够导电只能作为参考因素。
熔融的NaOH是电解质, 因Fe 、Cl2是单质,NaOH溶液是混合物.故Fe、 Cl2 NaOH溶液既不是电解质也不是非电解质。
Na2O是电解质的原因是它熔融状态下能导电,Na2O(熔融)=2Na+ +O2-
而不是溶于水能导电,因为:Na2O + H2O = 2NaOH
【问】CO2 SO3 SO2、NH3的水溶液能导电,它们是电解质吗?
------SO2、Cl2、NH3的水溶液虽然能导电,但自身不能电离出阴、阳离子,而是靠生成的酸或碱电离出阴、阳离子,
故CO2 SO3 SO2、NH3是非电解质.
【问】 Fe、 Cl2 的水溶液、熔融的NaOH 、 NaOH溶液能导电,
它们是电解质吗?
(1)下列说法正确的是( )
A.液态HCl不导电,所以HCl是非电解质。
B.NH3、CO2的水溶液均导电,所以NH3、CO2是电解质。
C.铁、石墨都能导电,所以铁、石墨是电解质。
D.蔗糖在水溶液里和熔化状况下都不能导电,
它是非电解质。
D
(2)下列物质属于非电解质的是( )
A HF B Cl2 C P2O5 D CO
CD
(3) NaHSO4在水溶液里电离出的离子是___________。
Na+和H+ 和SO42-
讨 论
NaHSO4在熔融状况下电离出的离子是___________。
Na+和HSO4-
×
×
×
√
项 目 1mol/L HCl 1mol/L CH3COOH
溶液的pH
与足量镁条反应的现象
PH=0
PH=3
观察实验:
有气泡产生速率快
有气泡产生速率较慢
CH3COOH H+ + CH3COO-
弱电解质:
HCl = H+ + Cl-
1mol/L
1mol/L
1mol/L
1mol/L
10-3mol/L
10-3 mol/L
PH= - lg C(H+) C(H+)= 10 -PH
强电解质:
第三章 水溶液中的离子平衡
第一节 弱电解质的电离
1.了解强、弱电解质在水溶液中电离程度的差异及其原因,在化学平衡概念的基础上理解电离平衡概念。
2.了解酸碱电离理论,能运用电离平衡原理解释弱电解质在水溶液中的电离情况。
3. 会书写电离方程式。
强电解质在稀水溶液中全部以离子形态存在。
盐酸溶液中全部是H+和Cl-,无HCl分子存在。
(还有大量H2O分子,极少量OH-)
1、强电解质:在水溶液里能全部电离成离子的电解质。
HCl = H+ + Cl-
CH3COOH H+ + CH3COO-
弱电解质在稀水溶液中电离的趋势很小,主要以分子形态存在,离子很少。
醋酸溶液中主要是醋酸分子,只有少量H+和CH3COO-
(还有大量H2O分子,极少量OH-)
2、弱电解质:在水溶液里部分电离成离子的电解质。
3.划分强弱电解质的标准: 电解质在水溶液里能否完全电离.
第1节 弱电解质的电离
一、强弱电解质:
强电解质
强酸:HCl H2SO4 HNO3 HBr HI等
强碱: NaOH KOH Ba(OH)2 Ca(OH)2
大多数盐:ZnCl2 Na2CO3 NH4NO3
NaHSO4 CaCO3 BaSO4
活泼金属氧化物 :Na2O K2O MgO Al2O3 Na2O2等
强电解质在溶液中以水合离子的形式存在。
弱电解质
弱酸:H2CO3 CH3COOH HF HClO等
弱碱:NH3.H2O Cu(OH)2 Fe(OH)3
水: H2O
个别盐 如HgCl2 PbAc2
弱电解质在溶液中以分子、水合离子的形式存在。
◆CaCO3 BaSO4虽难溶于水,但溶解的那少量完全电离 CaCO3=Ca2+ +CO32- 故它们是强电解质。
NH3.H2O → NH4+ + OH- H2O →H+ + OH-
H2SO4=2H++SO42—
Fe2(SO4)3=2Fe3++3SO42—
CaCO3=Ca2+ +CO32-
NaHSO4=Na + +H++SO42—
1. 强电解质的电离方程式:(全部电离用“=”)
二、电离方程式的书写:
2. 弱电解质的电离方程式:(部分电离用可逆符号“→”)
(弱酸分步写出,弱碱一步写出)
醋酸溶液
H2S H++HS—
HS— H++S2—
CH3COOH CH3COO—+H+
(第一步电离程度相对大些)
(第二步电离程度更小)
外加酸或碱都会使水的电离平衡向逆方向移动
NH3.H2O → NH4+ + OH- Fe(OH)3 → Fe3+ + 3OH-
H2O →H+ + OH-
硫化氢水溶液
弱电解质: CH3COOH CH3COO- + H+
NH3·H2O NH4+ + OH-
H2CO3 H++HCO3-(第1步电离)
HCO3- H++ CO32- (第2步电离)
H2S H++HS-(第1步电离)
HS- H++ S2- (第2步电离)
HF H++ F-
√
√
(弱酸分步写出,弱碱一步写出)
V离子化= V分子化
平衡状态
V离子结合成分子
t1
0
t
V
弱电解质电离的V-t图
V分子离解成离子
CH3COOH CH3COO - + H+
离子化
分子化
三、电离平衡: 在一定条件下,当电解质分子离解成离子的速率和离子结合成分子的速率相等,就达到了电离平衡.
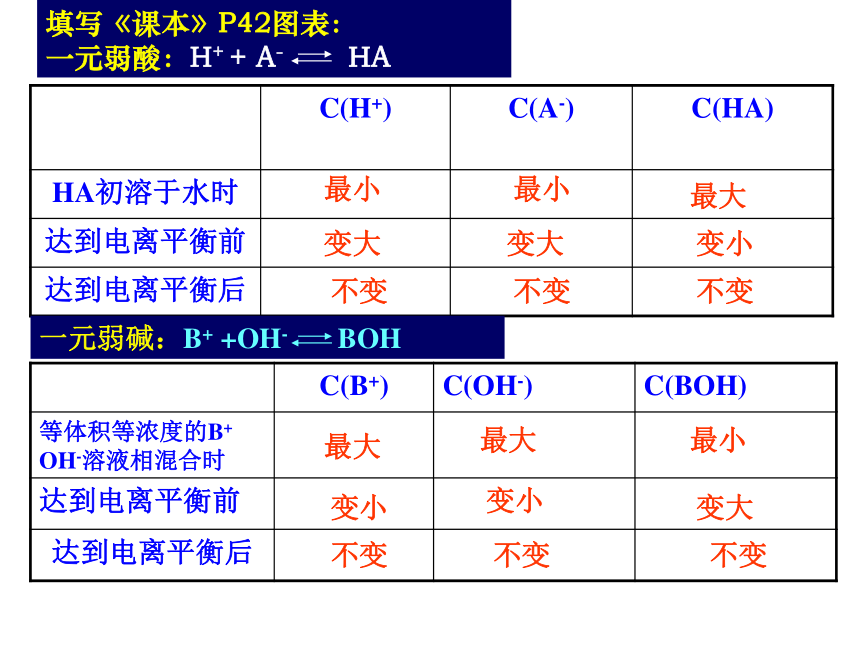
填写《课本》P42图表:
一元弱酸:H+ + A- HA
C(H+) C(A-) C(HA)
HA初溶于水时
达到电离平衡前
达到电离平衡后
一元弱碱:B+ +OH- BOH
C(B+) C(OH-) C(BOH)
等体积等浓度的B+ OH-溶液相混合时
达到电离平衡前
达到电离平衡后
最大
最小
最小
变大
变大
变小
不变
不变
不变
最大
最大
最小
变小
变小
变大
不变
不变
不变
1. 电离平衡常数
在一定温度下,当弱电解质在溶液中达到电离平衡时,溶液中各种离子浓度的乘积,跟溶液中未电离的分子浓度之比是一个常数,称为电离平衡常数,简称为电离常数。用K表示。
(一般酸的电离常数用Ka表示,碱的电离常数用Kb表示)
例如:CH3COOH的电离平衡常数为:
CH3COOH CH3COO- + H+
例如:25℃时, Ka(HNO2) =4.6×10-4, Ka(CH3COOH)=1.8 ×10-5,
Ka(HCN)=6.2×10-10.试比较它们酸性的强弱。
酸的强弱: HNO2 > CH3COOH > HCN
☆电离常数K只与温度有关,温度升高,K值增大
与电解质的浓度无关。
(氢氰酸)
(亚硝酸)
电离度:当弱电解质在溶液中达到平衡时,溶液中已经电离的电解质分子数占原来总分子数的百分数。
电离度(补充内容)
α =————— 100%
n (已电离)
n (总)
( 讨论)25℃,0.1mol/LCH3COOH溶液,
测得c (H+)=1.32 10-3mol/L , 求α
c (已电离)
c (总)
= ———— 100%
c (已电离)
c (总)
= ———— 100%
α
=
1.32 10-3mol/L
0.1 mol/L
100%
=1.32%
☆电离常数K只与温度有关,温度升高,K值增大
K与浓度无关.
☆ 电离度受温度和浓度的影响
浓度越大,电离度越小。
温度越高,电离度越大;
(问)为什么弱电解质浓度越大电离程度越小?
------弱电解质的电离依靠水的作用,浓度越大,相对水的含量就少,促进电离的能力就越弱,电离程度就越小。越稀越电离。
加水稀释,醋酸分子,醋酸离子,以及氢离子浓度都在减小,右边是两种离子浓度减小,因此减小的程度更大,平衡正向移动, (越稀越电离)
CH3COOH CH3COO- + H+
从电离平衡的角度:
根据电离平衡常数计算,可得出(越稀越电离)
(1)温度(越热越电离)
电离过程是吸热过程,温度升高,平衡向电离方向移动
(2)浓度(越稀越电离)
弱电解质浓度越小,电离程度越大
(3)同离子效应(抑制电离)
加入与弱电解质具有相同离子的强电解质,使电离平衡逆向移动
(4)化学反应(促进电离)
加入与弱电解质电离产生的某种离子反应的物质时,使电离平衡正向移动
2.影响电离平衡的因素
决定因素—弱电解质的本性;
外界条件的影响主要是—温度, 浓度;
升高温度,电离度增大,离子浓度增大
稀释使电离度增大,离子浓度一般减少
(探讨) 在CH3COOH溶液中分别加入下列物质,对CH3COOH的电离平衡各有什么影响?
CH3COOH CH3COO—+H+
加入物质或方法 盐酸 NaOH固体 加热 CH3COONa 大量水
电离平衡移动方向
逆
逆
正
正
正
化学平衡移动原理(勒夏特列原理)也适用于电离平衡,当条件发生改变时,电离平衡也发生移动。
勒夏特列原理: 在一个平衡体系中,若改变影响平衡的一个条件,平衡总是向减弱这种改变的方向移动。 #FIRST
HAc H+ + Ac-
起始量
变化量
平衡量
C(H+)
C- C(H+)
C(H+)
0
0
C
C(H+)
C(H+)
C(H+)
当Ka﹤10-4 ,
探讨:求25℃时,Cmol/L的CH3COOH溶液的氢离子浓度和电离度, Ka=1.8×10-5.
有关电离常数 、离子浓度及电离度的计算:
对于一元弱酸HA溶液,(若Ka<10-5时),其电离度α、氢离子浓度H+、电离平衡常数Ka三者关系:
NH3 H2O的电离平衡常数为:
NH3 H2O NH4+ + OH-
25℃时,Kb(NH3 H2O) = 1.8×10-5
对于一元弱碱BOH溶液,(若Ka<10-5时),其电离度α、OH-、电离平衡常数Kb三者关系:
b
(OH-)=
(讨论1)在1升浓度为c摩/升的弱酸HA溶液中,HA、H+和A-的物质的量之和为nc摩,则HA的电离度是 (A) n×100% (B)n/2 ×100%
(C) (n-1)×100% (D)n%
C
有关电离度计算
HA H+ + A-
始
变
平
0
0
C
X
X
X
C- X
X
X
C- X + +
X
X
= n C
X=(n-1)C
a=
(n-1)C
C
×100%
=(n-1)
×100%
HA H+ + A-
(讨论2) 相同温度下,两种稀氨水A和B,浓度分别为0.2mol/L和0.1mol/L,则A、B的OH-浓度之比为( )
A.大于2 B. 小于2
C. 等于2 D. 不能肯定
B
课堂 . 探讨
3.在25℃时,用蒸馏水稀释氨水,随溶液的稀释,下列各项中始终保持增大趋势的是( )
B.
C.
D.
A.
A
课堂 . 探讨
不变
讨论4.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如左图所示,
⑴O点导电能力为0的理由是
⑵a、b、c三点溶液的c(H+)由小到大的顺序是
⑶a、b、c三点醋酸的电离程度最大的是
⑷要使c点c(Ac— )增大,c(H+)减少,可采取的措施是(至少写出三种方法)
① ,
② ,
③ ,
④ 。
导电能力
加水体积
O
a
b
c
课堂 . 探讨电离平衡的移动
因冰醋酸为无水CH3COOH (HAc), 在O点无自由移动的离子.
c(H+): c ﹤ a ﹤ b
b
HAc H+ + Ac-
醋酸 醋酸根离子
加NaOH固体或溶液
加NaAc固体或溶液
加Na2CO3固体或溶液
加Zn
或CaO
或CaCO3
讨论5.某二元弱酸H2A溶液中,[A2-]浓度最大的是( )
A.0.01mol/L的H2A溶液
B.0.01mol/LNaHA溶液
C.0.02mol/L的HCl与0.04mol/LNaHA溶液等体积混合的 溶液
D. 0.02mol/L的NaOH与0.02mol/LNaHA溶液等体积混合的溶液
D
2. 一定量的盐酸与过量的锌反应制氢气,为了减缓速率,且不影响生成氢气的总量,可向盐酸中加入( )
A NaCl溶液 B NaNO3溶液
C NH4Cl (固体) D CH3COONa (固体)
1.在CH3COOH CH3COO-+H+的电离平衡中,要使平衡
右移且氢氧根离子浓度增大,应采取的措施是( )
A 加入硫酸 B 加入氢氧化钠
C加水 D 升温
BC
AD
课堂 . 作业
3.用水稀释0.1mol·L-1氨水时,溶液中随着水量的增加而增加的是( )
A.c(OH-)/c(NH3·H2O) B.c(NH3·H2O)/c(OH-)
C.c (H+)和c (OH-)的乘积 D.OH-的物质的量浓度
A
5. 1mol/L的盐酸、醋酸1L,分别加入足量的铁。
开始反应时产生氢气的速率________ ,
最终收集到的氢气的物质的量______ 。
硫酸>盐酸>醋酸
硫酸>盐酸=醋酸
4.将0.2mol·L-1醋酸溶液加水稀释,下列说法正确的是( )
A.c(H+)和c(OH-)都减小 B.溶液中c(OH-)增大
C.电离平衡向右移动 D.溶液的pH增大
5.用水稀释0.1mol·L-1氨水时,溶液中随着水量的增加而增加的是( )
A.c(OH-)/c(NH3·H2O) B.c(NH3·H2O)/c(OH-)
C.c (H+)和c (OH-)的乘积 D.OH-的物质的量浓度
BC
A
6.某二元弱酸H2A溶液中,[A2-]浓度最大的是( )
A.0.01mol/L的H2A溶液 B.0.01mol/LNaHA溶液
C.0.02mol/L的HCl与0.04mol/LNaHA溶液等体积混合的溶液
D. 0.02mol/L的NaOH与0.02mol/LNaHA溶液等体积混合的溶液
D
(讨论) 在2mol/L的醋酸溶液中分别采取:①加水、②加氢氧化钠溶液、③加稀硫酸、④加NaAC固体 ⑤加热、⑥加锌对醋酸溶液的电离平衡有何影响?[H+]、[AC-]、电离度如何变化?填下表。
平衡移动方向 [H+] [AC-] 电离度
水
NaOH
稀硫酸
NaAC
加热
加锌
正向移动
减小
增大
增大
逆向移动
增大
减小
减小
减小
增大
减小
增大
增大
增大
减小
增大
增大
逆向移动
正向移动
正向移动
正向移动
减少
减少
增大
对于一元弱碱溶液,(若Kb<10-5时),其电离度α、氢氧根离子浓度OH-、电离平衡常数Kb三者关系:
对于一元弱酸HA溶液,(若Ka<10-5时),其电离度α、氢离子浓度H+、电离平衡常数Ka三者关系:
1.电离常数K只与温度有关,温度升高,K值增大
与电解质的浓度无关。
2.电离度受温度和浓度的影响
浓度越大,电离度越小。
温度越高,电离度越大;
知识归纳
强电解质 弱电解质
相同点
不同点 电离程度
电离过程
表示方法
存在形式
都是电解质,在水溶液中均能电离
完全电离
部分电离
不可逆过程
可逆过程
水合离子
分子和水合离子
Al2(SO4)3=
KHSO4 =
NaHCO3=
HI =
2Al3++3SO42-
K++H++SO42-
Na++HCO3-
H++I-
CH3COOH CH3COO- + H+
NH3·H2O NH4+ + OH-
Fe(OH)3 Fe3++3OH-
强电解质的电离方程式:(全部电离用“=”)
弱电解质的电离方程式:(部分电离用可逆符号“→”)
(弱酸分步写出,弱碱一步写出)
(1)下列物质中属于强电解质的是( )
A H2O B CaCl2 C Fe(OH)2 D HBr
(2)下列物质的水溶液中,除水分子外还存在其它分子的是( )
A盐酸 B 醋酸 C 硝酸钾 D 氨水
(3)下列物质中,导电性最差的是( )
A熔融氢氧化钠 B 盐酸溶液
C 氨水溶液 D 固态氯化钾
B D
B D
D
讨 论
多元弱酸是分步电离的,每步各有电离常数,通常用Ka1Ka2Ka3表示.如:H3PO4的电离。
HPO42- H++PO43- Ka3=2.2×10-13
H2PO4- H++HPO42- Ka2=6.2×10-8
H3PO4 H++H2PO4- Ka1=7.5×10-3
从上可看出:Ka1>Ka2>Ka3,Ka1比Ka2约大105倍,Ka2比Ka3约大105倍,多元弱酸的电离主要由第一步决定.几种常见的多元弱酸的电离常数.
H2CO3 K1=4.3×10-7 ,K2=5.6×10-11
H2SO3 K1=1.5×10-3 , K2=1.0×10-8
H2S K1=9.1×10-8 , K2=1.0×10-12
