黑龙江省绥化一高2021-2022学年高一上学期期中考试化学试卷(Word版含答案)
文档属性
| 名称 | 黑龙江省绥化一高2021-2022学年高一上学期期中考试化学试卷(Word版含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 479.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-25 00:00:00 | ||
图片预览



文档简介
绥化一高2021-2022学年度第一学期期中考试
高一化学试题
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 K 39 Mg 24 Al 27 Si 28 S 32 Cl 35.5 Ca 40 Cu 64 Fe 56 Ag 108 Ba 137 Zn 65 Pb 207
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷共60分,第Ⅱ卷共40分,满分100分,考试时间为90分钟。
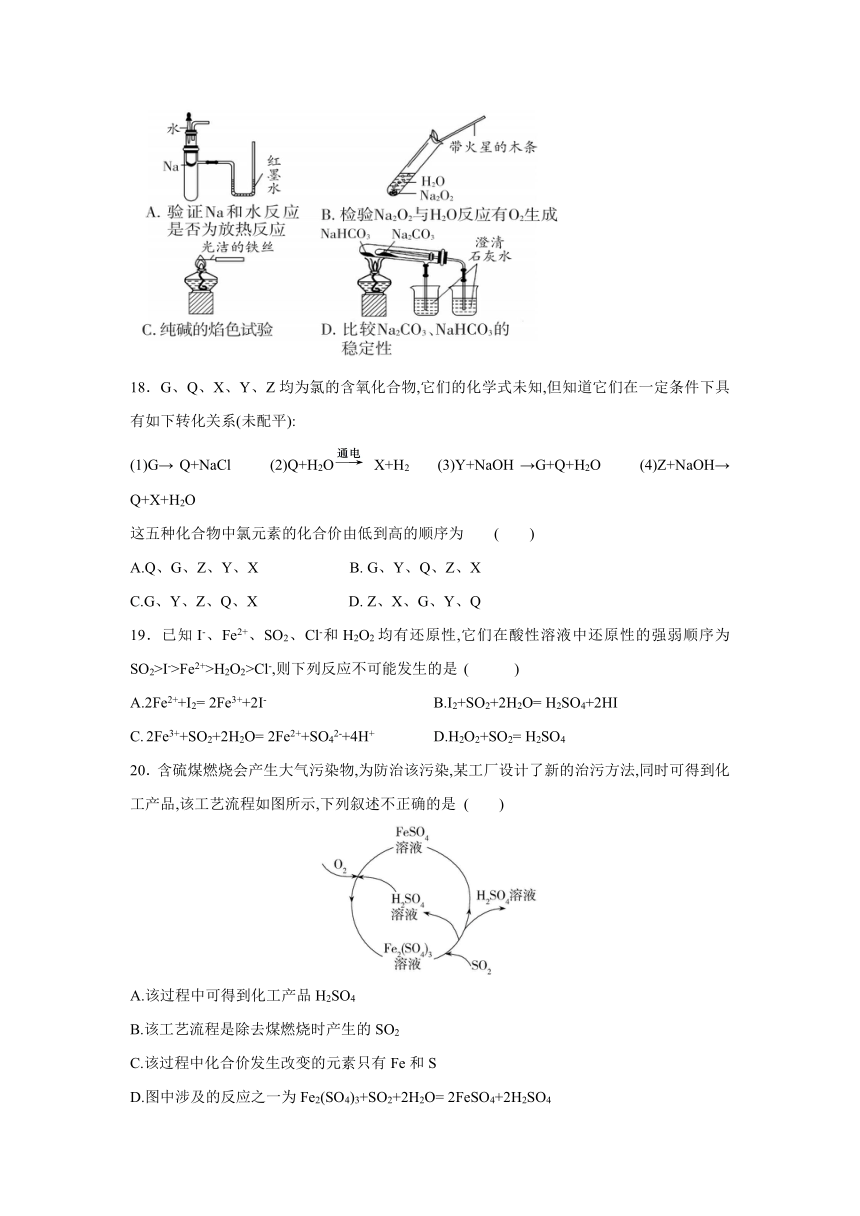
第Ⅰ卷 选择题(60分)
一.选择题(本题共25小题,1-15每小题2分,16-25每小题3分,共60分。在每小题给出的四个选项中,只有一个选项是符合题目要求)
1.物质的分类如下图所示:
由图判断下列说法中正确的是 ( )
A.甲图所示的分类方法属于交叉分类法 B.乙图所示的分类方法属于树状分类法
C.碱性氧化物一定是金属氧化物 D.非金属氧化物一定是酸性氧化物
2.纳米材料是指研究、开发出的直径从几纳米至几十纳米的“材料粒子”,若将“材料粒子”分散到水中,对所得混合物叙述正确的是 ( )
A.不能产生丁达尔效应 B.能透过滤纸 C.一定是胶状的 D.可以看见“材料粒子”
3.某物质灼烧焰色为黄色,下列判断正确的是 ( )
A.该物质一定是钠的化合物 B.该物质一定含钠离子
C.该物质一定是金属钠 D.不能确定该物质是否含钾元素
4.钠与水反应的现象和钠的下列性质无关的是 ( )
A.钠的硬度小 B.钠的密度小 C.钠的熔点低 D.钠的强还原性
5.下列变化中,需加入适当的还原剂才能完成的是 ( )
A.KI→I2 B.FeCl2→FeCl3 C.CuO→Cu D.CO2→Na2CO3
6.能用H++OH-= H2O来表示的化学反应是 ( )
A.Mg(OH)2和稀盐酸反应 B.NaOH溶液和稀盐酸反应
C.CuO和稀硫酸反应 D.Cu(OH)2和稀硫酸反应
7.如图为NaCl在水中溶解和电离的示意图,下列关于该图的说法中错误的是 ( )
A.在NaCl晶体中,Na+和Cl-的排列整齐有序 B.Na+、Cl-在水中是以水合离子的形式存在的
C.水合离子中水分子取向都应该是氧原子朝内 D.上述过程通常可表示为NaCl= Na++Cl-
8.下列各选项中,不能通过一步反应实现如图所示转化关系的是 ( )
A.X为铜、Y为氧化铜、Z为硫酸铜 B.X为二氧化碳、Y为氧气、Z为一氧化碳
C.X为碳酸钙、Y为氧化钙、Z为氢氧化钙 D.X为氢氧化钠、Y为氯化钠、Z为碳酸钠
9.氢化钙(CaH2中氢元素为-1价)可以作为生氢剂,反应的化学方程式为CaH2+2H2O= Ca(OH)2+2H2↑,其中水的作用是 ( )
A.既不是氧化剂也不是还原剂 B.是还原剂
C.是氧化剂 D.既是氧化剂又是还原剂
10.下列离子能大量共存的是 ( )
A.使无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32-
B.无色透明的溶液中:Cu2+、K+、SO42-、NO3-
C.含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl-
D.使紫色石蕊试液呈红色的溶液中:Ca2+、K+、HCO3-、NO3-
11.下列电离方程式书写正确的是 ( )
A.把FeCl3放入水中:FeCl3= Fe3++Cl3- B.把NaCl放入水中:NaCl=Na++Cl-
C.把CaO放入水中:CaO= Ca2++O2- D.加热NaHSO4至熔融:NaHSO4(熔融)= Na++H++SO42-
12.下列反应的离子方程式书写正确的是 ( )
A.碳酸镁和盐酸反应的离子方程式:CO32-+2H+= CO2↑+H2O
B.制备氢氧化铁胶体的离子方程式:Fe3++3H2O Fe(OH)3(胶体)+3H+
C.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-= BaSO4↓+H2O
D.少量的NaHCO3与Ca(OH)2溶液反应:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
13.下列化学反应中溴元素仅被氧化的是 ( )
A.2NaBr+Cl2= 2NaCl+Br2 B.Br2+2NaI= 2NaBr+I2
C.3Br2+6NaOH 5NaBr+NaBrO3+3H2O D.HBr+NaOH= NaBr+H2O
14.鉴别K2CO3和NaHCO3两种白色固体的下列方案中,不可行的是 ( )
A.分别配成溶液,进行焰色反应,观察火焰的颜色
B.分别在试管中加热,将可能产生的气体通入澄清石灰水,观察有无浑浊出现
C.分别配成稀溶液,再逐滴加入盐酸,立即产生气泡的是NaHCO3
D.分别配成稀溶液,滴加Ba(OH)2溶液,观察有无白色沉淀产生
15.下列有关Na2O2的说法不正确的是 ( )
A.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2与H2O反应放热且有氧气生成
B.Na2O2与CO2反应时有单质O2生成,该反应属于置换反应
C.Na2O2在空气中久置变白,最终产物为Na2CO3
D.将Na2O2粉末加入Ca(HCO3)2溶液中,会产生气体和浑浊
16.某溶液中只含有表中所示的四种离子(忽略水的电离),则b可能为 ( )
离子 K+ Mg2+ Cl- SO42-
数目 3a 2a a b
A.2a B.3a C.4a D.5a
17.下列实验装置不能达到实验目的的是 ( )
18.G、Q、X、Y、Z均为氯的含氧化合物,它们的化学式未知,但知道它们在一定条件下具有如下转化关系(未配平):
(1)G→ Q+NaCl (2)Q+H2O X+H2 (3)Y+NaOH →G+Q+H2O (4)Z+NaOH→ Q+X+H2O
这五种化合物中氯元素的化合价由低到高的顺序为 ( )
A.Q、G、Z、Y、X B. G、Y、Q、Z、X
C.G、Y、Z、Q、X D. Z、X、G、Y、Q
19.已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是 ( )
A.2Fe2++I2= 2Fe3++2I- B.I2+SO2+2H2O= H2SO4+2HI
C. 2Fe3++SO2+2H2O= 2Fe2++SO42-+4H+ D.H2O2+SO2= H2SO4
20.含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是 ( )
A.该过程中可得到化工产品H2SO4
B.该工艺流程是除去煤燃烧时产生的SO2
C.该过程中化合价发生改变的元素只有Fe和S
D.图中涉及的反应之一为Fe2(SO4)3+SO2+2H2O= 2FeSO4+2H2SO4
21.某地区的雾霾中可能含有Na+、Ba2+、Mg2+、Fe3+、SO42-、Cl-、CO32-、HCO3-等离子。某同学收集雾霾样品,经必要的预处理配成试样溶液,设计如下实验探究其中含有的离子。
①取一定体积的溶液,加入足量BaCl2溶液,产生白色沉淀,继续滴加足量盐酸,沉淀不溶解,同时得到无色气体。
②另取一定体积的溶液,加入足量NaOH溶液,产生白色沉淀,继续滴加足量稀盐酸,沉淀全部溶解。
下列判断错误的是 ( )
A.一定不存在Ba2+、Fe3+、Cl- B.一定不含CO32-
C.肯定含有Mg2+、SO42- 、HCO3- D.操作①中产生的无色气体为CO2
22.已知反应(1)、(2)分别是从海藻灰和智利硝石中提取碘的主要反应:
(1)2NaI+MnO2+3H2SO4 = 2NaHSO4+MnSO4+2H2O+I2
(2)2NaIO3+5NaHSO3 = 2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是 ( )
A.两个反应中NaHSO4均为氧化产物
B.I2在反应(1)中是还原产物,在反应(2)中是氧化产物
C.氧化性:MnO2 > SO42- > IO3- > I2
D.反应(1)、(2)中生成等量的I2时转移电子数之比为1∶5
23.在反应5NH4NO3 2HNO3+4N2↑+9H2O中,发生氧化反应与发生还原反应的氮原子个数之比是 ( )
A.3:5 B.5:8 C.5:3 D.5:4
24.在一个氧化还原反应体系中,反应物、生成物共有六种粒子:Fe3+、NO3-、Fe2+、NH4+、H+、H2O
已知氧化性NO3-(H+)>Fe3+。下列叙述不正确的是 ( )
A.该反应说明Fe(NO3)2溶液不宜加酸酸化
B.该反应中氧化剂与还原剂的个数之比为8∶1
C.若有1个NO3-参与反应,则转移8个电子
D.该反应中Fe2+是还原剂,NH4+是还原产物
25.某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,其中ClO-与ClO3-的个数比为11∶1,则Cl2与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为 ( )
A.4∶3 B.1∶3 C.2∶1 D.3∶1
第Ⅱ卷 非选择题(40分)
26.(14分)A、B、C、D、E五种物质的焰色反应都显黄色,A、B与水反应都有气体放出,A与水的反应放出的气体具有还原性,同时都生成溶液C,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能变成D。
(1)写出A~E的化学式: A_________、B__________、C_________、D__________、E_________。
(2)E加热生成D的化学方程式是:___________________________。
(3)C溶液和CO2反应生成D的离子方程式:____________________________。
(4) E在水溶液里的电离方程式为: 。
(5)少量的E溶液与澄清石灰水反应的化学方程式为: 。
(6)8g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的B固体,固体增加的质量为 g。
27.(9分)某小组以Ba(OH)2、水、H2SO4、Na2SO4为实验对象探究离子反应发生的条件。
实验1:向烧杯中依次加入下列试剂,记录灯泡变化
①Ba(OH)2粉末:灯泡不亮②加入蒸馏水:灯泡变亮③逐滴滴加0.1 mol/L H2SO4溶液,灯泡变化如下:亮
(1)Ba(OH)2与H2SO4在溶液中能发生 反应。
a.置换 b.酸碱中和 c.复分解
(2)①中灯泡不亮而②中加H2O后灯泡变亮的原因是加水后,Ba(OH)2发生了 。
(3)用离子方程式解释过程Ⅰ中灯泡变暗的原因 。
(4)实验2:用Na2SO4溶液替代H2SO4溶液,重复实验进行对照。加入Na2SO4溶液过程中灯泡不熄灭,原因是 。
通过实验1和2可知:离子反应发生的条件之一是生成沉淀。
(5)在两份完全相同的Ba(OH)2溶液中,分别滴入H2SO4溶液和NaHSO4溶液(说明:等体积溶液含H2SO4和NaHSO4微粒数相同),其导电能力随滴入溶液体积变化的曲线如图所示。
下列分析正确的是 。
A.①代表滴加H2SO4溶液的变化曲线 B.b点溶液中大量存在的离子是Na+、OH-、SO42-
C.c点时,两份溶液中含有相同量的OH- D.a、d两点对应的溶液均显中性
28.(8分)《南村辍耕录》中记载:“杭人削松木为小片,其薄如纸,熔硫磺涂木片顶分许,名曰发烛。”《资治通鉴》中记载:“陈宣帝太建九年,齐后妃贫苦,至以卖烛为业。”文中的“发烛”就是原始的火柴。已知K2Cr2O7用于工业中制造火柴头。
K2Cr2O7+HCl(浓) KCl+CrCl3+Cl2↑+H2O(未配平)
(1) (填元素名称)元素被氧化, (填化学式,下同)是氧化剂, 发生氧化反应。
(2) 参加反应的HCl,表现了 和 。(填“还原性”“氧化性”或“酸性”)
(3)该反应中每生成6个Cl2转移电子个数为 个。
(4)配平上述反应,并用单线桥法表示出该反应中电子转移的方向和数目 。
29.(9分)已知HNO2是一种弱酸,向NaNO2中加入强酸可生成HNO2。HNO2不稳定,易分解成NO和NO2气体。HNO2是一种还原剂,能被常见的强氧化剂氧化,但在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。NaNO2晶体外观和食盐相似,又有咸味,因而容易误食引起中毒。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐如NaNO2,则导致血红蛋白中的Fe2+转化为Fe3+而中毒,可以服用维生素C解毒,维生素C在解毒的过程中表现出 (填“氧化”或“还原”)性。
(2)在酸性条件下HNO2与KI反应,I-被氧化为I2,HNO2被还原为NO气体,写出该反应的离子方程式为 。
(3)N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为 。
(4) 已知NaNO2能发生反应:2NaNO2+4HI = 2NO↑+I2+2NaI+2H2O。鉴别NaNO2和NaCl,可选用的物质有:①KI-淀粉试纸;②水;③淀粉;④白酒;⑤食醋,你认为必须选用的物质有 (填序号)。
(5)某厂废液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂中能使NaNO2转化为不引起二次污染的N2的是 (填字母)。
A. NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(6)请配平以下化学方程式:
Al+ NaNO3+ NaOH = NaAlO2+ N2↑+ H2O
绥化一中2021-2022学年度第一学期期中考试
高一化学答案
(1-15每小题2分,16-25每小题3分,共60分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
C B D A C B C D C A B B A D B
16 17 18 19 20 21 22 23 24 25
B D B A C A D C B A
26.(14分) (1)Na(1分) Na2O2(1分) NaOH (1分) Na2CO3(1分) NaHCO3(1分)
(2)2NaHCO3 Na2CO3 +H2O+CO2↑(2分)
(3)2OH-+CO2 = CO32- +H2O(2分)
(4) NaHCO3 = Na ++HCO3- (2分)
(5)NaHCO3+Ca(OH) 2=CaCO3↓+H2O+NaOH(2分)
(6)8(1分)
27.(9分)(1)bc(2分)(只选一个得1分,有错选没分)
(2)电离(1分) (3)Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O(2分)
(4)溶液中一直存在没有参与反应的Na+和OH-,灯泡不熄灭(2分)
(5)AD(2分)(只选一个得1分,有错选没分)
28.(8分)(1)氯(1分) K2Cr2O7(1分) HCl(1分)
(2)还原性(1分) 酸性(1分)(顺序可颠倒)
(3)12 (1分)
(4) 2KCl+2CrCl3+3Cl2↑+7H2O(2分)
29.(9分) (1)还原(1分) (2)2HNO2+2I-+2H+= 2NO↑+I2+2H2O (2分)
(3)2NH3+2O2 N2O+3H2O(2分)
(4)①⑤(1分)(只选一个没分)
(5)B(1分)
(6)10 6 4 10 3 2(2分)
高一化学试题
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 K 39 Mg 24 Al 27 Si 28 S 32 Cl 35.5 Ca 40 Cu 64 Fe 56 Ag 108 Ba 137 Zn 65 Pb 207
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷共60分,第Ⅱ卷共40分,满分100分,考试时间为90分钟。
第Ⅰ卷 选择题(60分)
一.选择题(本题共25小题,1-15每小题2分,16-25每小题3分,共60分。在每小题给出的四个选项中,只有一个选项是符合题目要求)
1.物质的分类如下图所示:
由图判断下列说法中正确的是 ( )
A.甲图所示的分类方法属于交叉分类法 B.乙图所示的分类方法属于树状分类法
C.碱性氧化物一定是金属氧化物 D.非金属氧化物一定是酸性氧化物
2.纳米材料是指研究、开发出的直径从几纳米至几十纳米的“材料粒子”,若将“材料粒子”分散到水中,对所得混合物叙述正确的是 ( )
A.不能产生丁达尔效应 B.能透过滤纸 C.一定是胶状的 D.可以看见“材料粒子”
3.某物质灼烧焰色为黄色,下列判断正确的是 ( )
A.该物质一定是钠的化合物 B.该物质一定含钠离子
C.该物质一定是金属钠 D.不能确定该物质是否含钾元素
4.钠与水反应的现象和钠的下列性质无关的是 ( )
A.钠的硬度小 B.钠的密度小 C.钠的熔点低 D.钠的强还原性
5.下列变化中,需加入适当的还原剂才能完成的是 ( )
A.KI→I2 B.FeCl2→FeCl3 C.CuO→Cu D.CO2→Na2CO3
6.能用H++OH-= H2O来表示的化学反应是 ( )
A.Mg(OH)2和稀盐酸反应 B.NaOH溶液和稀盐酸反应
C.CuO和稀硫酸反应 D.Cu(OH)2和稀硫酸反应
7.如图为NaCl在水中溶解和电离的示意图,下列关于该图的说法中错误的是 ( )
A.在NaCl晶体中,Na+和Cl-的排列整齐有序 B.Na+、Cl-在水中是以水合离子的形式存在的
C.水合离子中水分子取向都应该是氧原子朝内 D.上述过程通常可表示为NaCl= Na++Cl-
8.下列各选项中,不能通过一步反应实现如图所示转化关系的是 ( )
A.X为铜、Y为氧化铜、Z为硫酸铜 B.X为二氧化碳、Y为氧气、Z为一氧化碳
C.X为碳酸钙、Y为氧化钙、Z为氢氧化钙 D.X为氢氧化钠、Y为氯化钠、Z为碳酸钠
9.氢化钙(CaH2中氢元素为-1价)可以作为生氢剂,反应的化学方程式为CaH2+2H2O= Ca(OH)2+2H2↑,其中水的作用是 ( )
A.既不是氧化剂也不是还原剂 B.是还原剂
C.是氧化剂 D.既是氧化剂又是还原剂
10.下列离子能大量共存的是 ( )
A.使无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32-
B.无色透明的溶液中:Cu2+、K+、SO42-、NO3-
C.含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl-
D.使紫色石蕊试液呈红色的溶液中:Ca2+、K+、HCO3-、NO3-
11.下列电离方程式书写正确的是 ( )
A.把FeCl3放入水中:FeCl3= Fe3++Cl3- B.把NaCl放入水中:NaCl=Na++Cl-
C.把CaO放入水中:CaO= Ca2++O2- D.加热NaHSO4至熔融:NaHSO4(熔融)= Na++H++SO42-
12.下列反应的离子方程式书写正确的是 ( )
A.碳酸镁和盐酸反应的离子方程式:CO32-+2H+= CO2↑+H2O
B.制备氢氧化铁胶体的离子方程式:Fe3++3H2O Fe(OH)3(胶体)+3H+
C.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-= BaSO4↓+H2O
D.少量的NaHCO3与Ca(OH)2溶液反应:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
13.下列化学反应中溴元素仅被氧化的是 ( )
A.2NaBr+Cl2= 2NaCl+Br2 B.Br2+2NaI= 2NaBr+I2
C.3Br2+6NaOH 5NaBr+NaBrO3+3H2O D.HBr+NaOH= NaBr+H2O
14.鉴别K2CO3和NaHCO3两种白色固体的下列方案中,不可行的是 ( )
A.分别配成溶液,进行焰色反应,观察火焰的颜色
B.分别在试管中加热,将可能产生的气体通入澄清石灰水,观察有无浑浊出现
C.分别配成稀溶液,再逐滴加入盐酸,立即产生气泡的是NaHCO3
D.分别配成稀溶液,滴加Ba(OH)2溶液,观察有无白色沉淀产生
15.下列有关Na2O2的说法不正确的是 ( )
A.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2与H2O反应放热且有氧气生成
B.Na2O2与CO2反应时有单质O2生成,该反应属于置换反应
C.Na2O2在空气中久置变白,最终产物为Na2CO3
D.将Na2O2粉末加入Ca(HCO3)2溶液中,会产生气体和浑浊
16.某溶液中只含有表中所示的四种离子(忽略水的电离),则b可能为 ( )
离子 K+ Mg2+ Cl- SO42-
数目 3a 2a a b
A.2a B.3a C.4a D.5a
17.下列实验装置不能达到实验目的的是 ( )
18.G、Q、X、Y、Z均为氯的含氧化合物,它们的化学式未知,但知道它们在一定条件下具有如下转化关系(未配平):
(1)G→ Q+NaCl (2)Q+H2O X+H2 (3)Y+NaOH →G+Q+H2O (4)Z+NaOH→ Q+X+H2O
这五种化合物中氯元素的化合价由低到高的顺序为 ( )
A.Q、G、Z、Y、X B. G、Y、Q、Z、X
C.G、Y、Z、Q、X D. Z、X、G、Y、Q
19.已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是 ( )
A.2Fe2++I2= 2Fe3++2I- B.I2+SO2+2H2O= H2SO4+2HI
C. 2Fe3++SO2+2H2O= 2Fe2++SO42-+4H+ D.H2O2+SO2= H2SO4
20.含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是 ( )
A.该过程中可得到化工产品H2SO4
B.该工艺流程是除去煤燃烧时产生的SO2
C.该过程中化合价发生改变的元素只有Fe和S
D.图中涉及的反应之一为Fe2(SO4)3+SO2+2H2O= 2FeSO4+2H2SO4
21.某地区的雾霾中可能含有Na+、Ba2+、Mg2+、Fe3+、SO42-、Cl-、CO32-、HCO3-等离子。某同学收集雾霾样品,经必要的预处理配成试样溶液,设计如下实验探究其中含有的离子。
①取一定体积的溶液,加入足量BaCl2溶液,产生白色沉淀,继续滴加足量盐酸,沉淀不溶解,同时得到无色气体。
②另取一定体积的溶液,加入足量NaOH溶液,产生白色沉淀,继续滴加足量稀盐酸,沉淀全部溶解。
下列判断错误的是 ( )
A.一定不存在Ba2+、Fe3+、Cl- B.一定不含CO32-
C.肯定含有Mg2+、SO42- 、HCO3- D.操作①中产生的无色气体为CO2
22.已知反应(1)、(2)分别是从海藻灰和智利硝石中提取碘的主要反应:
(1)2NaI+MnO2+3H2SO4 = 2NaHSO4+MnSO4+2H2O+I2
(2)2NaIO3+5NaHSO3 = 2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是 ( )
A.两个反应中NaHSO4均为氧化产物
B.I2在反应(1)中是还原产物,在反应(2)中是氧化产物
C.氧化性:MnO2 > SO42- > IO3- > I2
D.反应(1)、(2)中生成等量的I2时转移电子数之比为1∶5
23.在反应5NH4NO3 2HNO3+4N2↑+9H2O中,发生氧化反应与发生还原反应的氮原子个数之比是 ( )
A.3:5 B.5:8 C.5:3 D.5:4
24.在一个氧化还原反应体系中,反应物、生成物共有六种粒子:Fe3+、NO3-、Fe2+、NH4+、H+、H2O
已知氧化性NO3-(H+)>Fe3+。下列叙述不正确的是 ( )
A.该反应说明Fe(NO3)2溶液不宜加酸酸化
B.该反应中氧化剂与还原剂的个数之比为8∶1
C.若有1个NO3-参与反应,则转移8个电子
D.该反应中Fe2+是还原剂,NH4+是还原产物
25.某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,其中ClO-与ClO3-的个数比为11∶1,则Cl2与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为 ( )
A.4∶3 B.1∶3 C.2∶1 D.3∶1
第Ⅱ卷 非选择题(40分)
26.(14分)A、B、C、D、E五种物质的焰色反应都显黄色,A、B与水反应都有气体放出,A与水的反应放出的气体具有还原性,同时都生成溶液C,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能变成D。
(1)写出A~E的化学式: A_________、B__________、C_________、D__________、E_________。
(2)E加热生成D的化学方程式是:___________________________。
(3)C溶液和CO2反应生成D的离子方程式:____________________________。
(4) E在水溶液里的电离方程式为: 。
(5)少量的E溶液与澄清石灰水反应的化学方程式为: 。
(6)8g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的B固体,固体增加的质量为 g。
27.(9分)某小组以Ba(OH)2、水、H2SO4、Na2SO4为实验对象探究离子反应发生的条件。
实验1:向烧杯中依次加入下列试剂,记录灯泡变化
①Ba(OH)2粉末:灯泡不亮②加入蒸馏水:灯泡变亮③逐滴滴加0.1 mol/L H2SO4溶液,灯泡变化如下:亮
(1)Ba(OH)2与H2SO4在溶液中能发生 反应。
a.置换 b.酸碱中和 c.复分解
(2)①中灯泡不亮而②中加H2O后灯泡变亮的原因是加水后,Ba(OH)2发生了 。
(3)用离子方程式解释过程Ⅰ中灯泡变暗的原因 。
(4)实验2:用Na2SO4溶液替代H2SO4溶液,重复实验进行对照。加入Na2SO4溶液过程中灯泡不熄灭,原因是 。
通过实验1和2可知:离子反应发生的条件之一是生成沉淀。
(5)在两份完全相同的Ba(OH)2溶液中,分别滴入H2SO4溶液和NaHSO4溶液(说明:等体积溶液含H2SO4和NaHSO4微粒数相同),其导电能力随滴入溶液体积变化的曲线如图所示。
下列分析正确的是 。
A.①代表滴加H2SO4溶液的变化曲线 B.b点溶液中大量存在的离子是Na+、OH-、SO42-
C.c点时,两份溶液中含有相同量的OH- D.a、d两点对应的溶液均显中性
28.(8分)《南村辍耕录》中记载:“杭人削松木为小片,其薄如纸,熔硫磺涂木片顶分许,名曰发烛。”《资治通鉴》中记载:“陈宣帝太建九年,齐后妃贫苦,至以卖烛为业。”文中的“发烛”就是原始的火柴。已知K2Cr2O7用于工业中制造火柴头。
K2Cr2O7+HCl(浓) KCl+CrCl3+Cl2↑+H2O(未配平)
(1) (填元素名称)元素被氧化, (填化学式,下同)是氧化剂, 发生氧化反应。
(2) 参加反应的HCl,表现了 和 。(填“还原性”“氧化性”或“酸性”)
(3)该反应中每生成6个Cl2转移电子个数为 个。
(4)配平上述反应,并用单线桥法表示出该反应中电子转移的方向和数目 。
29.(9分)已知HNO2是一种弱酸,向NaNO2中加入强酸可生成HNO2。HNO2不稳定,易分解成NO和NO2气体。HNO2是一种还原剂,能被常见的强氧化剂氧化,但在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。NaNO2晶体外观和食盐相似,又有咸味,因而容易误食引起中毒。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐如NaNO2,则导致血红蛋白中的Fe2+转化为Fe3+而中毒,可以服用维生素C解毒,维生素C在解毒的过程中表现出 (填“氧化”或“还原”)性。
(2)在酸性条件下HNO2与KI反应,I-被氧化为I2,HNO2被还原为NO气体,写出该反应的离子方程式为 。
(3)N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为 。
(4) 已知NaNO2能发生反应:2NaNO2+4HI = 2NO↑+I2+2NaI+2H2O。鉴别NaNO2和NaCl,可选用的物质有:①KI-淀粉试纸;②水;③淀粉;④白酒;⑤食醋,你认为必须选用的物质有 (填序号)。
(5)某厂废液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂中能使NaNO2转化为不引起二次污染的N2的是 (填字母)。
A. NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(6)请配平以下化学方程式:
Al+ NaNO3+ NaOH = NaAlO2+ N2↑+ H2O
绥化一中2021-2022学年度第一学期期中考试
高一化学答案
(1-15每小题2分,16-25每小题3分,共60分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
C B D A C B C D C A B B A D B
16 17 18 19 20 21 22 23 24 25
B D B A C A D C B A
26.(14分) (1)Na(1分) Na2O2(1分) NaOH (1分) Na2CO3(1分) NaHCO3(1分)
(2)2NaHCO3 Na2CO3 +H2O+CO2↑(2分)
(3)2OH-+CO2 = CO32- +H2O(2分)
(4) NaHCO3 = Na ++HCO3- (2分)
(5)NaHCO3+Ca(OH) 2=CaCO3↓+H2O+NaOH(2分)
(6)8(1分)
27.(9分)(1)bc(2分)(只选一个得1分,有错选没分)
(2)电离(1分) (3)Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O(2分)
(4)溶液中一直存在没有参与反应的Na+和OH-,灯泡不熄灭(2分)
(5)AD(2分)(只选一个得1分,有错选没分)
28.(8分)(1)氯(1分) K2Cr2O7(1分) HCl(1分)
(2)还原性(1分) 酸性(1分)(顺序可颠倒)
(3)12 (1分)
(4) 2KCl+2CrCl3+3Cl2↑+7H2O(2分)
29.(9分) (1)还原(1分) (2)2HNO2+2I-+2H+= 2NO↑+I2+2H2O (2分)
(3)2NH3+2O2 N2O+3H2O(2分)
(4)①⑤(1分)(只选一个没分)
(5)B(1分)
(6)10 6 4 10 3 2(2分)
同课章节目录
