2020-2021学年高二化学人教版(2019)选择性必修2同步备课系列1.1.2 构造原理与电子排布式 电子云与原子轨道(23张ppt)
文档属性
| 名称 | 2020-2021学年高二化学人教版(2019)选择性必修2同步备课系列1.1.2 构造原理与电子排布式 电子云与原子轨道(23张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-28 00:00:00 | ||
图片预览




文档简介
(共23张PPT)
第一章 原子结构与性质
第一节 原子结构
第二课时
一、构造原理与电子排布式
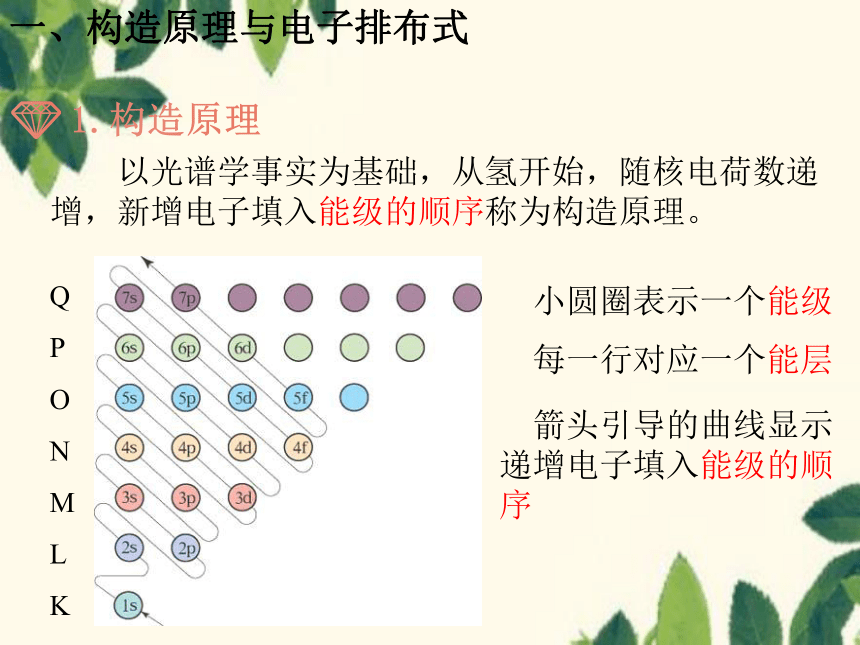
1.构造原理
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
Q
P
O
N
M
L
K
小圆圈表示一个能级
每一行对应一个能层
箭头引导的曲线显示递增电子填入能级的顺序
一、构造原理与电子排布式
按照构造原理,元素的核电荷数每递增一个,同时增加一个核电荷和一个核外电子,就得到一个基态原子的电子排布。
2.电子排布式
电子填满了一个能级,就开始填入下一个能级,由此构建了元素周期表中各元素的基态原子的电子排布。
例如,从氢到碳的基态原子电子排布式为:
1s1→1s2→1s22s1→1s22s2→1s22s22p1→1s22s22p2
氢 氦 锂 铍 硼 碳
一、构造原理与电子排布式
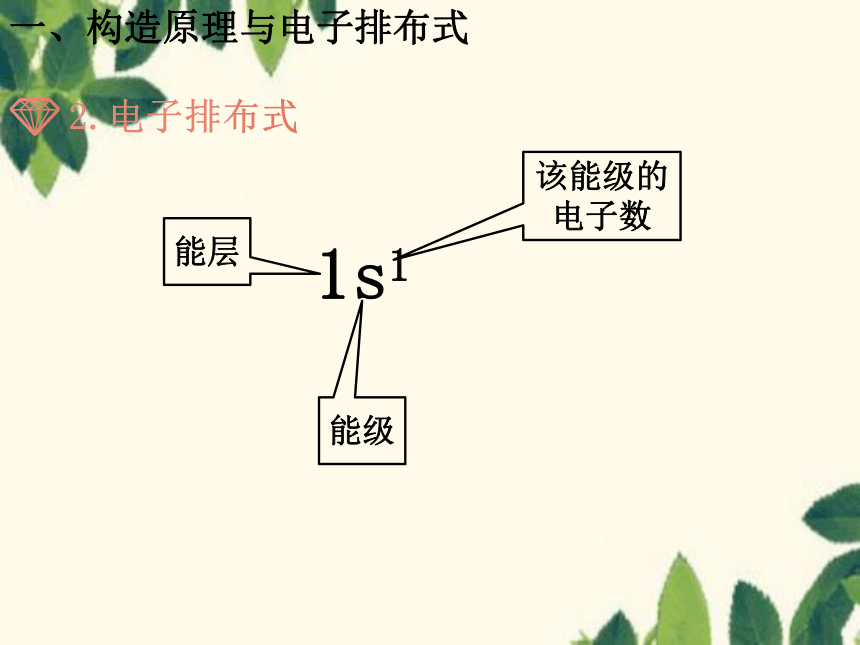
2.电子排布式
1s1
该能级的电子数
能层
能级
一、构造原理与电子排布式
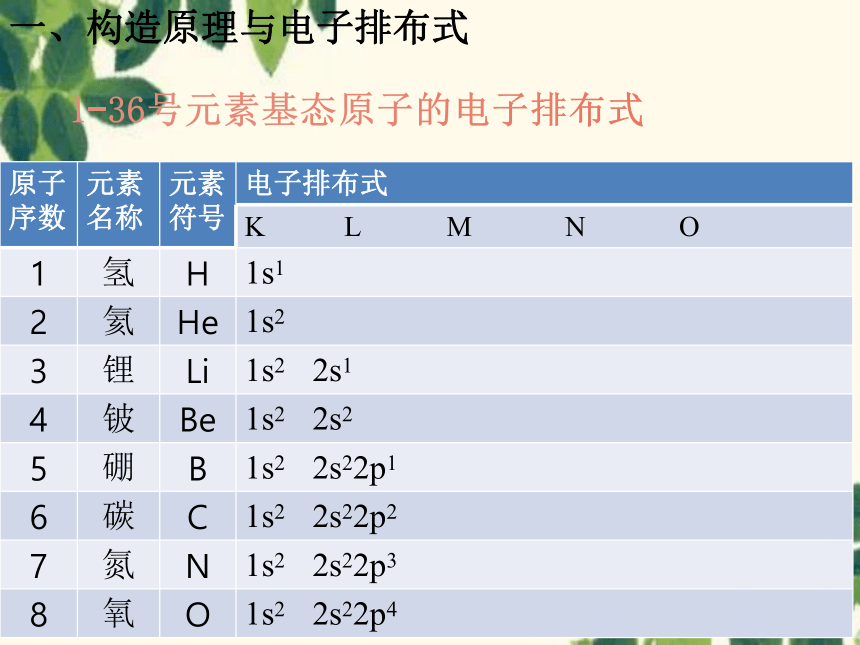
1-36号元素基态原子的电子排布式
原子序数 元素名称 元素符号 电子排布式
K L M N O
1 氢 H 1s1
2 氦 He 1s2
3 锂 Li 1s2 2s1
4 铍 Be 1s2 2s2
5 硼 B 1s2 2s22p1
6 碳 C 1s2 2s22p2
7 氮 N 1s2 2s22p3
8 氧 O 1s2 2s22p4
一、构造原理与电子排布式
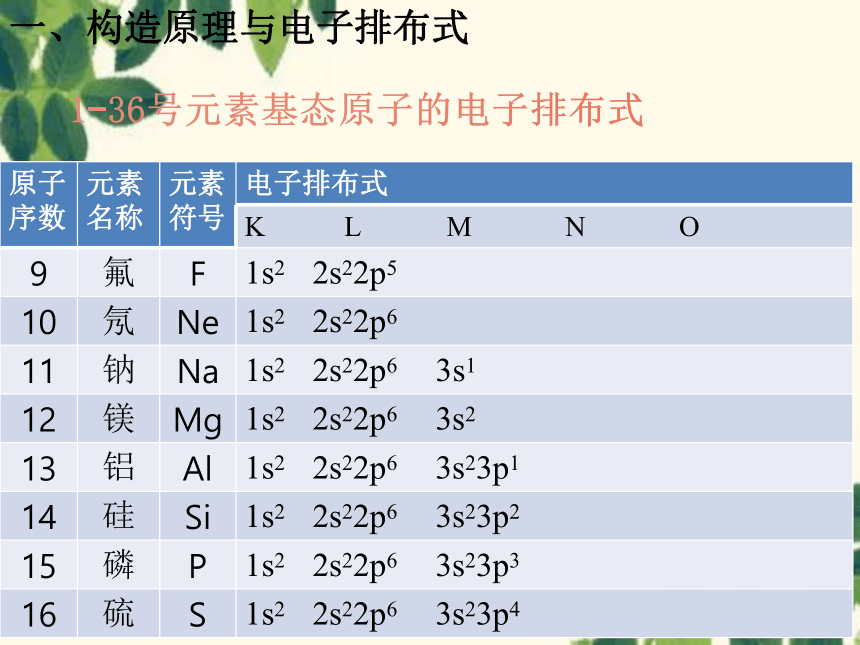
1-36号元素基态原子的电子排布式
原子序数 元素名称 元素符号 电子排布式
K L M N O
9 氟 F 1s2 2s22p5
10 氖 Ne 1s2 2s22p6
11 钠 Na 1s2 2s22p6 3s1
12 镁 Mg 1s2 2s22p6 3s2
13 铝 Al 1s2 2s22p6 3s23p1
14 硅 Si 1s2 2s22p6 3s23p2
15 磷 P 1s2 2s22p6 3s23p3
16 硫 S 1s2 2s22p6 3s23p4
一、构造原理与电子排布式
1-36号元素基态原子的电子排布式
原子序数 元素名称 元素符号 电子排布式
K L M N O
17 氯 Cl
18 氩 Ar
19 钾 K
20 钙 Ca
21 钪 Sc
22 钛 Ti
4s1
4s2
4s2
3d1
1s2 2s22p6 3s23p5
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
3d2 4s2
能级交错现象
一、构造原理与电子排布式
④不同层不同能级能量由低到高顺序 :
1s 2s 2p3s 3p4s 3d4p5s 4d5p6s 4f5d6p7s 5f6d7p……
①相同能层的不同能级的能量高低顺序 :ns②英文字母相同的不同能级的能量高低顺序:
1s<2s<3s<4s;2p<3p<4p; 3d<4d
③不同层不同能级可由下面的公式得出:
ns < (n-2)f < (n-1)d < np (n为能层序数)
称为能级交错现象
各能级的能量高低顺序
构造理论呈现的能级交错源于光谱学事实
构造理论是一个思维模型,是个假想过程
一、构造原理与电子排布式
1-36号元素基态原子的电子排布式
原子序数 元素名称 元素符号 电子排布式
K L M N O
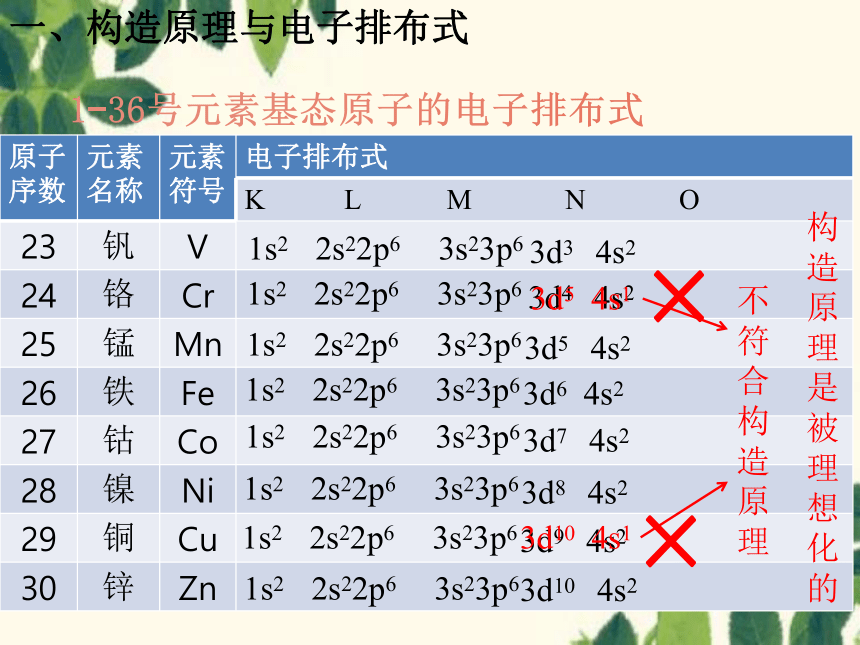
23 钒 V
24 铬 Cr
25 锰 Mn
26 铁 Fe
27 钴 Co
28 镍 Ni
29 铜 Cu
30 锌 Zn
1s2 2s22p6 3s23p6
3d3 4s2
1s2 2s22p6 3s23p6
3d4 4s2
×
3d5 4s1
1s2 2s22p6 3s23p6
3d5 4s2
1s2 2s22p6 3s23p6
3d6 4s2
1s2 2s22p6 3s23p6
3d7 4s2
1s2 2s22p6 3s23p6
3d8 4s2
1s2 2s22p6 3s23p6
3d9 4s2
×
3d10 4s1
1s2 2s22p6 3s23p6
3d10 4s2
不符合构造原理
构造原理是被理想化的
一、构造原理与电子排布式
1-36号元素基态原子的电子排布式
原子序数 元素名称 元素符号 电子排布式
K L M N O
31 镓 Ga
32 锗 Ge
33 砷 As
34 硒 Se
35 溴 Br
36 氩 Ar
1s2 2s22p6 3s23p6
3d10 4s2
4p1
1s2 2s22p6 3s23p6
3d10 4s2
4p2
1s2 2s22p6 3s23p6
3d10 4s2
4p3
1s2 2s22p6 3s23p6
3d10 4s2
4p4
1s2 2s22p6 3s23p6
3d10 4s2
4p5
1s2 2s22p6 3s23p6
3d10 4s2
4p6
一、构造原理与电子排布式
如:钠的电子排布式可简化为[Ne]3s1
上式方括号里的符号的意义是:
表示内层电子已达到稀有气体结构的部分
3.简化电子排布式
电子排布式可以简化
写出第8号元素氧、第14号元素硅和第29号元素铜的简化电子排布式吗?
Cu:[Ar]3d104s1
O:[He]2s22p4
Si:[Ne]3s23p2
一、构造原理与电子排布式
4.价层电子排布式
为突出化合价与电子排布的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)
如:铁的简化电子排布式为[Ar]3d64s2
铁的价层电子排布式为3d64s2
Na:3s1
查看元素周期表找出Na、Al、Cl、Mn、Br价层电子排布式
Al:3s2 3p1
Cl:3s2 3p5
Mn:3d5 4s2
Br:4s24p5
二、电子云与原子轨道
1.概率密度
1913年,波尔提出氢原子模型,电子在线性轨道上绕核运行
量子力学指出,一定空间运动状态的电子并不在玻尔假定的线性轨道上运行,而在核外空间各处都可能出现,但出现的概率不同,可以算出它们的概率密度分布。
P表示电子在某处出现的概率
V表示该处的体积
概率密度:ρ=
二、电子云与原子轨道
氢原子的1s电子在原子核外出现的概率分布图
小点是1s电子在原子核外出现外出现的概率密度的形象描述
小点越密,表明概率密度越大
二、电子云与原子轨道
由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称为电子云
2.电子云
电子云是处于一定空间运动状态的电子在原子核外空间的概率分布的形象化描述。
电子云图很难绘制,使用不便,我们常使用电子云轮廓图
电子云轮廓图的绘制过程
二、电子云与原子轨道
绘制电子云轮廓图的目的是表示 的形状,对核外电子的 有一个形象化的简便描述。绘制电子云轮廓图时,把电子在原子核外空间出现概率P= 的空间圈出来。
电子云轮廓
空间运动状态
90%
3.电子云轮廓图
二、电子云与原子轨道
(1)所有原子的任一能层 的s电子的电子云轮廓图都是一个球形 只是球的半径不同
同一原子的能层越高,s电子云半径越大
原因:由于电子能量依次增高,电子在离核更远的区域出现的概率增大,电子云越来越向更大的空间扩展
二、电子云与原子轨道
(2)p电子云的形状是哑铃状的,
有3个互向垂直电子云分别称为Px、Py、Pz
右下角x、y、z分别是p电子云在直角坐标系里的取向
二、电子云与原子轨道
二、电子云与原子轨道
二、电子云与原子轨道
4.原子轨道
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
ns能级各有 个轨道,np能级各有 个轨道,
nd能级各有 个轨道,nf能级各有 个轨道。
1
5
7
3
能层数 K L M N O P Q n
能级数 1 2 3 4 5 6 7
轨道数 1 4 9 16 25 36 49
n
n2
课后作业
THANK YOU
Asadal has been running one of the biggest domain and web hosting sites in Korea since March 1998. More than 3,000,000 people have.visited our website, www. for domain registration and web hosting
第一章 原子结构与性质
第一节 原子结构
第二课时
一、构造原理与电子排布式
1.构造原理
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
Q
P
O
N
M
L
K
小圆圈表示一个能级
每一行对应一个能层
箭头引导的曲线显示递增电子填入能级的顺序
一、构造原理与电子排布式
按照构造原理,元素的核电荷数每递增一个,同时增加一个核电荷和一个核外电子,就得到一个基态原子的电子排布。
2.电子排布式
电子填满了一个能级,就开始填入下一个能级,由此构建了元素周期表中各元素的基态原子的电子排布。
例如,从氢到碳的基态原子电子排布式为:
1s1→1s2→1s22s1→1s22s2→1s22s22p1→1s22s22p2
氢 氦 锂 铍 硼 碳
一、构造原理与电子排布式
2.电子排布式
1s1
该能级的电子数
能层
能级
一、构造原理与电子排布式
1-36号元素基态原子的电子排布式
原子序数 元素名称 元素符号 电子排布式
K L M N O
1 氢 H 1s1
2 氦 He 1s2
3 锂 Li 1s2 2s1
4 铍 Be 1s2 2s2
5 硼 B 1s2 2s22p1
6 碳 C 1s2 2s22p2
7 氮 N 1s2 2s22p3
8 氧 O 1s2 2s22p4
一、构造原理与电子排布式
1-36号元素基态原子的电子排布式
原子序数 元素名称 元素符号 电子排布式
K L M N O
9 氟 F 1s2 2s22p5
10 氖 Ne 1s2 2s22p6
11 钠 Na 1s2 2s22p6 3s1
12 镁 Mg 1s2 2s22p6 3s2
13 铝 Al 1s2 2s22p6 3s23p1
14 硅 Si 1s2 2s22p6 3s23p2
15 磷 P 1s2 2s22p6 3s23p3
16 硫 S 1s2 2s22p6 3s23p4
一、构造原理与电子排布式
1-36号元素基态原子的电子排布式
原子序数 元素名称 元素符号 电子排布式
K L M N O
17 氯 Cl
18 氩 Ar
19 钾 K
20 钙 Ca
21 钪 Sc
22 钛 Ti
4s1
4s2
4s2
3d1
1s2 2s22p6 3s23p5
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
3d2 4s2
能级交错现象
一、构造原理与电子排布式
④不同层不同能级能量由低到高顺序 :
1s 2s 2p3s 3p4s 3d4p5s 4d5p6s 4f5d6p7s 5f6d7p……
①相同能层的不同能级的能量高低顺序 :ns
1s<2s<3s<4s;2p<3p<4p; 3d<4d
③不同层不同能级可由下面的公式得出:
ns < (n-2)f < (n-1)d < np (n为能层序数)
称为能级交错现象
各能级的能量高低顺序
构造理论呈现的能级交错源于光谱学事实
构造理论是一个思维模型,是个假想过程
一、构造原理与电子排布式
1-36号元素基态原子的电子排布式
原子序数 元素名称 元素符号 电子排布式
K L M N O
23 钒 V
24 铬 Cr
25 锰 Mn
26 铁 Fe
27 钴 Co
28 镍 Ni
29 铜 Cu
30 锌 Zn
1s2 2s22p6 3s23p6
3d3 4s2
1s2 2s22p6 3s23p6
3d4 4s2
×
3d5 4s1
1s2 2s22p6 3s23p6
3d5 4s2
1s2 2s22p6 3s23p6
3d6 4s2
1s2 2s22p6 3s23p6
3d7 4s2
1s2 2s22p6 3s23p6
3d8 4s2
1s2 2s22p6 3s23p6
3d9 4s2
×
3d10 4s1
1s2 2s22p6 3s23p6
3d10 4s2
不符合构造原理
构造原理是被理想化的
一、构造原理与电子排布式
1-36号元素基态原子的电子排布式
原子序数 元素名称 元素符号 电子排布式
K L M N O
31 镓 Ga
32 锗 Ge
33 砷 As
34 硒 Se
35 溴 Br
36 氩 Ar
1s2 2s22p6 3s23p6
3d10 4s2
4p1
1s2 2s22p6 3s23p6
3d10 4s2
4p2
1s2 2s22p6 3s23p6
3d10 4s2
4p3
1s2 2s22p6 3s23p6
3d10 4s2
4p4
1s2 2s22p6 3s23p6
3d10 4s2
4p5
1s2 2s22p6 3s23p6
3d10 4s2
4p6
一、构造原理与电子排布式
如:钠的电子排布式可简化为[Ne]3s1
上式方括号里的符号的意义是:
表示内层电子已达到稀有气体结构的部分
3.简化电子排布式
电子排布式可以简化
写出第8号元素氧、第14号元素硅和第29号元素铜的简化电子排布式吗?
Cu:[Ar]3d104s1
O:[He]2s22p4
Si:[Ne]3s23p2
一、构造原理与电子排布式
4.价层电子排布式
为突出化合价与电子排布的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)
如:铁的简化电子排布式为[Ar]3d64s2
铁的价层电子排布式为3d64s2
Na:3s1
查看元素周期表找出Na、Al、Cl、Mn、Br价层电子排布式
Al:3s2 3p1
Cl:3s2 3p5
Mn:3d5 4s2
Br:4s24p5
二、电子云与原子轨道
1.概率密度
1913年,波尔提出氢原子模型,电子在线性轨道上绕核运行
量子力学指出,一定空间运动状态的电子并不在玻尔假定的线性轨道上运行,而在核外空间各处都可能出现,但出现的概率不同,可以算出它们的概率密度分布。
P表示电子在某处出现的概率
V表示该处的体积
概率密度:ρ=
二、电子云与原子轨道
氢原子的1s电子在原子核外出现的概率分布图
小点是1s电子在原子核外出现外出现的概率密度的形象描述
小点越密,表明概率密度越大
二、电子云与原子轨道
由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称为电子云
2.电子云
电子云是处于一定空间运动状态的电子在原子核外空间的概率分布的形象化描述。
电子云图很难绘制,使用不便,我们常使用电子云轮廓图
电子云轮廓图的绘制过程
二、电子云与原子轨道
绘制电子云轮廓图的目的是表示 的形状,对核外电子的 有一个形象化的简便描述。绘制电子云轮廓图时,把电子在原子核外空间出现概率P= 的空间圈出来。
电子云轮廓
空间运动状态
90%
3.电子云轮廓图
二、电子云与原子轨道
(1)所有原子的任一能层 的s电子的电子云轮廓图都是一个球形 只是球的半径不同
同一原子的能层越高,s电子云半径越大
原因:由于电子能量依次增高,电子在离核更远的区域出现的概率增大,电子云越来越向更大的空间扩展
二、电子云与原子轨道
(2)p电子云的形状是哑铃状的,
有3个互向垂直电子云分别称为Px、Py、Pz
右下角x、y、z分别是p电子云在直角坐标系里的取向
二、电子云与原子轨道
二、电子云与原子轨道
二、电子云与原子轨道
4.原子轨道
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
ns能级各有 个轨道,np能级各有 个轨道,
nd能级各有 个轨道,nf能级各有 个轨道。
1
5
7
3
能层数 K L M N O P Q n
能级数 1 2 3 4 5 6 7
轨道数 1 4 9 16 25 36 49
n
n2
课后作业
THANK YOU
Asadal has been running one of the biggest domain and web hosting sites in Korea since March 1998. More than 3,000,000 people have.visited our website, www. for domain registration and web hosting
