人教版(五四制)九年级全一册化学 第三单元 课题2 酸和碱的中和反应 课件(共17张PPT)
文档属性
| 名称 | 人教版(五四制)九年级全一册化学 第三单元 课题2 酸和碱的中和反应 课件(共17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-25 00:00:00 | ||
图片预览





文档简介
(共17张PPT)
课题2 酸和碱的中和反应
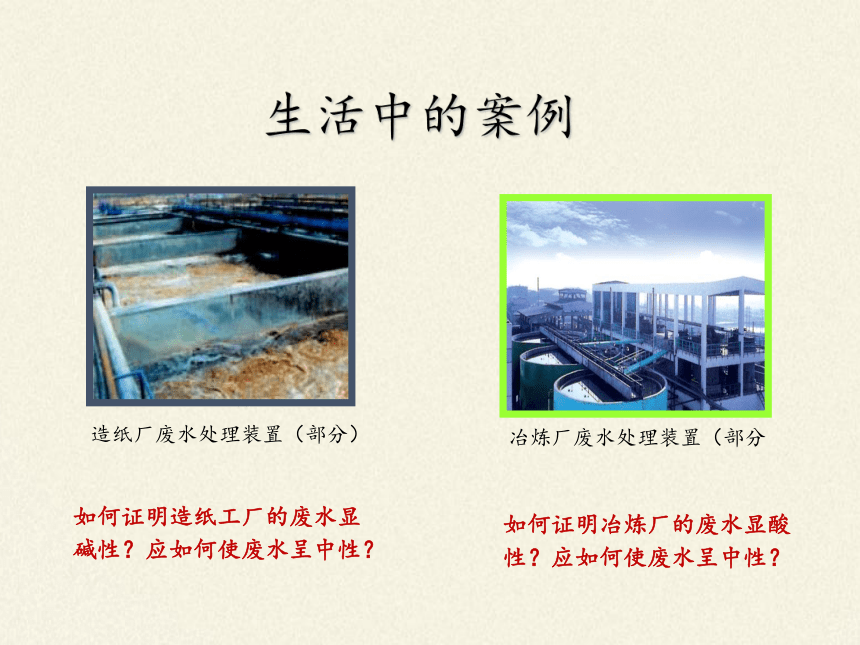
生活中的案例
造纸厂废水处理装置(部分)
冶炼厂废水处理装置(部分
如何证明造纸工厂的废水显碱性?应如何使废水呈中性?
如何证明冶炼厂的废水显酸性?应如何使废水呈中性?
第十单元 酸和碱
课题2 酸碱的中和反应(1)
提出问题:
酸与碱之间会发生反应吗
作出假设:
会反应
实验验证:
①稀盐酸与氢氧化钠溶液直接混合
观察现象:
②氢氧化钠溶液中滴加酚酞后,溶液变红,逐渐滴加稀盐酸,红色消失
得出结论:
稀盐酸与氢氧化钠发生发应
②借助指示剂,如先在氢氧化钠溶 液中滴加酚酞,再逐滴加酸
①无明显现象
该反应放热
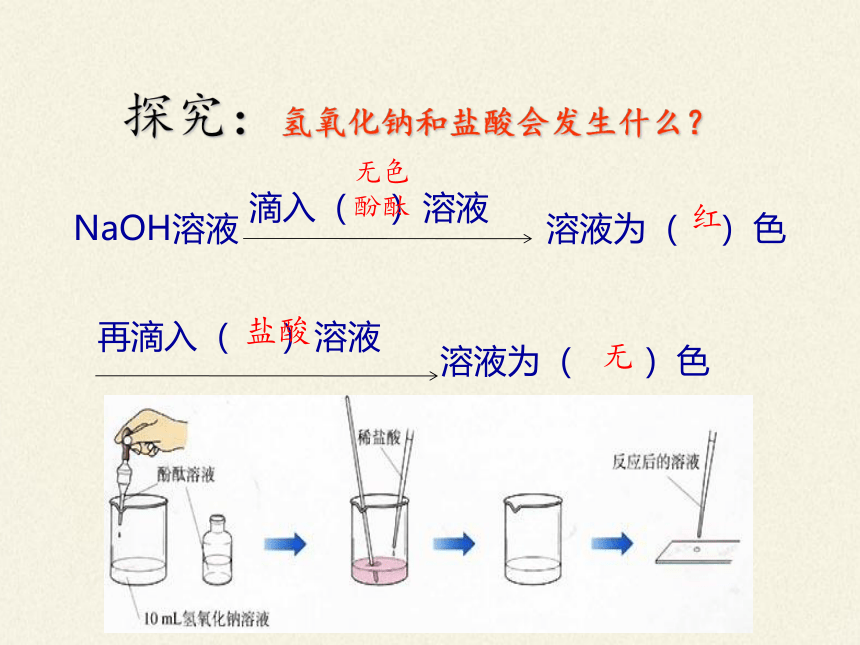
探究:氢氧化钠和盐酸会发生什么?
NaOH溶液
滴入( )溶液
溶液为( )色
再滴入( )溶液
溶液为( )色
无色酚酞
红
盐酸
无
讨论:
1.为什么要加入酚酞指示剂?
借以判断反应有无发生
2. 什么时候酸和碱恰好完全反应?
溶液刚好由红色变为无色
3.能否用紫色的石蕊作指示剂?现象
可以 溶液由蓝色变成紫色,继续加酸又变成红色
思考:
答:防止稀盐酸滴加过量。
答:起指示作用。因为NaOH与HCl反应无明显的现象发生,根据酚酞溶液由红色变为无色来判断NaOH和HCl是否反应完全。
2. 为什么在操作中必须逐滴滴入稀盐酸?
1. 酚酞在实验中起什么作用?
注意:
滴加盐酸至红色恰好变成无色时即止。否则盐酸过量。
为什么NaOH+HCl反应 生成什么
反应前后溶液中离子发生了怎样的变化
重新组合
微观世界
HCl + NaOH
NaCl + H2O
氢氧化钠与盐酸反应的本质:酸溶液中的氢离子和碱溶液中的氢氧根离子反应生成水的过程。
思考:氢氧化钠(碱)和稀盐酸(酸)反应,生成了什么?
NaOH + HCl = NaCl + H2O
碱
酸
水
盐
NaCl = Na+ + Cl-
注意:
这个“盐”是指一类物质,和平时说的“食盐”不同!
想一想:下列反应有何共同特点?
NaOH+HCl == NaCl + H2O
Ca(OH)2+2HCl==
CaCl2 + 2H2O
2NaOH + H2SO4==
Na2SO4 + 2H2O
金属离子
酸根离子
盐
盐:由金属离子(铵根离子NH4)和酸根离子组成的化合物
中和反应:酸和碱作用生成盐和水的反应
酸 + 碱 → 盐 + 水
中和反应的实质:
+
你认为判断一个反应是不是中和反应的关键是什么?举例说明。
讨论
反应物必须是
酸与碱
生成物必须是盐和水
例:H2SO4 + Cu(OH)2 = CuSO4+2H2O
练一练
1.下列反应中属于中和反应的是( )
A.Zn + 2HCl ZnCl2 +H2↑
B.CuO + 2HCl CuCl2+ H2O
C.Ba(OH)2+ H2SO4 BaSO4 ↓+ 2H2O
D. AgNO3+HCl AgCl↓ +HNO3
C
随堂练习
名称 氢氧化钠 硫酸 氧化铁
化学式 CuSO4
类别
2.下列物质属于盐的是( )
A CuO B Cu(OH)2 C CuSO4 D HCl
3.填写下表(类别按酸、碱、盐、氧化物填写)
C
NaOH
碱
硫酸铜
盐
H2SO4
酸
Fe2O3
氧化物
生活中的化学
用适量盐酸可以将热水瓶胆壁上的水垢[主要成分是Mg(OH)2和CaCO3]除去。说明去垢的原理,写出有关的化学方程式。
Mg(OH)2+2HCl=MgCl2+2H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
盐酸将不溶性的Mg(OH)2和CaCO3生成可溶性的氯化镁和氯化钙而便于洗去。
谢 谢
课题2 酸和碱的中和反应
生活中的案例
造纸厂废水处理装置(部分)
冶炼厂废水处理装置(部分
如何证明造纸工厂的废水显碱性?应如何使废水呈中性?
如何证明冶炼厂的废水显酸性?应如何使废水呈中性?
第十单元 酸和碱
课题2 酸碱的中和反应(1)
提出问题:
酸与碱之间会发生反应吗
作出假设:
会反应
实验验证:
①稀盐酸与氢氧化钠溶液直接混合
观察现象:
②氢氧化钠溶液中滴加酚酞后,溶液变红,逐渐滴加稀盐酸,红色消失
得出结论:
稀盐酸与氢氧化钠发生发应
②借助指示剂,如先在氢氧化钠溶 液中滴加酚酞,再逐滴加酸
①无明显现象
该反应放热
探究:氢氧化钠和盐酸会发生什么?
NaOH溶液
滴入( )溶液
溶液为( )色
再滴入( )溶液
溶液为( )色
无色酚酞
红
盐酸
无
讨论:
1.为什么要加入酚酞指示剂?
借以判断反应有无发生
2. 什么时候酸和碱恰好完全反应?
溶液刚好由红色变为无色
3.能否用紫色的石蕊作指示剂?现象
可以 溶液由蓝色变成紫色,继续加酸又变成红色
思考:
答:防止稀盐酸滴加过量。
答:起指示作用。因为NaOH与HCl反应无明显的现象发生,根据酚酞溶液由红色变为无色来判断NaOH和HCl是否反应完全。
2. 为什么在操作中必须逐滴滴入稀盐酸?
1. 酚酞在实验中起什么作用?
注意:
滴加盐酸至红色恰好变成无色时即止。否则盐酸过量。
为什么NaOH+HCl反应 生成什么
反应前后溶液中离子发生了怎样的变化
重新组合
微观世界
HCl + NaOH
NaCl + H2O
氢氧化钠与盐酸反应的本质:酸溶液中的氢离子和碱溶液中的氢氧根离子反应生成水的过程。
思考:氢氧化钠(碱)和稀盐酸(酸)反应,生成了什么?
NaOH + HCl = NaCl + H2O
碱
酸
水
盐
NaCl = Na+ + Cl-
注意:
这个“盐”是指一类物质,和平时说的“食盐”不同!
想一想:下列反应有何共同特点?
NaOH+HCl == NaCl + H2O
Ca(OH)2+2HCl==
CaCl2 + 2H2O
2NaOH + H2SO4==
Na2SO4 + 2H2O
金属离子
酸根离子
盐
盐:由金属离子(铵根离子NH4)和酸根离子组成的化合物
中和反应:酸和碱作用生成盐和水的反应
酸 + 碱 → 盐 + 水
中和反应的实质:
+
你认为判断一个反应是不是中和反应的关键是什么?举例说明。
讨论
反应物必须是
酸与碱
生成物必须是盐和水
例:H2SO4 + Cu(OH)2 = CuSO4+2H2O
练一练
1.下列反应中属于中和反应的是( )
A.Zn + 2HCl ZnCl2 +H2↑
B.CuO + 2HCl CuCl2+ H2O
C.Ba(OH)2+ H2SO4 BaSO4 ↓+ 2H2O
D. AgNO3+HCl AgCl↓ +HNO3
C
随堂练习
名称 氢氧化钠 硫酸 氧化铁
化学式 CuSO4
类别
2.下列物质属于盐的是( )
A CuO B Cu(OH)2 C CuSO4 D HCl
3.填写下表(类别按酸、碱、盐、氧化物填写)
C
NaOH
碱
硫酸铜
盐
H2SO4
酸
Fe2O3
氧化物
生活中的化学
用适量盐酸可以将热水瓶胆壁上的水垢[主要成分是Mg(OH)2和CaCO3]除去。说明去垢的原理,写出有关的化学方程式。
Mg(OH)2+2HCl=MgCl2+2H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
盐酸将不溶性的Mg(OH)2和CaCO3生成可溶性的氯化镁和氯化钙而便于洗去。
谢 谢
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
