2021-2022学年高一上学期化学苏教版(2019)必修第一册3.2.2碳酸钠和碳酸氢钠 课件
文档属性
| 名称 | 2021-2022学年高一上学期化学苏教版(2019)必修第一册3.2.2碳酸钠和碳酸氢钠 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-28 00:00:00 | ||
图片预览





文档简介
(共17张PPT)
碳酸钠和碳酸氢钠
碳酸钠的用途
碳酸氢钠的用途
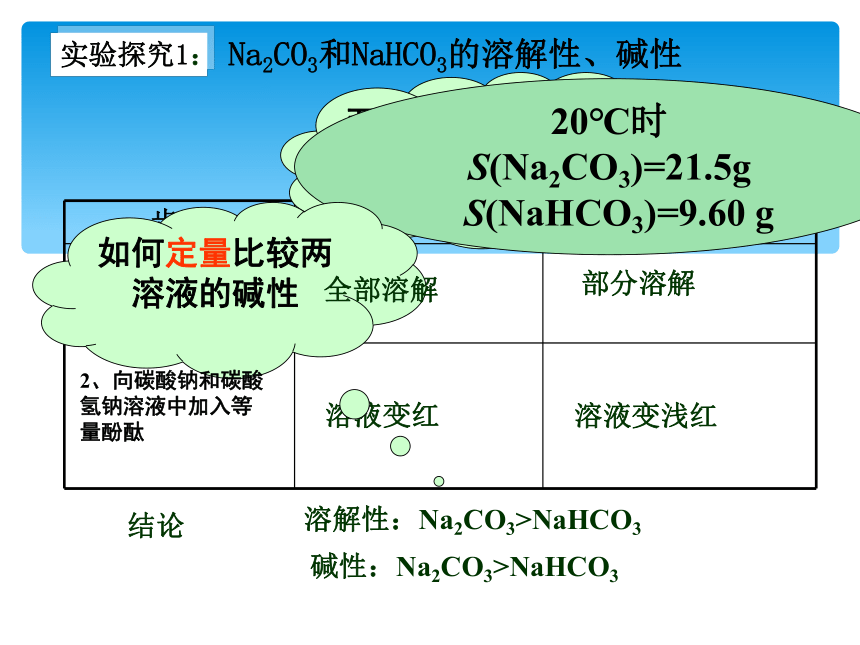
步骤 1药匙Na2CO3 1药匙 NaHCO3
1、分别加5毫升水
溶液变红
溶液变浅红
实验探究1:
Na2CO3和NaHCO3的溶解性、碱性
两者溶解性如何比较才确切?
20℃时
S(Na2CO3)=21.5g
S(NaHCO3)=9.60 g
如何定量比较两溶液的碱性
部分溶解
全部溶解
溶解性:Na2CO3>NaHCO3
碱性:Na2CO3>NaHCO3
结论
2、向碳酸钠和碳酸氢钠溶液中加入等量酚酞
碱性物质是油污的克星
厨房去油污,为什么建议使用碳酸钠而不是碳酸氢钠?
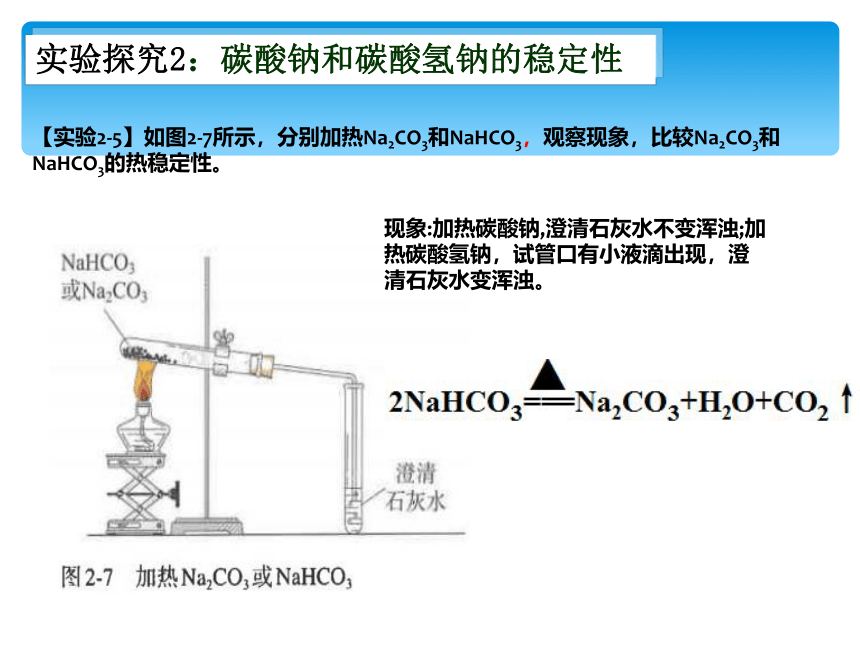
实验探究2:碳酸钠和碳酸氢钠的稳定性
现象:加热碳酸钠,澄清石灰水不变浑浊;加热碳酸氢钠,试管口有小液滴出现,澄清石灰水变浑浊。
【实验2-5】如图2-7所示,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
下图装置为本实验的改进装置“套管实验”,碳酸钠和碳酸氢钠可以对调吗?
不可以 。
*
*
Na2CO3和NaHCO3与盐酸的反应
实验探究3:
实验:分别往试管加入等量的NaHCO3 ,Na2CO3 中逐滴滴加稀HCl,观察现象
现象:往NaHCO3中滴入稀盐酸立即产生大量气泡
往Na2CO3中滴入稀盐酸先无气泡后有气泡
滴加盐酸
滴加盐酸
滴加盐酸
宏观
微观
CO32-
H+
HCO3-
2H+
H+
H2CO3
H2O+CO2
现象对比与微观解析
Na2CO3 + 2HCl = 2NaCl + CO2↑+ H2O
NaHCO3 + HCl = NaCl + CO2↑+ H2O
NaHCO3 + HCl = NaCl + CO2↑+ H2O
Na2CO3 分两步进行:
{
NaHCO3一步进行:
物质 类别 构成微粒
碳酸钠 钠盐
碳酸盐
正盐
Na+ 、CO32-
碳酸氢钠 钠盐
碳酸氢盐
酸式盐 Na+ 、HCO3-
[小结]:从微观角度认识Na2CO3与NaHCO3 性质上的异同
为什么治疗胃酸过多的药物选用NaHCO3,而不是 Na2CO3?
在中国化学工业史上,有一位杰出的科学家,他为祖国的化工事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是侯德榜。
侯德榜发明的侯氏制碱法的原理是将二氧化碳通入氨的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠从溶液中析出。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
过滤得到碳酸氢钠晶体,碳酸氢钠受热分解生成碳酸钠。
思考:怎样鉴别碳酸钠和碳酸氢钠?
⑴ 加热固体。产生能使石灰水变浑浊的无色气体的是NaHCO3 。
2NaHCO3 = Na2CO3 + H2O + CO2
△
(2) 在固体中加入相同浓度的盐酸,反应剧烈的是NaHCO3 。
(3) 利用与酸反应速率不同,用稀盐酸来鉴别。
(4)利用阴离子性质不同,用BaCl2(aq)或 CaCl2(aq)来鉴别。
小结
Na2CO3 NaHCO3
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小白色晶体
溶解性 Na2CO3:易溶 > NaHCO3:易溶
热稳定性 Na2CO3:稳定 > NaHCO3:不稳定
2NaHCO3=Na2CO3+CO2↑+H2O
碱性强弱 Na2CO3:碱性(温度越高碱性越强) > NaHCO3:碱性
与酸反应 Na2CO3:不剧烈 < NaHCO3:剧烈
2H++CO32-=CO2↑+H2O H++HCO3-=CO2↑+H2O
谢
谢
观
看
碳酸钠和碳酸氢钠
碳酸钠的用途
碳酸氢钠的用途
步骤 1药匙Na2CO3 1药匙 NaHCO3
1、分别加5毫升水
溶液变红
溶液变浅红
实验探究1:
Na2CO3和NaHCO3的溶解性、碱性
两者溶解性如何比较才确切?
20℃时
S(Na2CO3)=21.5g
S(NaHCO3)=9.60 g
如何定量比较两溶液的碱性
部分溶解
全部溶解
溶解性:Na2CO3>NaHCO3
碱性:Na2CO3>NaHCO3
结论
2、向碳酸钠和碳酸氢钠溶液中加入等量酚酞
碱性物质是油污的克星
厨房去油污,为什么建议使用碳酸钠而不是碳酸氢钠?
实验探究2:碳酸钠和碳酸氢钠的稳定性
现象:加热碳酸钠,澄清石灰水不变浑浊;加热碳酸氢钠,试管口有小液滴出现,澄清石灰水变浑浊。
【实验2-5】如图2-7所示,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
下图装置为本实验的改进装置“套管实验”,碳酸钠和碳酸氢钠可以对调吗?
不可以 。
*
*
Na2CO3和NaHCO3与盐酸的反应
实验探究3:
实验:分别往试管加入等量的NaHCO3 ,Na2CO3 中逐滴滴加稀HCl,观察现象
现象:往NaHCO3中滴入稀盐酸立即产生大量气泡
往Na2CO3中滴入稀盐酸先无气泡后有气泡
滴加盐酸
滴加盐酸
滴加盐酸
宏观
微观
CO32-
H+
HCO3-
2H+
H+
H2CO3
H2O+CO2
现象对比与微观解析
Na2CO3 + 2HCl = 2NaCl + CO2↑+ H2O
NaHCO3 + HCl = NaCl + CO2↑+ H2O
NaHCO3 + HCl = NaCl + CO2↑+ H2O
Na2CO3 分两步进行:
{
NaHCO3一步进行:
物质 类别 构成微粒
碳酸钠 钠盐
碳酸盐
正盐
Na+ 、CO32-
碳酸氢钠 钠盐
碳酸氢盐
酸式盐 Na+ 、HCO3-
[小结]:从微观角度认识Na2CO3与NaHCO3 性质上的异同
为什么治疗胃酸过多的药物选用NaHCO3,而不是 Na2CO3?
在中国化学工业史上,有一位杰出的科学家,他为祖国的化工事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是侯德榜。
侯德榜发明的侯氏制碱法的原理是将二氧化碳通入氨的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠从溶液中析出。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
过滤得到碳酸氢钠晶体,碳酸氢钠受热分解生成碳酸钠。
思考:怎样鉴别碳酸钠和碳酸氢钠?
⑴ 加热固体。产生能使石灰水变浑浊的无色气体的是NaHCO3 。
2NaHCO3 = Na2CO3 + H2O + CO2
△
(2) 在固体中加入相同浓度的盐酸,反应剧烈的是NaHCO3 。
(3) 利用与酸反应速率不同,用稀盐酸来鉴别。
(4)利用阴离子性质不同,用BaCl2(aq)或 CaCl2(aq)来鉴别。
小结
Na2CO3 NaHCO3
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小白色晶体
溶解性 Na2CO3:易溶 > NaHCO3:易溶
热稳定性 Na2CO3:稳定 > NaHCO3:不稳定
2NaHCO3=Na2CO3+CO2↑+H2O
碱性强弱 Na2CO3:碱性(温度越高碱性越强) > NaHCO3:碱性
与酸反应 Na2CO3:不剧烈 < NaHCO3:剧烈
2H++CO32-=CO2↑+H2O H++HCO3-=CO2↑+H2O
谢
谢
观
看
