化学反应原理绪言
图片预览








文档简介
(共22张PPT)
化学反应原理
1、化学研究的核心问题是:
2、化学中最具有创造性的工作是:
3、如何实现这个过程?
化学反应
设计和创造新的分子
通常是利用已发现的原理来进行设计并实现这个过程
4、我们必须弄清楚些什么才能使化学为人类服务?
对化学反应的原理要清楚
我们只有知道化学反应是怎样发生的,为什么有的反应快、有的反应慢,它遵循怎样的规律,如何控制化学反应才能为人所用!
这就是学习化学反应原理的目的
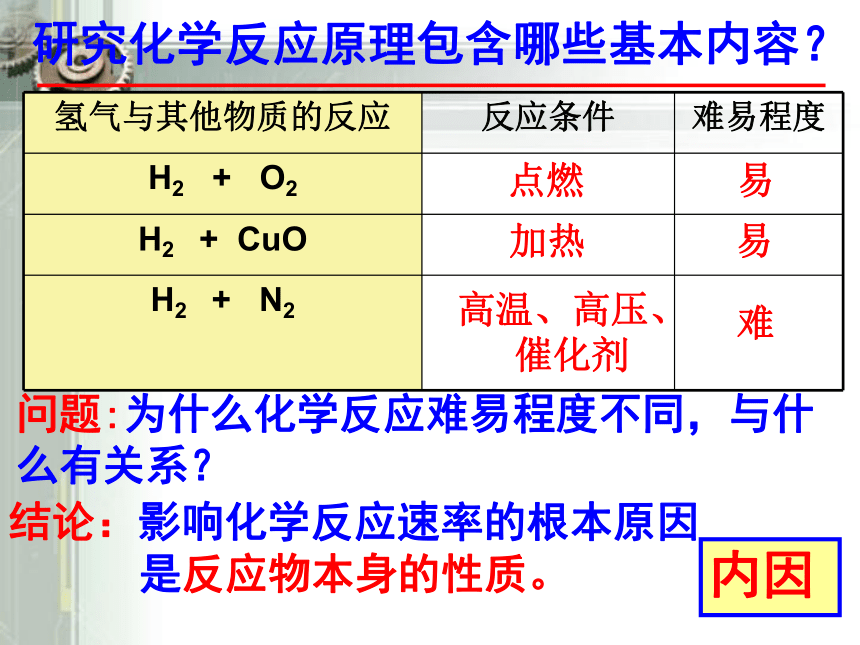
研究化学反应原理包含哪些基本内容?
氢气与其他物质的反应 反应条件 难易程度
H2 + O2
H2 + CuO
H2 + N2
问题:为什么化学反应难易程度不同,与什么有关系?
结论:影响化学反应速率的根本原因
是反应物本身的性质。
内因
点燃
加热
高温、高压、
催化剂
易
易
难
情景2
将H2 +O2混合,在室温条件下可以稳定
存在数百年,但点燃后却会发生剧烈的
爆炸反应,而且只要配比相当,可以完
全转化成生成物。这说明了什么?
不同的外界条件都能够
改变化学反应的速率。
结论:
情景3
H2+N2即使在高温、高压、催化剂的
条件下反应也不能完全转化为生成物,这又说明了什么?
有些反应是有一定限度的!
结论
如何来研究一个反应,研究化学反应原理的基本方法和思路是怎样?
——概念模型法
简化后的有效碰撞模型
简化后的有效碰撞模型
先认识几个概念:
1、有效碰撞
2、活化分子
3、活化能
4、催化剂
有 效 碰 撞
1、什么是有效碰撞?
引起分子间的化学反应的碰撞
结论:
分子间的碰撞是发生化学反应的必要条件
而有效碰撞是发生化学反应的充要条件
推论:
某一化学反应的速率大小与
单位时间内有效碰撞的次数有关
是否所有的分子都可以发生有效碰撞 能够发生化学反应与哪些因
素有关系?
问题:
活 化 分 子
2、什么是活化分子?
具有较高能量,能够发生有效碰撞的分子
结论:
发生有效碰撞的分子一定是活化分子,
但活化分子的碰撞不一定是有效碰撞。
推论:
有效碰撞次数的多少与
单位体积内反应物中活化分子
的多少有关。
某一化学反应的速率大小与单位时间内有效碰撞次数有关;而有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关;活化分子的多少又与什么有关?
问题:
活 化 能
3、什么是活化能?
活化分子高出反应物分子平均能量的部分
看图:
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
该反应是吸热反应还是放热反应
活化能与反应热有关吗
反应热
结论:
活化分子的多少与该反应的活化能的大小有关
推论:
活化能越小则一般分子成为活化分子越容易,
则活化分子越多,
则单位时间内有效碰撞越多,
则反应速率越快。
问题:
有没有活化能为“0”的反应?
H+ 和OH- 、Ag+和Cl-在水溶液中混合时,反应几乎都是在一瞬间完成的,其活化能接近于零。
归 纳 总 结
一个反应要发生一般要经历哪些过程?
普通
分子
活化
能
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
能量
解 释 问 题
1、为什么可燃物有氧气参与,还必
须达到着火点才能燃烧?
2、催化剂在我们技术改造和生产中
起关键作用,它主要作用是提高
化学反应速率,试想一下为什么
催化剂能提高反应速率?
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
随堂练习
1.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
2.发生有效碰撞的分子一定是活化分子
3.活化分子间的碰撞一定是有效碰撞
4.活化分子间每次碰撞都发生化学反应
5.能发生有效碰撞的分子必须具有相当高的能量
6.活化能指活化分子多出反应物分子平均能量的那部分能量
7.使用催化剂能改变分子的活化能
8.催化剂能使不起反应的物质间发生反应
化学反应原理
1、化学研究的核心问题是:
2、化学中最具有创造性的工作是:
3、如何实现这个过程?
化学反应
设计和创造新的分子
通常是利用已发现的原理来进行设计并实现这个过程
4、我们必须弄清楚些什么才能使化学为人类服务?
对化学反应的原理要清楚
我们只有知道化学反应是怎样发生的,为什么有的反应快、有的反应慢,它遵循怎样的规律,如何控制化学反应才能为人所用!
这就是学习化学反应原理的目的
研究化学反应原理包含哪些基本内容?
氢气与其他物质的反应 反应条件 难易程度
H2 + O2
H2 + CuO
H2 + N2
问题:为什么化学反应难易程度不同,与什么有关系?
结论:影响化学反应速率的根本原因
是反应物本身的性质。
内因
点燃
加热
高温、高压、
催化剂
易
易
难
情景2
将H2 +O2混合,在室温条件下可以稳定
存在数百年,但点燃后却会发生剧烈的
爆炸反应,而且只要配比相当,可以完
全转化成生成物。这说明了什么?
不同的外界条件都能够
改变化学反应的速率。
结论:
情景3
H2+N2即使在高温、高压、催化剂的
条件下反应也不能完全转化为生成物,这又说明了什么?
有些反应是有一定限度的!
结论
如何来研究一个反应,研究化学反应原理的基本方法和思路是怎样?
——概念模型法
简化后的有效碰撞模型
简化后的有效碰撞模型
先认识几个概念:
1、有效碰撞
2、活化分子
3、活化能
4、催化剂
有 效 碰 撞
1、什么是有效碰撞?
引起分子间的化学反应的碰撞
结论:
分子间的碰撞是发生化学反应的必要条件
而有效碰撞是发生化学反应的充要条件
推论:
某一化学反应的速率大小与
单位时间内有效碰撞的次数有关
是否所有的分子都可以发生有效碰撞 能够发生化学反应与哪些因
素有关系?
问题:
活 化 分 子
2、什么是活化分子?
具有较高能量,能够发生有效碰撞的分子
结论:
发生有效碰撞的分子一定是活化分子,
但活化分子的碰撞不一定是有效碰撞。
推论:
有效碰撞次数的多少与
单位体积内反应物中活化分子
的多少有关。
某一化学反应的速率大小与单位时间内有效碰撞次数有关;而有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关;活化分子的多少又与什么有关?
问题:
活 化 能
3、什么是活化能?
活化分子高出反应物分子平均能量的部分
看图:
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
该反应是吸热反应还是放热反应
活化能与反应热有关吗
反应热
结论:
活化分子的多少与该反应的活化能的大小有关
推论:
活化能越小则一般分子成为活化分子越容易,
则活化分子越多,
则单位时间内有效碰撞越多,
则反应速率越快。
问题:
有没有活化能为“0”的反应?
H+ 和OH- 、Ag+和Cl-在水溶液中混合时,反应几乎都是在一瞬间完成的,其活化能接近于零。
归 纳 总 结
一个反应要发生一般要经历哪些过程?
普通
分子
活化
能
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
能量
解 释 问 题
1、为什么可燃物有氧气参与,还必
须达到着火点才能燃烧?
2、催化剂在我们技术改造和生产中
起关键作用,它主要作用是提高
化学反应速率,试想一下为什么
催化剂能提高反应速率?
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
随堂练习
1.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
2.发生有效碰撞的分子一定是活化分子
3.活化分子间的碰撞一定是有效碰撞
4.活化分子间每次碰撞都发生化学反应
5.能发生有效碰撞的分子必须具有相当高的能量
6.活化能指活化分子多出反应物分子平均能量的那部分能量
7.使用催化剂能改变分子的活化能
8.催化剂能使不起反应的物质间发生反应
