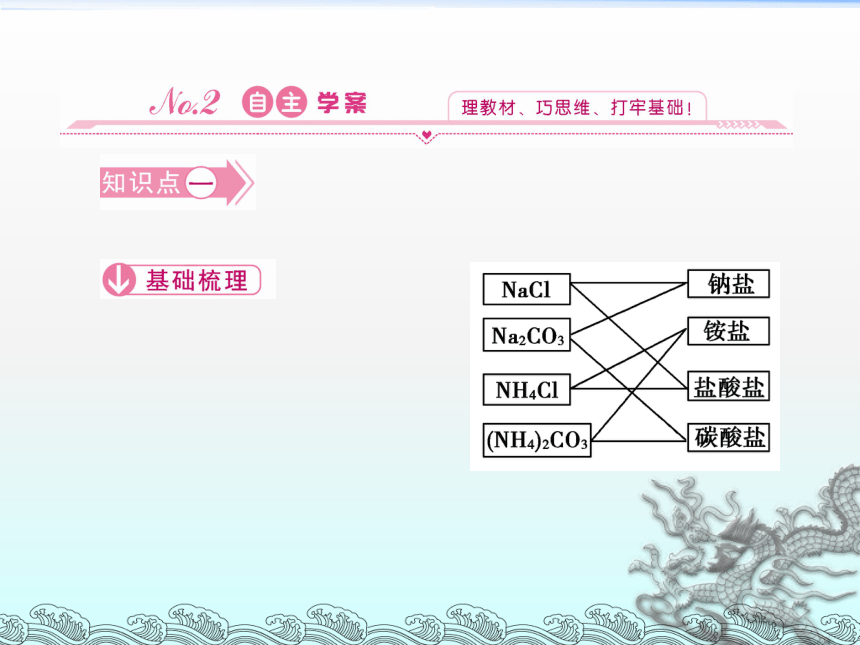
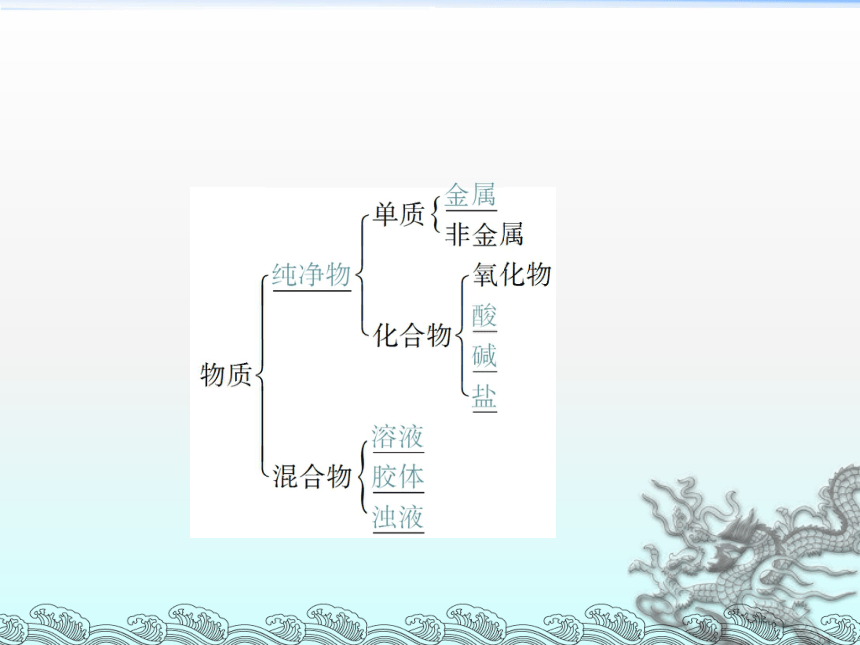
物质的分类
图片预览






文档简介
(共55张PPT)
2.1 物质的分类 课件(人教版必修1)
超市中的物品可谓成千上万、琳琅满目,可在超市购买东西时,为什么你能够迅速挑出自己所需要的商品?这是因为工作人员事先对它们进行了分类处理。化学中的物质是如何分类的呢?分类的依据是什么?
1.了解分类法的意义及分类方法。
2.了解分类法在化学中的应用,并实践对所学的化学物质和化学反应进行分类。
3.了解分散系的含义及分类。
4.掌握胶体的特性及其应用。
1.常见的分类方法
(1)交叉分类法:对物质
以不同的标准进行分类。
(2)树状分类法:对同类事物进行再分类。
2.分类法的应用
可以帮助我们更好地认识物质的性质,找出各类物质之间的关系。
①___________________,
②______________________,
③______________________________,
④_______________,
⑤_______________________,
⑥__________________________________。
2Ca+O2===2CaO
CaO+H2O===Ca(OH)2
Ca(OH)2+CO2===CaCO3↓+H2O
Ca(OH)2+H2CO3===CaCO3↓+2H2O
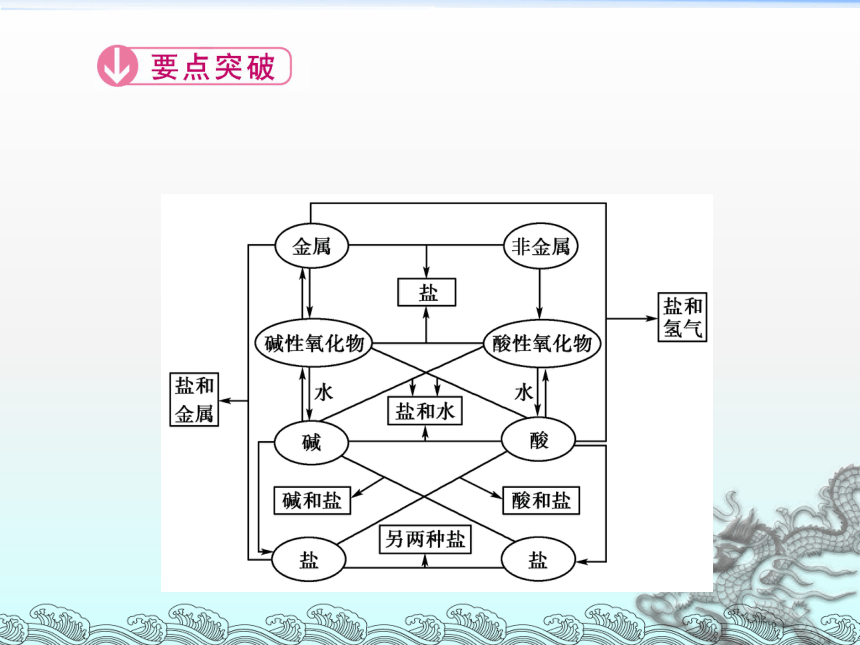
单质、氧化物、酸、碱和盐之间的相互关系
利用图表可以看出“氧化物的主要化学通性”
(1)酸性氧化物+水―→含氧酸
(2)酸性氧化物+碱―→盐+水
(3)酸性氧化物+碱性氧化物―→盐
(4)碱性氧化物+水―→碱
(5)碱性氧化物+酸―→盐+水
[温馨提示] 既要掌握物质所属类别的通性,还要掌握这种物质的特性。例如,酸与金属反应可以生成氢气和盐,这是一般规律,但并不是所有酸和金属的反应都产生H2;金属氧化物不都是碱性氧化物;碱性氧化物不都能与水反应生成相应的碱,如Fe2O3与H2O不反应。
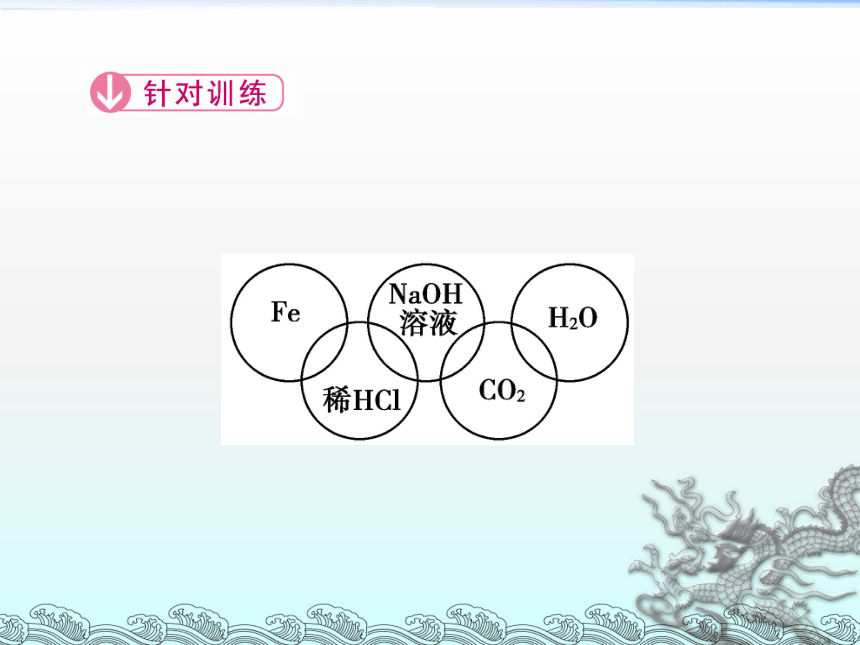
1.小美在奥运五连环中填入了5种物质(如图所示),相连环的物质间所发生的反应中,没有涉及的基本反应类型是( )
A.分解反应 B.复分解反应
C.化合反应 D.置换反应
解析: 题目中涉及的反应类型分别为Fe+2HCl===FeCl2+H2↑置换反应;HCl+NaOH===NaCl+H2O复分解反应;CO2+H2O===H2CO3化合反应。故答案为A。
答案: A
1.概念
把_____________物质分散在_____________ 物质中所得到的体系。
2.组成
(1)分散质:分散系中________的物质。
(2)分散剂:分散系中__________________的物 质。
一种(或多种)
另一种(或多种)
被分散
具有容纳分散质作用
3.分类
(1)以分散质和分散剂的状态为分类标准共分 为__种分散系:
(2)以分散质粒子大小为分类标准
①溶液:分散质粒子______________。
②胶体:分散质粒子_______________。
③浊液:分散质粒子_______________。
9
通常小于1 nm
1~100 nm之间
通常大于100 nm
4.胶体的制备和性质
(1)制备:Fe(OH)3胶体的制备
向____中逐滴加入5~6滴_____________,继 续煮沸至溶液呈____色,停止加热,得到的 分散系即为Fe(OH)3胶体。
沸水
FeCl3饱和溶液
红褐
(2)性质
①介稳性:胶体的稳定性介于____和____之间, 在一定条件下能稳定存在,属于_____体系。
②丁达尔效应
当光束通过胶体时,可以看到________________ ____,这是由于胶体粒子对光线_____形成的。 丁达尔效应可用来区分__________。
溶液
浊液
介稳
一条光亮的“通
路”
散射
胶体和溶液
③电泳现象
胶体微粒带电荷,胶体微粒在电场的作用下 发生定向移动。
④聚沉:胶体形成沉淀析出的现象。
其方法主要有:a._______________, b.____________________,c.___________。
加入电解质溶液
加入带相反电荷的胶粒
加热或搅拌
5.纳米科技的发展
纳米科技发展迅速,纳米粒子的大小与 _________大致相当,胶体化学原理和方 法有助于纳米科技的发展。
胶体粒子
溶液、胶体、浊液三类分散系的比较
分散系 溶液 胶体 浊液
悬浊液 乳浊液
分散质粒子大小 <1 nm 1~100nm >100 nm >100 nm
分散质
粒子结
构 分子、
离子 少量分子的集合体或大分子 大量分子聚集成的固体小颗粒 大量分子聚集成的液体小液滴
特点 均一
透明 多数均一透明,较稳定 不均一、不透明,久置沉淀 不均一、不透明,久置分层
稳定性 稳定 介稳性 不稳定 不稳定
能否透过滤纸 能 能 不能 不能
能否透过半透膜 能 不能 不能 不能
实例 食盐水、
蔗糖溶
液 Fe(OH)3胶体、淀粉溶液 泥水、
石灰乳 涂料、
油漆
[温馨提示] (1)分散质粒子大小不同是各种分散系的本质区别。
(2)胶体可透过滤纸但不能透过半透膜,因此可用过滤法分离胶体和浊液,用渗析法分离和提纯胶体。
(3)胶体具有介稳性的主要原因是分散质粒子带同种电荷而相互排斥,从而无法聚集成较大颗粒而聚沉。布朗运动也是胶体具有介稳性的原因之一。
2.下列有关胶体的叙述中不正确的是( )
A.实验室可用丁达尔效应鉴别胶体与溶液
B.豆浆制豆腐是利用了胶体聚沉的原理
C.氢氧化铁胶体微粒带正电,通电时胶体微粒向直流电源正极移动
D.分散质粒子大小在1~100 nm之间的分散系称为胶体
解析: 溶液中通电后,阳离子向直流电源负极移动,阴离子向正极移动。因Fe(OH)3胶体微粒带正电,故应向负极移动。
答案: C
无机化合物可根据其组成和性质进行分类,
(1)如图所示的物质分类方法名称是________。
(2)
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥后面的横线上。
(3)写出⑦转化为⑤的化学方程式:________________________________________________________________________。
(4)写出实验室由⑩制备O2的化学方程式:________________________________________________________________________。
(5)实验室制备⑦常用________和________反应,检验该气体的方法是________________________________________________________________________。
答案: (1)树状分类法
(2)②H2SO4(或HNO3或H2CO3均可)
③NaOH(或KOH)
⑥Na2SO4(或K2CO3或Na2SO3或NaNO3或KNO3或K2SO3)
(3)CO2+2NaOH===Na2CO3+H2O
(5)稀盐酸 大理石(或石灰石) 将气体通入澄清石灰水中,若石灰水变浑浊,即可证明气体是CO2
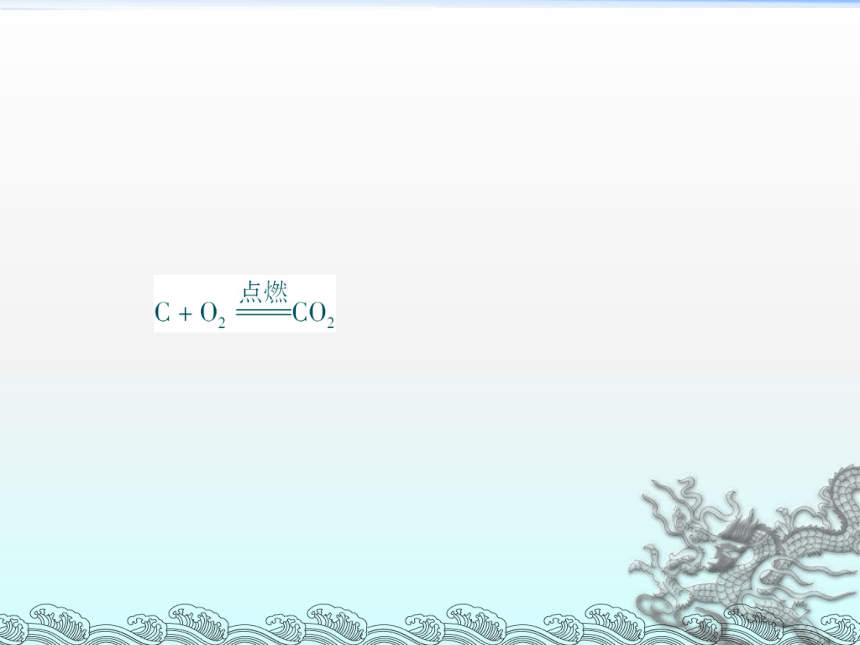
1.对下列化学反应进行分类:
(1)硫在氧气里燃烧。
(2)红磷在氧气里燃烧。
(3)铁丝在氧气里燃烧。
(4)锌与稀H2SO4反应。
(5)KClO3分解制氧气。
解析: 本题要求学生学会用简单分类法给化学反应分类。注意从不同角度进行分析。
答案:分类标准1.从四种基本反应类型看:(1)(2)(3)为化合反应,(4)为置换反应,(5)为分解反应。
分类标准2.从是否为燃烧反应看:(1)(2)(3)为燃烧反应。
分类标准3.从反应物特点看:(1)(2)为非金属与氧气反应,(3)为金属与氧气反应,(4)为金属与稀酸反应。
[思考感悟] (1)金属氧化物不一定是碱性氧化物,如Mn2O7等;
(2)非金属氧化物不一定是酸性氧化物,如CO、NO等;
(3)酸性氧化物不一定是非金属氧化物,如Mn2O7等。
下列事实与胶体性质无关的是( )
A.在豆浆里加入盐卤做豆腐
B.在河流入海处易形成沙洲
C.一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路
D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
解析: A项,属于蛋白质胶体遇电解质凝聚。B项,是土壤胶粒遇(海水中的)电解质发生凝聚。C项,是蛋白质胶体的丁达尔现象。D项,是一个化学反应:Fe3++3OH-===Fe(OH)3↓,此时生成的Fe(OH)3是大量的沉淀,而不属于胶体。
答案: D
[思考感悟] 胶体的性质及应用
性质 应用
丁达尔效应 区别溶液和胶体
电泳
现象 使用静电除尘器除去空气或工厂废气中的飘尘,以及微细的固体颗粒物;分离蛋白质、氨基酸;血清电泳用于诊断疾病等
胶体的聚沉 制豆腐、果冻、明矾净水等
2.下列叙述错误的是( )
A.胶体粒子的直径在1~100 nm之间
B.氢氧化铁胶体带电
C.可用渗析的方法分离淀粉和氯化钠的混合溶液
D.配制氢氧化铁胶体时,可将饱和FeCl3溶液滴入沸水中
解析: 胶体粒子直径在1~100 nm之间,这是胶体的本质特征;由于氢氧化铁胶粒能吸附阳离子而使氢氧化铁胶粒带正电,而整个胶体不带电;由于胶体粒子不能透过半透膜,溶液中的小分子、离子能透过半透膜,可用此方法分离淀粉胶体和氯化钠溶液;配制Fe(OH)3胶体的方法是将饱和FeCl3溶液滴入沸水中加热至溶液呈红褐色为止。
答案: B
热点实验 胶体的制备和性质
[探究举例] 取少量Fe2O3粉末(红棕色)加入适量盐酸,所发生反应的化学方程式为______________________________,反应后得到的FeCl3溶液呈棕黄色。用此溶液进行以下实验:
(1)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为____________________________
____________,此反应属于________反应。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈________色,即可制得Fe(OH)3胶体。
(3)取另一小烧杯也加入20 mL蒸馏水后,向烧杯中加入1 mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置在暗处:分别用激光笔照射杯中的液体,可以看到________烧杯中的液体会产生丁达尔效应。这个实验可以用来检验区别______________。
解析: Fe2O3与盐酸反应生成FeCl3和H2O,FeCl3与NaOH发生复分解反应生成Fe(OH)3沉淀和NaCl;向沸水中滴入FeCl3溶液生成Fe(OH)3胶体;胶体具有丁达尔效应。
答案: Fe2O3+6HCl===2FeCl3+3H2O
(1)FeCl3+3NaOH===Fe(OH)3↓+3NaCl 复分解
(2)红褐 (3)乙 溶液和胶体
1.下列物质中,前者属于纯净物,后者属于混合物的是( )
A.净化后的空气;氧化镁
B.水和冰混合;澄清石灰水
C.生锈的铁钉;高锰酸钾充分加热后的剩余固体
D.氯化钾;液氧
解析: 水和冰属于同种物质不同状态,是纯净物。
答案: B
2.按单质、氧化物、酸、碱、盐分类,下列各组物质中,两种物质类别相同的是( )
A.氧气、氧化镁
B.硫酸铜、氯化钠
C.硫酸、碳酸钠
D.硝酸银、氢氧化钠
解析: 氧气是单质、氧化镁是氧化物;硫酸是酸,氢氧化钠是碱;硫酸铜、氯化钠、碳酸钠、硝酸银均是盐。
答案: B
3.下列家庭小实验不能制得溶液的是( )
解析: 食盐、蔗糖溶于水得到溶液,分散质(溶质)粒子分别是Na+、Cl-和蔗糖分子。泥土加入水中得到悬浊液。植物油溶于汽油得到溶液。
答案: B
4.(聊城实验中学月考)Fe(OH)3胶体区别于FeCl3溶液最本质的特点是( )
A.Fe(OH)3胶体粒子的大小在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一、稳定的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
解析: 胶体和溶液、浊液的最本质区别是胶体粒子大小在1~100 nm之间。
答案: A
5.丁达尔效应是区分胶体与溶液的一种最常用的方法。
(1)如图是在实验室中进行氢氧化铁胶体丁达尔效应实验的示意图,该图中有一处明显错误是__________________________________
____________________________________,原因是________________________。(试从分散系的分类进行讨论说明)
(2)欲在树林中观察到丁达尔效应,你认为一天中最有可能观察到该现象的时间是________,理由是______________________
_____________________________________。
(3)去树林观察丁达尔效应有诸多不便,聪明的你想出了许多在家里看到丁达尔效应的方法,其中最简单、最环保的方法是:
________________________________________________________________________。
解析: (1)进入烧杯前,光穿过的空气是溶液,不是胶体,不会产生丁达尔效应,所以该图中的明显错误是空气中也出现了光柱。
(2)清晨,树林中存在水雾,阳光透过树叶间隙形成光束,穿过这些水雾会产生丁达尔效应,所以一天中最有可能观察到该现象的时间是清晨。
(3)打开暖瓶(加热水)让水汽升腾起来,用一束光照射即可。
答案: (1)空气中也出现了光柱 进入烧杯前,光穿过的空气是溶液,不是胶体,不会产生丁达尔效应
(2)清晨 清晨树林中存在水雾,雾是胶体,阳光透过树叶间隙形成光束,穿过这些水雾会产生丁达尔效应
(3)打开暖瓶(加热水)让水汽升腾起来,用一束光照射即可
2.1 物质的分类 课件(人教版必修1)
超市中的物品可谓成千上万、琳琅满目,可在超市购买东西时,为什么你能够迅速挑出自己所需要的商品?这是因为工作人员事先对它们进行了分类处理。化学中的物质是如何分类的呢?分类的依据是什么?
1.了解分类法的意义及分类方法。
2.了解分类法在化学中的应用,并实践对所学的化学物质和化学反应进行分类。
3.了解分散系的含义及分类。
4.掌握胶体的特性及其应用。
1.常见的分类方法
(1)交叉分类法:对物质
以不同的标准进行分类。
(2)树状分类法:对同类事物进行再分类。
2.分类法的应用
可以帮助我们更好地认识物质的性质,找出各类物质之间的关系。
①___________________,
②______________________,
③______________________________,
④_______________,
⑤_______________________,
⑥__________________________________。
2Ca+O2===2CaO
CaO+H2O===Ca(OH)2
Ca(OH)2+CO2===CaCO3↓+H2O
Ca(OH)2+H2CO3===CaCO3↓+2H2O
单质、氧化物、酸、碱和盐之间的相互关系
利用图表可以看出“氧化物的主要化学通性”
(1)酸性氧化物+水―→含氧酸
(2)酸性氧化物+碱―→盐+水
(3)酸性氧化物+碱性氧化物―→盐
(4)碱性氧化物+水―→碱
(5)碱性氧化物+酸―→盐+水
[温馨提示] 既要掌握物质所属类别的通性,还要掌握这种物质的特性。例如,酸与金属反应可以生成氢气和盐,这是一般规律,但并不是所有酸和金属的反应都产生H2;金属氧化物不都是碱性氧化物;碱性氧化物不都能与水反应生成相应的碱,如Fe2O3与H2O不反应。
1.小美在奥运五连环中填入了5种物质(如图所示),相连环的物质间所发生的反应中,没有涉及的基本反应类型是( )
A.分解反应 B.复分解反应
C.化合反应 D.置换反应
解析: 题目中涉及的反应类型分别为Fe+2HCl===FeCl2+H2↑置换反应;HCl+NaOH===NaCl+H2O复分解反应;CO2+H2O===H2CO3化合反应。故答案为A。
答案: A
1.概念
把_____________物质分散在_____________ 物质中所得到的体系。
2.组成
(1)分散质:分散系中________的物质。
(2)分散剂:分散系中__________________的物 质。
一种(或多种)
另一种(或多种)
被分散
具有容纳分散质作用
3.分类
(1)以分散质和分散剂的状态为分类标准共分 为__种分散系:
(2)以分散质粒子大小为分类标准
①溶液:分散质粒子______________。
②胶体:分散质粒子_______________。
③浊液:分散质粒子_______________。
9
通常小于1 nm
1~100 nm之间
通常大于100 nm
4.胶体的制备和性质
(1)制备:Fe(OH)3胶体的制备
向____中逐滴加入5~6滴_____________,继 续煮沸至溶液呈____色,停止加热,得到的 分散系即为Fe(OH)3胶体。
沸水
FeCl3饱和溶液
红褐
(2)性质
①介稳性:胶体的稳定性介于____和____之间, 在一定条件下能稳定存在,属于_____体系。
②丁达尔效应
当光束通过胶体时,可以看到________________ ____,这是由于胶体粒子对光线_____形成的。 丁达尔效应可用来区分__________。
溶液
浊液
介稳
一条光亮的“通
路”
散射
胶体和溶液
③电泳现象
胶体微粒带电荷,胶体微粒在电场的作用下 发生定向移动。
④聚沉:胶体形成沉淀析出的现象。
其方法主要有:a._______________, b.____________________,c.___________。
加入电解质溶液
加入带相反电荷的胶粒
加热或搅拌
5.纳米科技的发展
纳米科技发展迅速,纳米粒子的大小与 _________大致相当,胶体化学原理和方 法有助于纳米科技的发展。
胶体粒子
溶液、胶体、浊液三类分散系的比较
分散系 溶液 胶体 浊液
悬浊液 乳浊液
分散质粒子大小 <1 nm 1~100nm >100 nm >100 nm
分散质
粒子结
构 分子、
离子 少量分子的集合体或大分子 大量分子聚集成的固体小颗粒 大量分子聚集成的液体小液滴
特点 均一
透明 多数均一透明,较稳定 不均一、不透明,久置沉淀 不均一、不透明,久置分层
稳定性 稳定 介稳性 不稳定 不稳定
能否透过滤纸 能 能 不能 不能
能否透过半透膜 能 不能 不能 不能
实例 食盐水、
蔗糖溶
液 Fe(OH)3胶体、淀粉溶液 泥水、
石灰乳 涂料、
油漆
[温馨提示] (1)分散质粒子大小不同是各种分散系的本质区别。
(2)胶体可透过滤纸但不能透过半透膜,因此可用过滤法分离胶体和浊液,用渗析法分离和提纯胶体。
(3)胶体具有介稳性的主要原因是分散质粒子带同种电荷而相互排斥,从而无法聚集成较大颗粒而聚沉。布朗运动也是胶体具有介稳性的原因之一。
2.下列有关胶体的叙述中不正确的是( )
A.实验室可用丁达尔效应鉴别胶体与溶液
B.豆浆制豆腐是利用了胶体聚沉的原理
C.氢氧化铁胶体微粒带正电,通电时胶体微粒向直流电源正极移动
D.分散质粒子大小在1~100 nm之间的分散系称为胶体
解析: 溶液中通电后,阳离子向直流电源负极移动,阴离子向正极移动。因Fe(OH)3胶体微粒带正电,故应向负极移动。
答案: C
无机化合物可根据其组成和性质进行分类,
(1)如图所示的物质分类方法名称是________。
(2)
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥后面的横线上。
(3)写出⑦转化为⑤的化学方程式:________________________________________________________________________。
(4)写出实验室由⑩制备O2的化学方程式:________________________________________________________________________。
(5)实验室制备⑦常用________和________反应,检验该气体的方法是________________________________________________________________________。
答案: (1)树状分类法
(2)②H2SO4(或HNO3或H2CO3均可)
③NaOH(或KOH)
⑥Na2SO4(或K2CO3或Na2SO3或NaNO3或KNO3或K2SO3)
(3)CO2+2NaOH===Na2CO3+H2O
(5)稀盐酸 大理石(或石灰石) 将气体通入澄清石灰水中,若石灰水变浑浊,即可证明气体是CO2
1.对下列化学反应进行分类:
(1)硫在氧气里燃烧。
(2)红磷在氧气里燃烧。
(3)铁丝在氧气里燃烧。
(4)锌与稀H2SO4反应。
(5)KClO3分解制氧气。
解析: 本题要求学生学会用简单分类法给化学反应分类。注意从不同角度进行分析。
答案:分类标准1.从四种基本反应类型看:(1)(2)(3)为化合反应,(4)为置换反应,(5)为分解反应。
分类标准2.从是否为燃烧反应看:(1)(2)(3)为燃烧反应。
分类标准3.从反应物特点看:(1)(2)为非金属与氧气反应,(3)为金属与氧气反应,(4)为金属与稀酸反应。
[思考感悟] (1)金属氧化物不一定是碱性氧化物,如Mn2O7等;
(2)非金属氧化物不一定是酸性氧化物,如CO、NO等;
(3)酸性氧化物不一定是非金属氧化物,如Mn2O7等。
下列事实与胶体性质无关的是( )
A.在豆浆里加入盐卤做豆腐
B.在河流入海处易形成沙洲
C.一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路
D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
解析: A项,属于蛋白质胶体遇电解质凝聚。B项,是土壤胶粒遇(海水中的)电解质发生凝聚。C项,是蛋白质胶体的丁达尔现象。D项,是一个化学反应:Fe3++3OH-===Fe(OH)3↓,此时生成的Fe(OH)3是大量的沉淀,而不属于胶体。
答案: D
[思考感悟] 胶体的性质及应用
性质 应用
丁达尔效应 区别溶液和胶体
电泳
现象 使用静电除尘器除去空气或工厂废气中的飘尘,以及微细的固体颗粒物;分离蛋白质、氨基酸;血清电泳用于诊断疾病等
胶体的聚沉 制豆腐、果冻、明矾净水等
2.下列叙述错误的是( )
A.胶体粒子的直径在1~100 nm之间
B.氢氧化铁胶体带电
C.可用渗析的方法分离淀粉和氯化钠的混合溶液
D.配制氢氧化铁胶体时,可将饱和FeCl3溶液滴入沸水中
解析: 胶体粒子直径在1~100 nm之间,这是胶体的本质特征;由于氢氧化铁胶粒能吸附阳离子而使氢氧化铁胶粒带正电,而整个胶体不带电;由于胶体粒子不能透过半透膜,溶液中的小分子、离子能透过半透膜,可用此方法分离淀粉胶体和氯化钠溶液;配制Fe(OH)3胶体的方法是将饱和FeCl3溶液滴入沸水中加热至溶液呈红褐色为止。
答案: B
热点实验 胶体的制备和性质
[探究举例] 取少量Fe2O3粉末(红棕色)加入适量盐酸,所发生反应的化学方程式为______________________________,反应后得到的FeCl3溶液呈棕黄色。用此溶液进行以下实验:
(1)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为____________________________
____________,此反应属于________反应。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈________色,即可制得Fe(OH)3胶体。
(3)取另一小烧杯也加入20 mL蒸馏水后,向烧杯中加入1 mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置在暗处:分别用激光笔照射杯中的液体,可以看到________烧杯中的液体会产生丁达尔效应。这个实验可以用来检验区别______________。
解析: Fe2O3与盐酸反应生成FeCl3和H2O,FeCl3与NaOH发生复分解反应生成Fe(OH)3沉淀和NaCl;向沸水中滴入FeCl3溶液生成Fe(OH)3胶体;胶体具有丁达尔效应。
答案: Fe2O3+6HCl===2FeCl3+3H2O
(1)FeCl3+3NaOH===Fe(OH)3↓+3NaCl 复分解
(2)红褐 (3)乙 溶液和胶体
1.下列物质中,前者属于纯净物,后者属于混合物的是( )
A.净化后的空气;氧化镁
B.水和冰混合;澄清石灰水
C.生锈的铁钉;高锰酸钾充分加热后的剩余固体
D.氯化钾;液氧
解析: 水和冰属于同种物质不同状态,是纯净物。
答案: B
2.按单质、氧化物、酸、碱、盐分类,下列各组物质中,两种物质类别相同的是( )
A.氧气、氧化镁
B.硫酸铜、氯化钠
C.硫酸、碳酸钠
D.硝酸银、氢氧化钠
解析: 氧气是单质、氧化镁是氧化物;硫酸是酸,氢氧化钠是碱;硫酸铜、氯化钠、碳酸钠、硝酸银均是盐。
答案: B
3.下列家庭小实验不能制得溶液的是( )
解析: 食盐、蔗糖溶于水得到溶液,分散质(溶质)粒子分别是Na+、Cl-和蔗糖分子。泥土加入水中得到悬浊液。植物油溶于汽油得到溶液。
答案: B
4.(聊城实验中学月考)Fe(OH)3胶体区别于FeCl3溶液最本质的特点是( )
A.Fe(OH)3胶体粒子的大小在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一、稳定的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
解析: 胶体和溶液、浊液的最本质区别是胶体粒子大小在1~100 nm之间。
答案: A
5.丁达尔效应是区分胶体与溶液的一种最常用的方法。
(1)如图是在实验室中进行氢氧化铁胶体丁达尔效应实验的示意图,该图中有一处明显错误是__________________________________
____________________________________,原因是________________________。(试从分散系的分类进行讨论说明)
(2)欲在树林中观察到丁达尔效应,你认为一天中最有可能观察到该现象的时间是________,理由是______________________
_____________________________________。
(3)去树林观察丁达尔效应有诸多不便,聪明的你想出了许多在家里看到丁达尔效应的方法,其中最简单、最环保的方法是:
________________________________________________________________________。
解析: (1)进入烧杯前,光穿过的空气是溶液,不是胶体,不会产生丁达尔效应,所以该图中的明显错误是空气中也出现了光柱。
(2)清晨,树林中存在水雾,阳光透过树叶间隙形成光束,穿过这些水雾会产生丁达尔效应,所以一天中最有可能观察到该现象的时间是清晨。
(3)打开暖瓶(加热水)让水汽升腾起来,用一束光照射即可。
答案: (1)空气中也出现了光柱 进入烧杯前,光穿过的空气是溶液,不是胶体,不会产生丁达尔效应
(2)清晨 清晨树林中存在水雾,雾是胶体,阳光透过树叶间隙形成光束,穿过这些水雾会产生丁达尔效应
(3)打开暖瓶(加热水)让水汽升腾起来,用一束光照射即可
